不同负荷游泳运动对PM2.5暴露运动大鼠肝脏TNF-α、PPAR-γ蛋白表达的影响
许磊,汪子铮,牛亦博
(1.山西财经大学体育学院,山西 太原030006;2. 山西省体育科学研究所,山西 太原030012;3.中国铁路太原局集团有限公司,山西 太原030009)
PM2.5是大气污染主要来源,日渐受到研究者的重视。现代研究表明,PM2.5暴露给机体带来多器官的损伤,肝脏是重要的代谢器官,参与并维护机体的日常工作,对于肝脏损伤的进一步研究得出,PM2.5可导致心脏和肝脏一定程度的氧化损伤[1],同时PM2.5暴露会损害肝脏的葡萄糖代谢,会导致脾脏、肝脏出现炎症损伤[2]。PPAR是配体活化型核转录因子,也是一种新的甾体激素类受体,参与免疫反应和脂类代谢调控[3]。PPAR-γ具有调节脂肪细胞基因表达,糖、脂代谢平衡和胰岛素细胞间信号传递等功能,在脂类代谢和机体内环境动态平衡过程中的主要调节者[4]。Kawakami等[5]于1982年发现脂肪组织肿瘤坏死因子(TNF-α),该肿瘤坏死因子可抑制脂肪组织的蛋白合成[6],同时该物质能够直接杀伤肿瘤细胞而对正常细胞无明显毒性[7]。肝脏是TNF-α的一个重要靶向器官,可促进肝细胞坏死,同时可降低胰岛素受体活性,增多游离脂肪酸(nonesterified fatty acid, NEFA),并与细胞膜上受体结合,直接参与肝脏脂肪代谢,降低甘油三酯(triglyceride, TG),增加胰岛素抵抗[8]。本研究通过不同负荷游泳训练模式,结合肝脏的甘油三酯(triglyceride, TG)及NEFA数据,探讨PM2.5暴露下运动大鼠肝脏蛋白表达功能,为PM2.5暴露环境下有氧运动对肝脏功能的影响提供理论依据。
1 材料和方法
1.1 动物
普通级雄性SD大鼠40只,体质量230~260 g,由华阜康物生物科技股份有限责任公司(北京)提供,生产许可证号为SCXK(京)2014-0004,检疫合格。
1.2 试剂
甘油三酯(TG)测定试剂盒(100 管/96 样);游离脂肪酸(NEFA)测试盒(96T);大鼠肿瘤坏死因子-α(TNF-α)酶联免疫检测试剂盒;过化物酶体增殖物激活受体(PPAR-γ)Western blot检测试剂盒。试剂盒全部购置于南京建成生物工程研究所。
1.3 方法
1.3.1 动物分组及模型制备 将实验大鼠,采用随机数字表法分为4组:PM2.5暴露组(E)、PM2.5暴露低负荷组(LES,负荷体质量3%)、PM2.5暴露中负荷组(MES,负荷体质量6%)、PM2.5暴露高负荷组(HES,负荷体质量9%)。对运动组大鼠采用游泳训练方式9周,每周运动6 d,休息1 d,每次运动60 min。
1.3.2 标本的采集 通过流量采样器,高于水平面12 m左右,持续35 d采样。
1.3.3 采用GPO-PAP法测定TG,微板法测定NEFA 甘油三酯(TG)测定试剂盒(100管/96样);游离脂肪酸(FFA)测试盒(96T),测试全过程严格按照试剂盒说明书完成。
1.3.4 大气细颗粒物收集和染毒实验 使用流量采样器,持续30 d/24 h。气管滴注对动物进行染毒,每kg体质量气管滴注量为6 mg,染毒后游泳训练,期间禁食禁水。
1.3.5 ELISA法检测大鼠肝脏匀浆中肿瘤坏死因子(TNF-α)表达水平 将冷冻大鼠肝脏组织融解至4 ℃,与PBS混合后使用匀浆器研磨匀浆,2 000~3 000 r/min,离心15 min左右,收集上清液,在提前稀释好的标准品中加入样品与生物素抗原工作液,轻摇后盖上封板膜,放于37 ℃培养箱中孵育55 min。3次洗涤之后,揭掉封板膜,先后加入显色剂A、B,摇均后放于37 ℃避光显色10 min。立刻以空白孔调零,测试吸光度,之后进行计算得出数据。测试全过程严格按照试剂盒说明书完成。
1.3.6 Western blot检测过化物酶体增殖物激活受体(PPAR-γ)蛋白表达 随机挑取大鼠肝脏组织2个,进行蛋白提取,然后进行预实验,显示有阳性条带,之后开展正式实验。对大鼠肝脏提取组织蛋白,经SDS-PAGE完成分离蛋白后将PPAR-γ通过湿式电转印方法转移至PVDF膜上;冲洗膜上剩余转膜液,用巴斯特吸管吸尽洗涤液,加入封闭液,放于摇床上缓慢摇动;按比例用封闭液稀释一抗4 ℃在侧摆摇床上缓慢摇动孵育过夜;TBST洗膜3次,加入二抗4 ℃缓慢摇动孵育3 h,TBST洗膜3次;于暗室中将膜片平铺,滴加ECL工作液使其将膜片完全覆盖,孵育2~3 min,ECL发光显色,凝胶成像系统扫描分析,所用PPAR-γ的mRNA引物分别为美国Applied Biosystems 公司的Mm01135197_m1。目的基因的mRNA信号通过与核糖体18S RNA信号的比值为相对值,即可得到实验组的相对定量值。测试全过程严格按照试剂盒说明书完成。
1.4 统计学处理
实验采用SPSS19.0数据分析软件进行统计分析。计量资料用均数±标准差(Mean±SD)表示,各组均数间比较用ANOVA方法进行检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 PM2.5暴露及不同运动负荷游泳运动对肝脏NEFA及TG含量的影响
实验数据显示,与暴露组相比,暴露中负荷组、暴露高负荷组肝脏TG含量明显降低(P<0.05),而暴露低负荷组与暴露组比较无显著统计学差异;NEFA测试结果指出,同样暴露中负荷组、暴露高负荷组肝脏TG含量明显降低(P<0.05),而暴露低负荷组于暴露组比较无显著统计学差异,见表1。
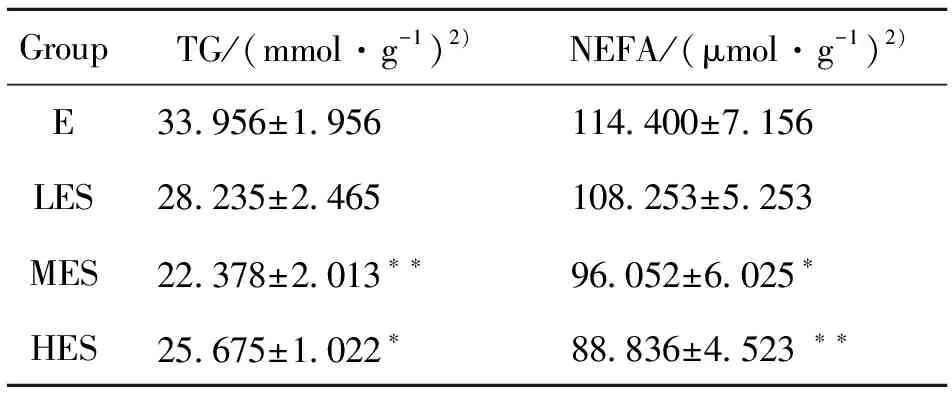
表1 PM2.5暴露及不同运动负荷游泳运动对肝脏NEFA及TG含量的影响(Mean±SD,n=10)1)Table 1 Effects of PM2.5 exposure and swimming exercise with different exercise loads on NEFA and TG content in liver(Mean±SD,n=10)
2.2 肝脏TNF-α含量
ELISA结果显示,于暴露组相比,暴露中负荷组肝脏TNF-α含量明显降低(P<0.01),但暴露高负荷组的肝脏TNF-α含量高于暴露组(P<0.05),而暴露低负荷组于暴露组比较无显著统计学差异,见表2。通过不同负荷游泳训练大鼠肝脏TNF-α对比发现,暴露中负荷组对比暴露低负荷组,TNF-α含量显著降低;而暴露高负荷组对比暴露低负荷组,TNF-α含量显著升高。肝脏内TNF-α含量的变化可能与运动强度有关,表明大强度负荷可增加体内炎症反应,见图1。
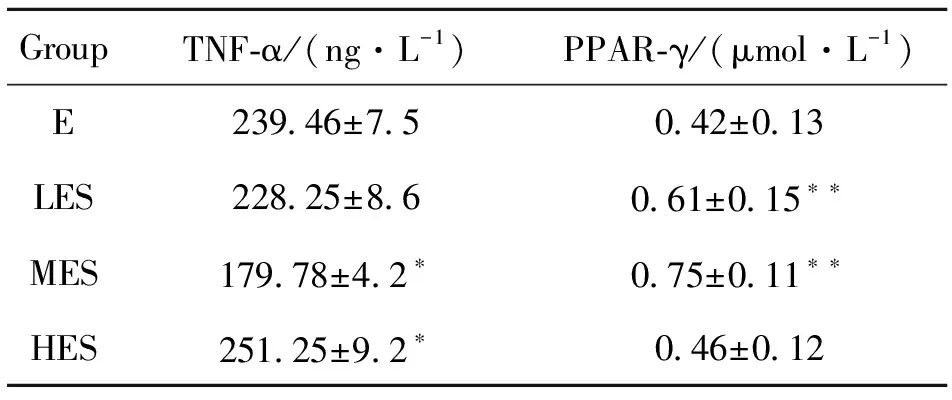
表2 PM2.5暴露及不同运动负荷游泳运动对肝脏TNF-α及PPAR-γ表达水平的影响(Mean±SD, n=10)1)Table 2 Effects of PM2.5 exposure and swimming exercise with different exercise loads on the expression of TNF-α and PPAR-γ in liver (Mean±SD, n=10)
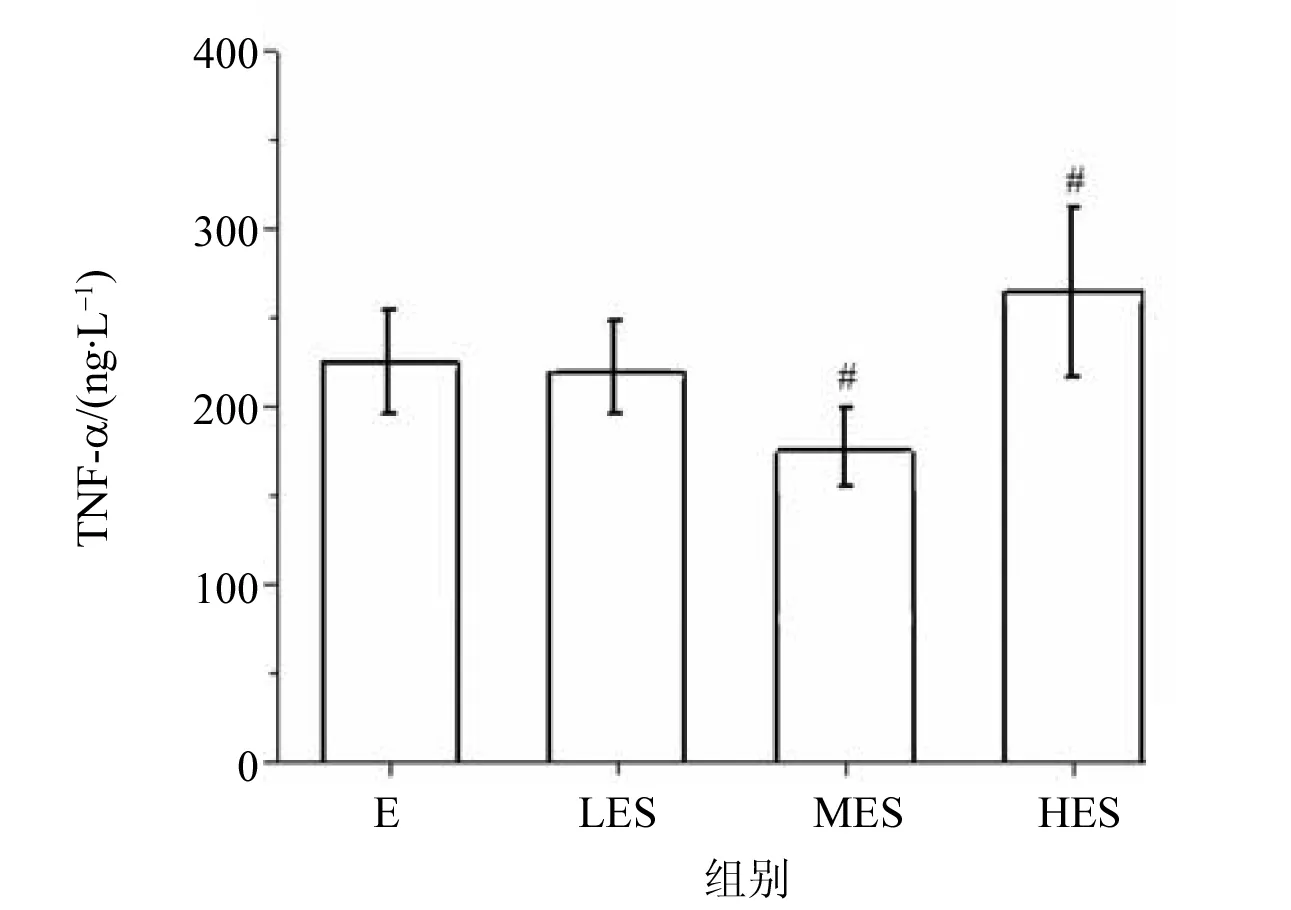
图1 不同负荷运动大鼠TNF-α含量的比较Fig.1 Comparison of TNF-α content in rats with different load exercise (Mean±SD, n=10)#P<0.05,##P<0.01 vs LES
2.3 肝脏PPAR-γ表达水平
Western blot结果如图2所示。从左到右依次为暴露组、暴露低负荷组、暴露中负荷组以及暴露高负荷组,与暴露组相比,暴露低负荷组、暴露中负荷组肝脏PPAR-γ表达明显升高(P<0.01),于暴露组比较呈现显著统计学差异,见表2。通过不同负荷游泳训练大鼠肝脏PPAR-γ对比发现,暴露中负荷组对比暴露低负荷组,PPAR-γ表达水平显著升高,差异具有统计学意义(P<0.05);而暴露高负荷组对比暴露中负荷组、暴露低负荷组,PPAR-γ含量显著降低,差异具有统计学意义(P<0.05)。而暴露中负荷组、暴露低负荷组之间无显著性差异。提示随着运动强度变化,肝脏内PPAR-γ表达水平产生变化。其中,中等运动负荷组(MES)表达水平显著增高,见图3。

图2 小鼠肝脏PPAR-γ的蛋白水平Fig.2 Protein level of mouse liver PPAR-γ
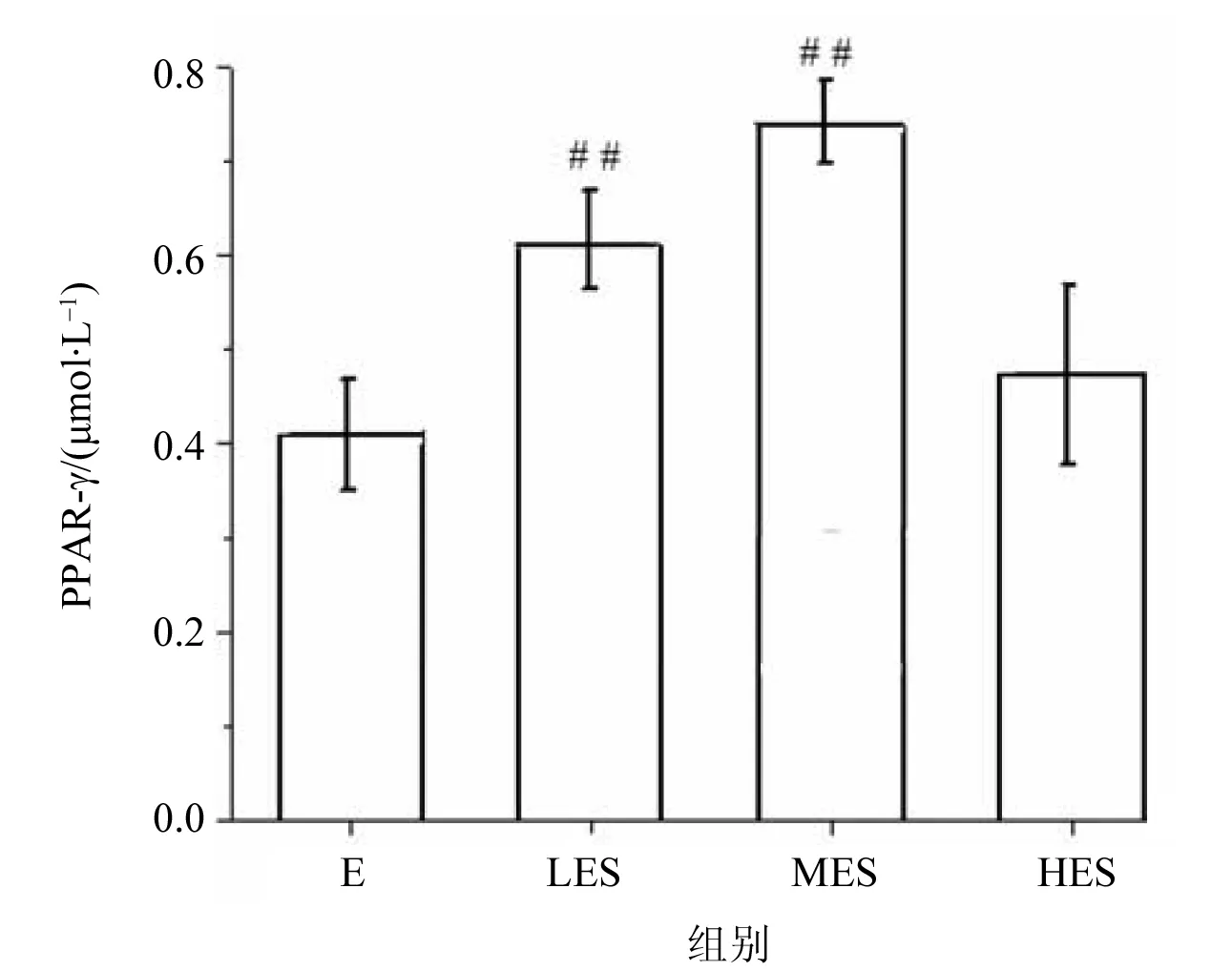
图3 不同负荷运动大鼠PPAR-γ含量的比较Fig.3 Comparison of PPAR-γ content in rats with different load exercise (Mean±SD, n=10)#P<0.05,##P<0.01 vs E
3 讨 论
TNF-α可直接反应肝脏脂肪功能,可影响肝脏内NEFA和TG的合成与分解。研究表明,TNF-α可以促进肌肉与脂肪组织活动,通过增加血浆的NEFA浓度增高肝脏指标,同时增加肝脏TG合成,全过程是通过激素敏感性脂肪酶途径增加肝脏脂肪变性的发生,TNF-α是重要的炎性因子,也发挥和调节炎性状态下的脂质代谢[9]。动物实验研究表明,NASH模型动物肝组织中TNF-α含量显著增高[10], TNF-α mRNA表达也显著增加[11]。通过本实验肝脏NEFA和TG指标显示,与PM2.5暴露组(E)对比,暴露中负荷组、暴露高负荷组均出现统计学差异(P<0.05),其中NEFA指标暴露高负荷组显著低于暴露组(P<0.01)。提示,通过有氧训练,可在一定范围内影响PM2.5暴露环境下肝脏脂肪功能代谢。
运动可改善肝脏脂肪代谢功能,影响细胞因子,提高抗氧化能力,前期研究发现,低强度的功率车实验无法改变血浆TNF-α值,但高负荷强度可使TNF-α值显著升高[12]。Vassilakopoulos实验发现,通过较大负荷强度运动可以引起血浆TNF-α升高[13]。大鼠实验研究发现,通过一次性力竭运动后,大鼠血清TNF-α含量显著高于对照组[14],9 W/90 min游泳训练,大鼠血清中TNF-α显著高于对照组[15]。本实验研究发现,在PM2.5暴露环境下,与暴露组相比,暴露中负荷组、暴露高负荷组出现差异性(P<0.05),暴露中负荷组降低,暴露高负荷组增高,暴露低负荷组无明显变化,表明运动降低TNF-α表达而减轻炎症性反应;不同负荷运动组对比显示,暴露中负荷组低于其他负荷训练组(P<0.05),表明中等负荷有氧训练,可有效降低大鼠肝脏TNF-α水平。这可能与运动时的脂肪消耗,动员组织中细胞因子,增加激素分泌有关。这些与之前学者研究相对应,运动可增白介素分泌,具有抗炎作用,进而抑制TNF-α分泌,降低TNF-α水平[16]。还有研究发现,TNF-α可能与肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)合成相关[17]。运动对炎症状态的减轻,可能是通过抑制TNF-α产生来完成的[18]。
PPAR-γ参与肝脏脂肪细胞分化和糖脂代谢,有着调节脂肪细胞基因表达及传递胰岛素细胞间信号的重要作用[19]。对于肌纤维传到信号而言,对肝星状细胞的转化有重要作用,表现为从静止表型向活化表型转化[20]。本实验研究发现,与暴露组相比,参与运动的三组均有不同程度的提高,其中暴露低负荷组、暴露中负荷组对比暴露组出现显著性差异(P<0.01),蛋白表达的提高可能是由于适宜负荷强度的有氧运动影响肝脏脂肪代谢的作用。前期研究发现,通过对脂肪组织TNF-α、PPAR-γ基因表达的调节,引起肝脏糖代谢AKT蛋白表达变化,以此来进一步改善肝脏糖耐量和胰岛素抵抗[21]。在NAFLD大鼠实验中进一步表明,通过12周有氧训练,对肝脏脂性改变PPAR-γ发挥更重要作用[22]。
运动可有效的抑制组织炎症,减轻炎症危害。研究发现,PPAR-γ可抑制炎症反应,是通过竞争抑制炎症信号通路和炎症介质的生成而发挥作用[23]。通过本实验研究,TNF-α降低最为显著的暴露中负荷组,PPAR-γ表达提高也最为显著,这与前者研究相一致,动物实验表明,8周耐力游泳运动可提高PPAR-γ蛋白表达,在大鼠脂肪组织中,进一步诱导脂肪细胞产生增殖与分化,同时研究发现,PPAR-γ蛋白表达程度与大鼠脂肪细胞的增殖与分化变化有关[24]。TNF-α是敏感的炎症指标之一,实验研究表明,TNF-α可减少PPAR-γ的产生及降低其mRNA的表达,有氧运动对于胰岛素抵抗的调节,可能是通过上调小鼠肝组织PPAR-γ mRNA的表达,反向增加PDH mRNA的表达来实现的,大鼠通过游泳训练可以明显改善胰岛素抵抗,这可能与PPAR-γ表达的上调有关[25]。
总之,TNF-α与PPAR-γ在肝脏脂肪代谢中起到重要作用,参与调控肝内脂肪酸氧化和炎症反应相关基因表达。PM2.5暴露可损伤肝脏脂肪功能,而有氧运动在一定程度上可改善肝脏脂肪代谢。本研究制作PM2.5暴露下不同负荷游泳训练大鼠模型,探讨研究在暴露环境下,不同负荷训练参与的肝脏脂肪代谢功能影响,为该环境下运动训练提供理论基础研究。

