基于胰高血糖素样肽-1的多重受体激动剂的研究进展
钱海,李承业,华子春,2,3,4**
(1. 中国药科大学新药研究中心,江苏 南京 210009;2. 中国药科大学生物药物学院,江苏 南京 210009;3. 南京大学生命科学学院,江苏 南京 210023;4. 江苏省产业技术研究院医药生物技术研究所/常州南京大学高新技术研究院,江苏 常州 213164)
超重和肥胖已成为人类面临的一个严重的公共卫生问题。根据世界卫生组织(WHO)估计,2016年全球范围内有19亿成年人超重[身体质量指数(body mass index,BMI)大于 25 kg · m-2],其中6.5 亿人是肥胖患者 [BMI > 30 kg · m-2][1]。肥胖与冠状动脉疾病、高血压、非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)、某些癌症以及2型糖尿病等疾病直接相关[2]。根据国际糖尿病联合会(International Diabetes Federation,IDF)的报告,2017年全球有4.22亿糖尿病患者,占全球人口的8.5%,预计到2045年该比例将增至14%[3]。
对于超重或肥胖人群,仅通过饮食和运动为基础的生活方式的改变,很难持续逆转体质量增加。虽然减肥手术能够有效减重,但其需要符合相应标准,风险较高且价格昂贵[4]。治疗肥胖的药物主要通过诱导饱腹感或减少营养素的吸收来发挥作用[5-6]。这种程度的体质量减轻可以有效改善代谢循环及脂质管理。然而,这些疗法通常伴有限制其使用的胃肠不良反应和心血管效应[6]。因此,有必要针对肥胖症及其并发症开发新的疗法,达到减轻体质量、改善糖尿病症状、预防糖尿病并发症和改善心血管健康等目的,并尽可能降低不良反应。
本综述从肥胖症和糖尿病治疗领域的最新研究成果出发,关注以胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)为基础的胃肠激素的肥胖治疗方案。总结GLP-1类似物的结构特征及临床使用情况,重点介绍基于GLP-1的单分子多重受体激动剂的最新研究进展。
1 胰高血糖素样肽-1的生理学基础
GLP-1是一种由小肠L细胞分泌的内源性肠促胰岛素激素,内源性GLP-1存在2种主要活性形式,分别为GLP-1(7-36)酰胺和GLP-1(7-37)。前胰高血糖素原是多种胃肠激素的前体,其在翻译后进行剪切可得到胰高血糖素(glucagon)和GLP-1等活性多肽[7]。GLP-1受体(GLP-1 receptor,GLP-1R)是G蛋白偶联受体(G protein-coupled receptors,GPCRs)B类家族的一员。B类家族GPCRs包含葡萄糖依赖性促胰岛素肽受体(glucose-dependent insulinotropic peptide receptor,GIPR)、胰高血糖素受体(glucagon receptor,GCGR)等受体[8]。
GLP-1在胰岛、肠神经元和中枢神经系统中大量表达,在肺、肾、心脏和周围神经系统中中度表达。GLP-1在胰岛中发挥保护胰岛β细胞的作用,以葡萄糖依赖的方式刺激胰岛β细胞释放胰岛素,有效控制餐后血糖的作用。因其独特的作用机制,低血糖风险大大降低[9]。GLP-1在其他生理系统中的表达则有抑制食欲,延缓胃排空以及心血管获益等好处[10]。研究表明,在侧脑室给予GLP-1可剂量依赖性地短暂减少食物摄入量,且该厌食效应可被GLP-1R拮抗剂抑制[11]。然而GLP-1(7-37)和GLP-1(7-36)酰胺在血浆中会被二肽基肽酶-4(DPP-4)等酶切割而代谢失活,并被肾小球快速滤过清除,导致体内半衰期较短,只有1 ~ 2 min。同时,GLP-1属于多肽类药物,在胃肠道中易被降解且难穿越肠黏膜,因此需要注射给药;此外,GLP-1还可能引发胃肠不适和呕吐[9]。
2 胰高血糖素样肽-1受体激动剂的临床应用
自2005年艾塞那肽被美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市以来,陆续有多种GLP-1受体激动剂上市(见图1),分别采取不同的策略克服内源性GLP-1的缺陷,表1总结了已上市的GLP-1受体激动剂的概况。
其中,口服索马鲁肽(semaglutide,Rybelsus®)是索马鲁肽与名为SNAC(sodiumN-(8-[2-hydroxybenzoyl]amino)caprylate)的小分子吸收增强剂混合构成的口服制剂,于2019年9月被FDA批准上市[12]。其独特之处在于,SNAC与索马鲁肽的结合能够让索马鲁肽在胃部被部分吸收。SNAC在胃部的溶解能够提高局部环境的pH,不仅能改善索马鲁肽的溶解度,还可以缓冲胃中的酸性环境,以抵抗胃部肽酶的降解。然而,口服索马鲁肽的口服生物利用度仅1%左右,需1日1片给药,每片剂量为7或14 mg,且服用前6 h和服用后0.5 h不能进食[13]。
相较而言,国内GLP-1激动剂的研发起步较晚,其市场规模仅约为全球市场规模的1%。2017年国内GLP-1激动剂市场规模仅4亿元。目前6个GLP-1受体激动剂已获国家药品监督管理局(National Medical Products Administration,NMPA)批准上市(见表1),其中索马鲁肽正在中国上市申请中,阿必鲁肽处于临床试验阶段。
3 基于胰高血糖素样肽-1的单分子多重受体激动剂
代谢性疾病如肥胖和糖尿病等具有并发性和异质性的特点,单一药物、单一靶点的治疗方案的疗效有限,通过在单一疗法中组合多种代谢通路,则可能实现多重作用以改善疗效[14]。然而,基于多药组合复方给药的方式,药物开发和临床研究历程相对复杂。因此,设计并获得单个药物分子在多种受体上具备适当平衡的活性成为最佳选择[15]。与共同施用单一激动剂相比,单分子多重受体激动剂因不同信号通路可被同时激活,从而具有疗效最大化、副作用降低、药动学性质更稳定等优点[15]。
研究表明,GLP-1受体激动剂与其他不同的胃肠激素共同给药显示出促进或协同作用,从而改善血糖控制和减轻体质量[16]。目前,许多以GLP-1为基础的、联合其他胃肠激素发挥促进或协同作用的单分子多重受体激动剂正处于临床前和临床开发阶段,且已表现出协同增效、提高耐受性和改善安全性等益处。

图 1 已上市胰高血糖素样肽-1激动剂的结构Figure 1 Structures of GLP-1 agonists commercially available
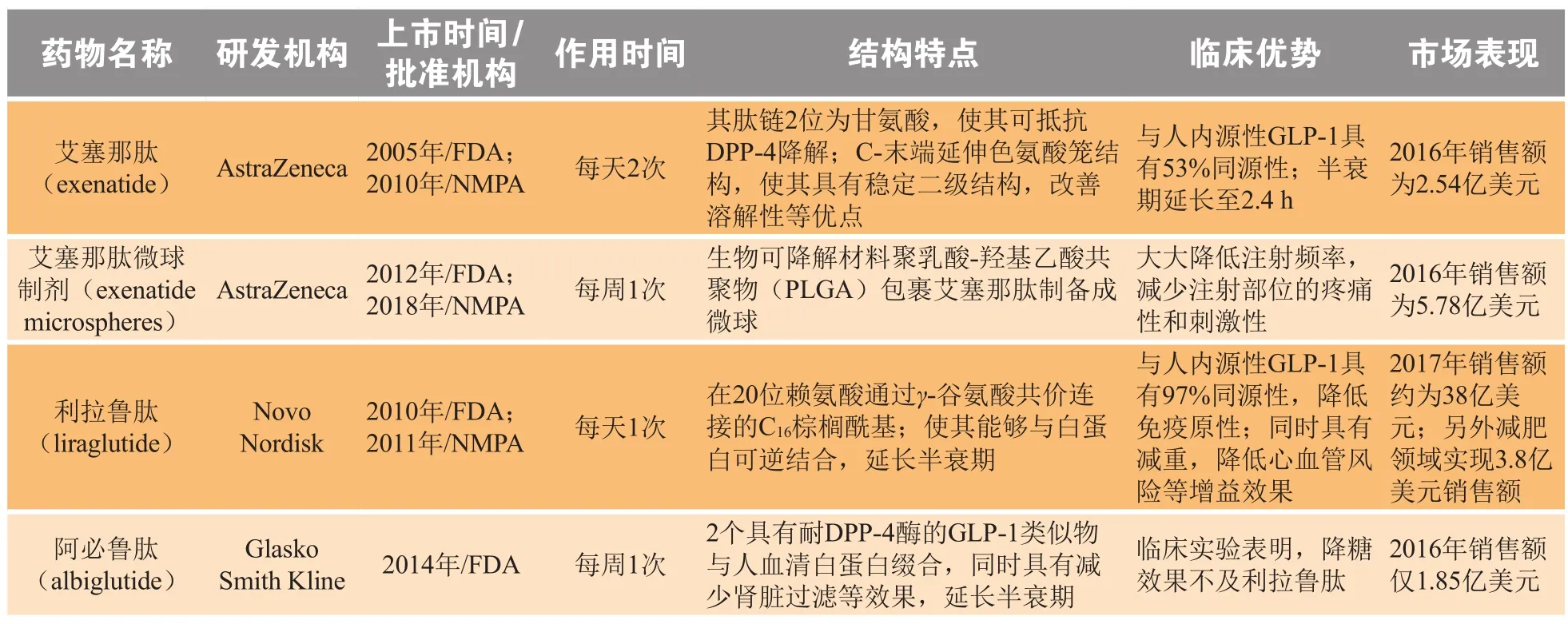
表 1 已上市胰高血糖素样肽-1激动剂药物信息汇总Table 1 Drug information of GLP-1 agonists commercially available

续表1
3.1 胰高血糖素样肽-1/胰高血糖素双重受体激动剂
胰高血糖素是在胰腺中产生胃肠激素,主要作用与胰岛素相反,响应于空腹或急性低血糖,通过刺激肝脏糖异生和糖原分解升高血糖[17]。同时,胰高血糖素能够影响机体代谢和产热过程。研究表明,外源性给予胰高血糖素能够减少肝脏三酰甘油(TG)合成并促进肝脂解[17]。胰高血糖素的促分解代谢作用和机体产热增加作用对肥胖患者有益。此外,急性给予胰高血糖素能适度减少食物摄入[18]。
GLP-1和胰高血糖素的双重受体激动剂将胰高血糖素的产热和脂解作用与GLP-1的延缓胃排空作用相结合以产生显著的体质量减轻作用,并通过GLP-1的促胰岛素分泌作用缓冲胰高血糖素的升血糖作用,从而有效控制血糖。许多GLP-1 / 胰高血糖素双重受体激动剂正在进行临床试验,已披露的试验结果显示,该类激动剂均展示出较好的降低体质量和控制血糖的效果[19-20]。
3.1.1 胃泌酸调节素 胃泌酸调节素(oxyntomodulin,OXM)由小肠的L细胞分泌,是内源性的单分子GLP-1/胰高血糖素双重受体激动剂。除胰高血糖素序列外,OXM在C末端延伸出8个氨基酸残基(见图2)[21]。相比于天然配体,OXM对GLP-1R和GCGR的激动活性降低为原来的近1/100,且对2个受体的激动活性有较大差别;与GLP-1相似,由于DPP-4的降解,OXM的循环半衰期相对较短,约为12 min[22]。OXM的临床前研究结果显示,与纯GLP-1R激动剂相比,OXM能显著降低体质量、食物摄入量和脂肪量[19]。另一项研究显示,在超重受试者中,OXM的双靶点激动效应导致食物摄入量减少42%[23]。这一内源性双重受体激动剂的活性结果同样证明了对2个受体进行合适比例的激活,可以发挥协同和促进血糖控制及减轻体质量的作用。

图 2 内源性胃肠多肽结构Figure 2 Structures of endogenous gastrointestinal polypeptides[21-23]
3.1.2 Pegapamodutide Pegapamodutide(LY2944876/TT-401;Eli Lilly/Transition Therapeutics)目前处于Ⅱ期临床试验阶段,其结构为OXM类似物缀合大分子聚乙二醇(PEG)链(见图3),每周给药1次。在一项由420名患者参加的临床研究中,患者被分为6组,分别接受pegapamodutide(10、15、30或50 mg)、艾塞那肽缓释制剂(2 mg)或安慰剂。结果显示,pegapamodutide(30/50 mg)治疗组患者的糖化血红蛋白(HbA1c)水平下降幅度(-1.15%和-1.04%)非劣于艾塞那肽(-0.02%和0.09%)治疗组;尽管与安慰剂组和艾塞那肽治疗组相比,pegapamodutide(30/50 mg)治疗组在第12周(-1.87和-1.15 kg)和24周(-1.67和-1.22 kg)时体质量下降幅度更大,但其在降低体质量方面未体现预期的优势[24]。
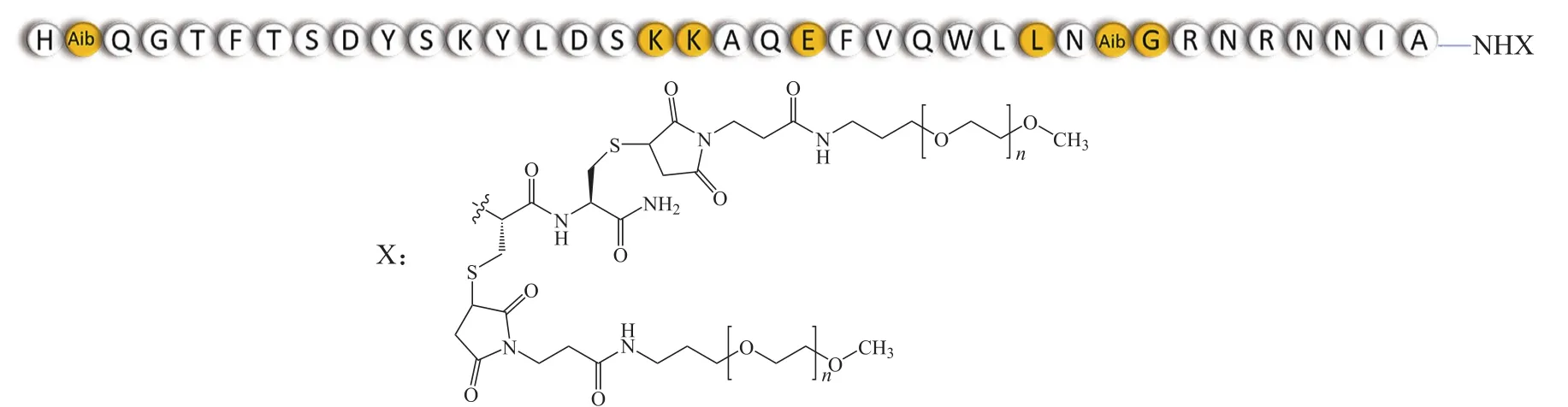
图 3 Pegapamodutide的结构[24]Figure 3 Structure of pegapamodutide[24]
3.1.3 HM12525A HM12525A(Hanmi Pharm)是利用Lapscovery技术研发的双重受体激动剂,处于Ⅱ期临床试验阶段。其是由GLP-1类似物,以相对分子质量为10 000的PEG为连接臂通过Lapscovery技术与免疫球蛋白G4(immunoglobulin G4,Ig G4)Fc部分二聚体缀合而共同组成的融合蛋白(见图4),体内半衰期得以延长,可每周给药1次。临床前研究表明,HM12525A在肥胖和(或)糖尿病动物模型中发挥有效的体质量减轻和血糖控制作用。HM12525A给药可显著降低db/db小鼠的血糖水平以及抑制体质量增加。正常小鼠的腹腔糖耐量(ipGTT)显示HM12525A能增加胰岛素分泌。身体成分分析显示,HM12525A的体质量减轻由饮食诱导的肥胖(diet-induced obesity, DIO)小鼠中脂肪量减少导致。HM12525A处理后激素敏感性脂肪酶(脂解作用的关键酶)和甘油释放后的磷酸化显著增加,表明HM12525A具有刺激脂解作用。这些结果表明HM12525A的双重激动介导脂肪细胞和胰腺β细胞中的脂解、能量消耗和胰岛素分泌,从而产生抗肥胖和抗糖尿病作用[25]。

图 4 HM12525A的结构[25]Figure 4 Structure of HM12525A[25]
3.1.4 MEDI0382 MEDI0382(Med Immune)处于Ⅱ期临床试验阶段,设计为每天给药1次。其结构在胰高血糖素的基础上,将20和24位的谷氨酰胺残基用不易脱酰胺的氨基酸取代,17位精氨酸残基用谷氨酸取代以减少蛋白水解,Lys10侧链与棕榈酸偶联以促进与白蛋白的可逆结合从而延长血浆半衰期(见图5)[26]。一项为期41 d的Ⅱa期临床试验评估了MEDI0382的有效性、安全性和耐受性。51名患者被随机分配到MEDI0382治疗组(25例)或安慰剂组(26例)。结果表明,与安慰剂组相比,MEDI0382治疗组患者的葡萄糖耐量更好,并且体质量减轻效果更好,第41 d后的体质量平均下降3.84 kg,而安慰剂组下降1.70 kg,MEDI0382治疗组HbA1c水平下降0.9%,而安慰剂组下降0.6%。然而,与安慰剂组相比,MEDI0382治疗组胃肠道疾病和食欲下降发生率更高(72%,20%vs40%,0)[27]。
3.1.5 ZP2929 ZP2929(Zealand Pharm)目前处于Ⅰ期临床试验阶段,每天给药1次,结构信息未披露。非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)被认为是代谢综合征的肝脏表现,与肥胖、糖尿病和胰岛素抵抗密切相关。最新研究揭示了ZP2929对DIO-NASH小鼠模型中代谢参数和肝病发展的影响。结果显示,与对照组相比,ZP2929组和利拉鲁肽组小鼠体质量显著降低,且与利拉鲁肽高剂量组相比,ZP2929高剂量组的体质量减轻效果更好。此外,ZP2929显著降低谷丙转氨酶(ALT)水平(U·L-1,低剂量组:39.3±3.1;高剂量组:35.7±1.7;利拉鲁肽组:43.3±12.8;空白对照组:148.8±10.1)、天门冬氨酸转氨酶(AST)水平,以及肝脏TG和总胆固醇(TC)含量,这意味着ZP2929治疗可显著改善NASH症状,说明GLP-1/胰高血糖素双重受体激动剂可能成为NASH患者新的治疗选择[28]。
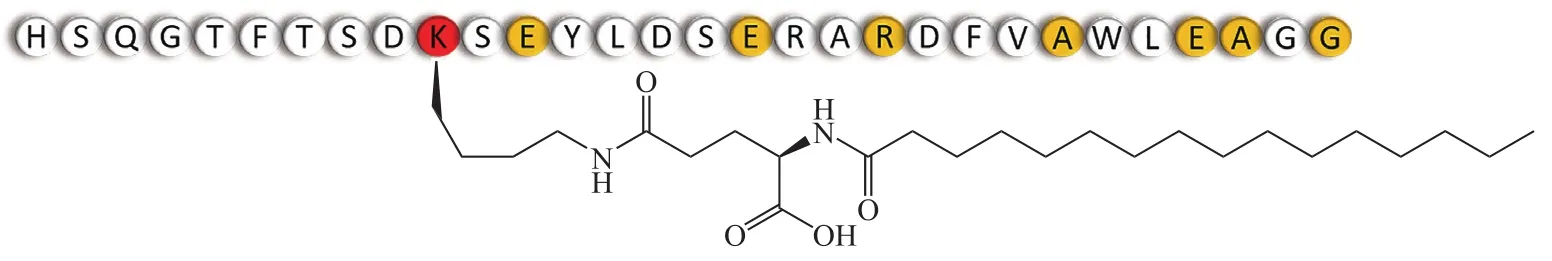
图 5 MEDI0382的结构[26]Figure 5 Structure of MEDI0382[26]
3.1.6 MOD-6030 MOD-6030(Prolor Biotech)目前处于临床前研究阶段,其采用可逆的PEGylation技术开发长效化OXM,通过2-磺基-9-芴基甲氧基羰基(FMS)连接在N末端,12或30位的Lys残基上PEG化。注射后,完整的OXM会缓慢释放,从而延长肽的体内作用时间,同时保持其生物活性和通过血脑屏障的能力。最新研究结果显示,每天2次注射未经修饰的OXM可使食物摄入量减少12%,并使体质量减轻16%;而每周仅注射1次MOD-6030可使食物摄入量下降29%,体质量减轻28%。身体成分分析证实,观察到的体质量减轻是由特定的脂肪减少所引起。同时MOD-6030也发挥出改善葡萄糖耐量、降低非空腹血糖水平的作用。此外,与对照组相比,MOD-6030使终末血浆胆固醇水平显著降低56%。可逆性PEG化OXM显著诱导体质量减轻,同时改善每周1次注射后DIO小鼠的血糖控制和脂质特征,表明MOD-6030可用于治疗肥胖和2型糖尿病[29]。
3.1.7 SP1373 SP1373(VPD-107/ALT-801;Altimmune,EuMederis Pharm,Velocity Pharm)尚处于临床前研究阶段,其结构信息和长效化手段均未披露,每周给药1次。最新的临床前研究数据显示,SP-1373的药动学性质更加稳定,这有利于减少副作用。药效学实验表明,在相同剂量下,SP-1373比索马鲁肽更有效、作用更持久,并且SP-1373的药效学曲线显示逐渐接近正常葡萄糖水平。SP-1373组在3和10 nmol·kg-1剂量下24和120 h后的血糖水平分别为 1.3和 2.1、1.3和 2.3 g·L-1,而 3和 10 nmol·kg-1索马鲁肽组血糖水平分别为2.0和3.9、1.3和2.8 g·L-1。组织学显示,SP-1373组小鼠几乎没有肝脏脂肪变性,其他治疗组脂肪变性适度减少,此外SP-1373组小鼠肝脏质量显著降低。与其他治疗组相比,SP-1373组可最大程度地改善NASH症状,显示出其作为NASH潜在新疗法的巨大希望[30]。
3.1.8 PSA-OXM PSA-OXM(Xenetic Biosciences,Pharmsynthez)目前处于Ⅰ期临床试验阶段,但尚无最新的临床数据更新,其由重组OXM与天然亲水聚合物聚唾液酸(PSA)结合以达到长效化作用。PSA-OXM的Ⅰ期临床试验招募了12名健康志愿者。受试者皮下接受安慰剂或0.25、0.75、1.5 mg·kg-1PSA-OXM,结果显示所有剂量的药物都安全且耐受良好。
3.1.9 CPU-4D CPU-4D为笔者所在课题组研发,该化合物是以胰高血糖素为基础开发的双重受体激动剂,以半胱氨酸置换胰高血糖素的对应氨基酸,并缀合脂肪酸以延长半衰期(见图6)。DIO小鼠每2天1次给予1 000 nmol· kg-1CPU-4D,为期1个月,观察到体质量减轻和葡萄糖耐受性正常化,以及胰岛素、瘦素和脂联素等的血浆代谢参数的改善。这些研究表明,化合物CPU-4D在降低体质量和维持能量消耗方面表现良好,作为预防、治疗肥胖症和血脂异常的GLP-1/胰高血糖素双重受体激动剂具有强大的临床潜力[31]。

图 6 CPU-4D的结构[31]Figure 6 Structure of CPU-4D[31]
3.2 胰高血糖素样肽-1/葡萄糖依赖性促胰岛素肽双重受体激动剂
葡萄糖依赖性促胰岛素肽(glucose-dependent insulinotropic peptide,GIP)是由小肠的神经内分泌K细胞分泌的多肽。由GIPR介导其生理作用,主要为非葡萄糖依赖的促胰岛素分泌、增强胰高血糖素分泌、增强脂质代谢等[32]。虽然GIPR激动剂的有益作用似乎在2型糖尿病患者的高血糖症状中减弱,但研究表明,GIP减弱的促胰岛素分泌作用可以在血浆葡萄糖水平恢复正常一段时间后完全恢复[33]。这表明共同激动GLP-1R/GIPR可发挥协同降血糖作用。Irwin课题组的最初研究表明,GLP-1R激动剂艾塞那肽和GIPR激动剂N-AcGIP的组合可以改善葡萄糖耐量,并减少食物摄入量和减轻体质量[34]。在Daousi 课题组的一项研究中,6名健康受试者和6名超重糖尿病受试者均分别接受GLP-1和GIP单独或联合给药。结果显示,与单独给予GLP-1相比,接受联合给药的健康受试者其胰岛素分泌水平更高;而接受上述2种给药方式的超重糖尿病受试者的胰岛素分泌处于同一水平,表明联合给药并不过度增强患者的胰岛素分泌。[35]。基于以上试验结果,GLP-1/GIP双重受体激动剂有可能产生更优异的降糖效果。以下介绍目前在研的GLP-1/GIP双重受体激动剂研究进展。
3.2.1 Tirzepatide(LY3298176) Tirzepatide(Lilly)的Ⅲ期临床即将进行,预计在2021年结束。设计为每周给药1次。其结构为GIP部分肽序的类似物和艾塞那肽的部分肽序的拼合,并缀合类似索马鲁肽边链的脂肪酸链达到长效化的作用(见图7)。一项由316名患者参加的为期6个月的Ⅱb期临床试验数据显示,tirzepatide对2型糖尿病患者显示出极显著的降糖和减轻体质量的效果:患者的HbA1c水平较基线降低了2.4%,平均体质量降低了11.3 kg(12.7%)。将患者随机分为安慰剂组,1、5、10、15 mg 4个剂量组和1.5 mg的杜拉鲁肽组,均为每周给药。结果显示,tirzepatide15 mg剂量组有77%的患者HbA1c水平低于7%,10 mg剂量组有90%的患者达到控制指标,而杜拉鲁肽组和安慰剂组只有55%和12%的患者达标。Tirzepatide的2个高剂量组绝对HbA1c水平下降2.4%、2.0%,显著高于杜拉鲁肽组的1.2%;体质量分别下降11.3和8.7 kg,而杜拉鲁肽组只降低2.7 kg。但tirzepatide组患者显示有较大的胃肠道副作用,这些不良事件主要包括恶心(5、10、15 mg治疗组发生率分别为20%、22%、40%)、腹泻(24%、24%、32%)和呕吐(8%、16%、26%),大多为轻至重度,且均为一过性反应[36-37]。Ⅱ期临床研究阶段,未披露结构信息。临床数据表明,在8和12周时,RG7697治疗组患者HbA1c水平分别比安慰剂组显著降低0.63%和0.96%;尽管12周时体质量减轻不显著,但8周后体质量较安慰剂组显著降低1.8%[38]。在一项为期12周的Ⅱa期临床试验中,2型糖尿病患者用二甲双胍控制不佳,每天1次皮下注射RG7697 1.8 mg或利拉鲁肽1.8 mg(第1周 0.6 mg, 第 2周 1.2 mg,第 3 ~ 12周 1.8 mg),每天1次皮下施用,定期收集数据。与安慰剂组相比,RG7697治疗组患者血糖控制显著改善且体质量减轻,一系列脂质参数和瘦蛋白中的总胆固醇均显著降低。结果表明RG7697治疗耐受良好,显示了较好的安全性[39]。
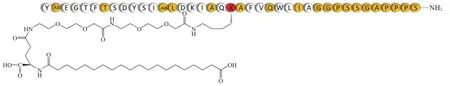
图 7 Tirzepatide的结构[36]Figure 7 Structure of tirzepatide[36]
3.2.3 ZP-DI-70 ZP-DI-70(Zealand Pharm),结构信息未披露,设计为1周给药1次。最新研究在小鼠和猴中进行了药动学表征,给药后的终末半衰期分别估计为17和68 h。在小鼠中研究了ZP-DI-70对体质量和血糖控制的影响。结果显示,ZP-DI-70可剂量依赖性地减少DIO小鼠的体质量,在1和3 nmol · kg-1剂量下给药3周后相对体质量分别减轻4%和13%。此外,在糖尿病db/db小鼠ipGTT实验中,5 nmol·kg-1ZP-DI-70能显著降低血糖水平[40]。这些结果表明,与现有疗法相比,ZP-DI-70作为治疗2型糖尿病有希望的候选药物具有优异的体质量降低效果。该化合物的药动学特征进一步表明ZP-DI-70可实现方便的每周1次治疗。
3.3 胰高血糖素样肽-1/葡萄糖依赖性促胰岛素肽/胰高血糖素三重受体激动剂
各类GLP-1/胰高血糖素和GLP-1/GIP双重受体激动剂的成功研发,引发了对同时激动3种靶受体的单个分子的研究。GLP-1的食欲抑制作用、GIP的脂肪分解作用及胰高血糖素的热量消耗作用结合起来可以提供协同的减轻体质量作用。此外,GLP-1和GIP可共同发挥促胰岛素释放作用以达到调控血糖的作用。GLP-1和胰高血糖素都来源于胰高血糖素原前体,GIP分子与GLP-1和胰高血糖素的N末端具有极高的同源性,而3个分子的N末端均为受体与配体亲和结合的部位,这为GLP-1/胰高血糖素/GIP三重受体激动剂的猜想与设计提供了基础。三重受体激动剂的研发起步较晚,目前仅少数进行到临床研究阶段,以下讨论一些在研的三重受体激动剂。
3.3.1 Triagonist 首个三重受体激动剂由Richard Di Marchi和Matthias Tschöp课题组研发,其从前期工作中已经验证具有GLP-1/胰高血糖素双重受体激动活性的序列开始,逐步引入GIP残基以引入GIP的激动活性(见图8),同时不破坏GLP-1/胰高血糖素的激动活性,并且相对于3个天然肽具有更高效能[41]。该肽序在位置2处(黄色部分所示)用Aib残基取代以防止DPP-4酶切;在位置10处(红色部分所示)以Lys连接C16棕榈酸以延长体内作用时间。体外激动活性实验以及各受体基因缺陷鼠的实验数据证明其对3种受体的激动活性。在DIO小鼠试验中,每天皮下注射3 nmol·kg-1的三重受体激动剂,为期20 d,使小鼠体质量减轻了26.6%,且身体成分分析为脂肪量的减少[41]。此外,三重受体激动剂可有效控制血糖,改善葡萄糖耐量,提高胰岛素敏感性。三重受体激动剂还降低了肝脂质含量,这对于患有脂肪肝疾病和NASH的患者是有益的[41]。
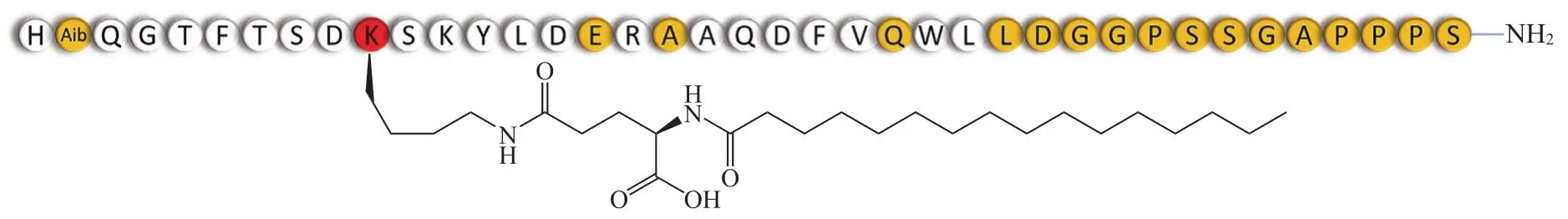
图 8 Triagonist的结构[41]Figure 8 Structure of triagonist[41]
3.3.2 HM15211 Hanmi Pharm也开发了一种三重受体激动剂HM15211,目前处于Ⅰ期临床试验阶段。其结构为胰高血糖素类似物,并通过柔性PEG化接头与人免疫球蛋白G(immunoglobulin G,IgG)Fc片段偶联延长半衰期,但具体的肽序结构未披露(见图9)。HM15211在NASH和血脂异常的动物模型中显示出治疗潜力。研究显示,该化合物比单独使用利拉鲁肽更大程度地降低了DIO小鼠的体质量,并且还改善了脂质代谢和肝脂肪变性[42]。另一项随机、双盲、安慰剂对照的试验显示,HM15211在肥胖的成年人群中安全且耐受良好,心率、血压、心电图、体格检查和临床实验室检查无明显变化。目前无受试者停止研究,且无因药物引起的严重不良反应事件。HM15211的血浆浓度在31.20 ~ 68.08 h达到其峰值水平,终末半衰期为72.09 ~ 142.10 h[43]。总之,单剂量的HM15211耐受性良好,显示适合每周给药的药动学曲线,随后将对NASH肥胖患者进行临床研究。
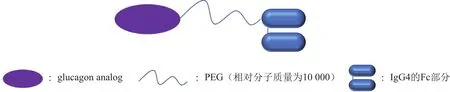
图 9 HM15211的结构[42]Figure 9 Structure of HM15211[42]
3.3.3 Syn-GIP-ZP Wang等[44]通过将GLP-1 / 胰高血糖素双重受体激动剂ZP2929肽链部分类似物与GIP类似物分别融合到名为Synagis的人免疫原性低的抗体的重链和轻链中得到Syn-GIP-ZP,该化合物在3种受体的体外激动活性实验中均显示出平衡且有效的活性。但目前没有更多的临床前实验证明其活性。该化合物更多的意义是,提供了一种可以将结构不相关的肽融合在一起的方法,此方法通过与更大的生物分子融合,增加了合成灵活性,并改善了药动学性质。
3.3.4 YAG-glucagon YAG-glucagon由 V. A. Gault课题组研发,目前处于临床前研究阶段。其结构以人胰高血糖素为基础,其氨基酸取代基与GIP序列中的关键位置对应。一项临床前研究表明,YAG-glucagon在体外可增加胰岛素分泌,在受体激动活性实验中对3种受体均显示激动活性。在小鼠中急性注射YAG-glucagon后,血浆葡萄糖水平显著降低,且胰岛素浓度增加。在DIO小鼠中,每天2次施用YAG-glucagon持续14 d可降低血糖并增加血浆胰岛素浓度[45]。
4 展望
截至目前,大多数代谢性疾病的治疗药物一直专注于单独疗效的单一分子靶点或各种单一靶点药物的复方制剂,然而这些策略并未取得令人满意的结果。过去15年里,GLP-1R激动剂为糖尿病和肥胖症患者提供了有效和安全的治疗方法,对2型糖尿病患者的治疗产生了深远的影响。与胰岛素相比,GLP-1R激动剂具有更大的安全性窗口,但其临床疗效并不能完全满足代谢紊乱病人的需求,为此,将GLP-1的益处与其他胃肠多肽激素的特性相结合有望实现理想的治疗目标。
目前多重受体激动剂的研究如火如荼,笔者认为,多重受体激动剂发挥疗效的关键在于各受体之间合适的激动比例,以发挥出协同促进的血糖控制、体质量减轻以及调节脂质代谢等功能。另一方面,长效多重受体激动剂不仅显示出更稳定的药动学性质,且在患者顺应性上有极大优势,而各种延长多肽半衰期的手段也各有利弊,因此也需要通盘考量。总的来说,以GLP-1为基础的多重受体激动剂很可能为糖尿病和肥胖症提供极具希望的新一代疗法。

