子宫内膜取样器用于子宫内膜组织学诊断的可行性研究
蒋 英 翟 妍 王秋石 时 晓 王淑珍
(首都医科大学附属北京朝阳医院妇产科,北京100020)
子宫内膜病变严重威胁女性健康,绝经过渡期和绝经后期女性高发。宫腔镜下子宫内膜活检组织学诊断,是当前诊断子宫内膜病变的金标准。如何便捷地获得子宫内膜组织,很多研究者[1-3]做了有益的探索。Madari等[4]用子宫内膜细胞刷行子宫内膜细胞学检查,这为子宫内膜取样器的研究提供了有益的提示。随着多种子宫内膜取样器问世和不断改进,新型子宫内膜取样器作为子宫内膜活检器械,在获取内膜组织过程中无须扩宫、子宫内膜损害轻微、无明显痛苦,已经成为欧美等国家门诊进行子宫内膜活检的常规器械[1-5]。由于其价格较昂贵,未能在国内广泛使用。本研究采用前瞻性自身对照的方法观察子宫内膜取样器获取内膜组织的量及制片质量,评价其对诊断子宫内膜病变可靠性、可信性,为其临床应用提供依据。
1 对象与方法
1.1 研究对象
选取 2013年12月至2014年5月在首都医科大学附属北京朝阳医院妇科病房可疑子宫内膜病变患者182例,患者年龄25~88岁,平均年龄(49.44±11.38)岁。其中绝经前患者113例,年龄25~53岁,平均年龄(42.61±6.88)岁。绝经后患者69 例,年龄49~88岁,平均年龄(60.62±7.90)岁。诊断性刮宫指征包括异常子宫出血、绝经后子宫出血、超声提示子宫内膜增厚、宫腔占位、子宫内膜息肉。本研究经首都医科大学附属北京朝阳伦理委员会审查通过。
1.1.1 纳入标准
①自然绝经后女性:绝经后阴道出血和(或)经阴道超声检查诊断子宫内膜增厚(厚度≥5 mm)或宫腔占位患者。②育龄期女性:异常子宫出血和(或)经阴道超声检查诊断子宫内膜息肉、宫腔占位、子宫内膜增厚患者。③激素药物绝经或假绝经女性1年以上,超声提示子宫内膜增厚者,如乳腺癌术后口服三苯氧胺(tamoxifen,TAM)。④既往诊断性刮宫病理确诊为子宫内膜增生,行口服药物保守治疗随访者。⑤宫颈脱落细胞学提示腺细胞异型,排除宫颈病变者。
1.1.2 排除标准
①存在凝血功能异常患者。②已确诊生殖道恶性肿瘤者。③妊娠者。④有严重内外科合并症者。⑤急性生殖道感染者。⑥不同意纳入本研究者。
1.1.3 研究设计
依据纳入标准和排除标准,最终纳入研究的患者均于非麻醉状态下用子宫内膜取样器抽取子宫内膜,记录患者的自觉症状、疼痛评分。再于麻醉后继续行宫腔镜下诊断性刮宫术,取样器和诊断性刮宫获取的子宫内膜标本分别行病理组织学检查。以宫腔镜下诊断性刮宫病理诊断为标准,评价子宫内膜取样器,获取子宫内膜组织的量、制片质量,评价其用于病理诊断取材的可靠性、可信性,以及与诊断性刮宫病理诊断的一致性。分为取样器组和诊断性刮宫组进行自身比对。
1.2 仪器与采样器
采用日立公司生产的HITACHI 二郎神5 彩色超声仪(日立),频率 7.5 MHs阴道探头(日立)经阴道测量子宫体积,形态、肌层及子宫腔及子宫内膜情况,长轴矢状切面测量双层子宫内膜的最大厚径、宫腔血流分布阻力指数宫腔血流分布阻力指数(resistance index,RI)。日本Olympus公司生产的直径4.5 cm的硬管型宫腔镜。
Endocell子宫内膜采样器(美国华莱士)由外套管和内树脂活塞2部分组成。外套管直径3 mm,透明聚丙烯套管,有刻度、具有一定柔韧性,头端一2.1 mm的侧孔。内套管即一个可以滑动的树脂活塞,推拉方便,管腔容量1 mL。内套管完全抽回后宫腔内形成负压,外拉吸引取样(图1)。

图1 Endocell子宫内膜采样器Fig.1 Endocell endometrial sampler
1.3 手术步骤
常规外阴阴道消毒,内诊确定子宫位置、体积、质地,阴道窥器暴露宫颈外口,探针明确子宫腔深度后置 Endocell 取样器缓慢置入宫腔,近宫底,固定,缓慢完全抽回取样器内套管活塞,形成负压;缓慢将取样器在宫腔底部、双侧宫角与宫颈内口间来回抽拉、旋转,获得整个宫腔的组织物标本并退出取样器。记录症状、疼痛评分后给予静脉麻醉,行诊断性刮宫即在宫腔镜直视下子宫内膜刮宫术。取样器及诊断性刮宫获取的子宫内膜标本均按常规固定、制作蜡块、切片,由病理医生在双盲的情况下,按照常规组织学诊断标准分别对两份活检组织材料病理学诊断。记录术中情况,包括取样器后宫腔镜检查的可行性、宫腔出血情况。采用目前疼痛数字评分法(Numerical Rating Pain Scale,NRS)进行疼痛评分,疼痛评分记录为1~6分。
1.4 病理学评估指标与标本质量评估
1.4.1 病理学评估指标
以诊断性刮宫(diagnostic curettage,D&C)组织学诊断[6]为标准,对正常内膜病例,明确其为增生期、分泌期及分泌状况。子宫内膜增生要标记单纯性子宫内膜增生伴或不伴非典型增生、复杂性子宫内膜增生伴或不伴非典型增生。子宫内膜癌病例要求明确组织类型和分化程度[7]。
1.4.2 病理标本满意度
根据标本取材量、组织形态、对病理诊断有无影响等,将标本划分为“满意、一般、差”3个等级。满意指子宫内膜组织量足够组织学诊断需要且组织学形态保存良好,能够对腺体和间质的比例进行评估。一般是指子宫内膜组织量少或组织学形态保持稍差,但尚能做出组织学诊断。差是指子宫内膜组织量少、呈碎片状,组织正常形态丧失,不能做出组织学诊断。
1.5 统计学方法
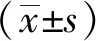
2 结果
2.1 子宫内膜取样器取材可靠性评价
2.1.1 取样器获取子宫内膜组织评价
182例患者中先用子宫内膜取样器取材,之后在宫腔镜下用刮匙诊断性刮宫取材,均顺利取出子宫内膜组织152例,均未能取到子宫内膜组织16例,仅用一种器械获取到子宫内膜组织者,取样器组8例,诊断性刮宫组6例,共14例。取样器和诊断性刮宫成功率分别是87.91%(160/182)和86.81%(158/182),2组取材失败率分别是和12.08%(22/182)和13.18%(24/182)。McNemar配对χ2检验表明2组所用器械取材结果的一致性良好,差异无统计学意义(P=0.791)(表1)。
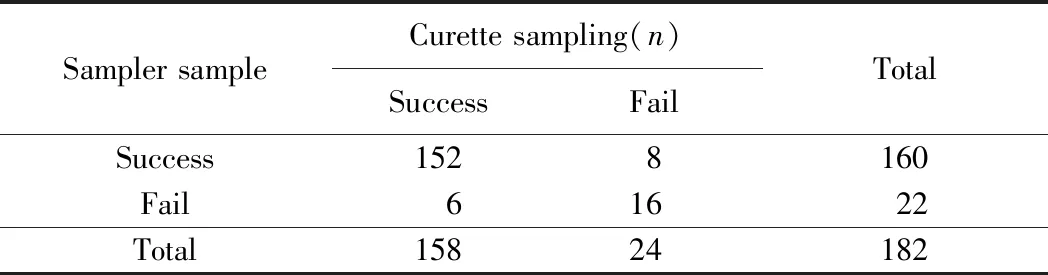
表1 子宫内膜取样器取材可靠性评价Tab.1 Evaluation of the reliability of endometrial sampler
2.1.2 绝经后和绝经前患者2种器械取材失败比较
182例患者中绝经后69例2种器械未获取子宫内膜组织均为20例,失败率28.99%。绝经前患者113例,取样器取材4例取材失败,诊断性刮宫2例失败,两组取材失败率分别为3.54%(4/113)和1.76%(2/113)。取样器和诊断性刮宫均呈现绝经后子宫内膜组织的获取率明显低于绝经前患者,差异有统计学意义(P均<0.01)。
2.2 病理资料分析
2.2.1 标本满意度评价
两种器械取材都获得满意内膜标本并进行组织学诊断的共148例,所有切片质量依据标本的量、组织形态及能够评价腺体和间质3个基本要求,能够满足病理科医生组织学诊断的需求。取材满意度评价见表2。
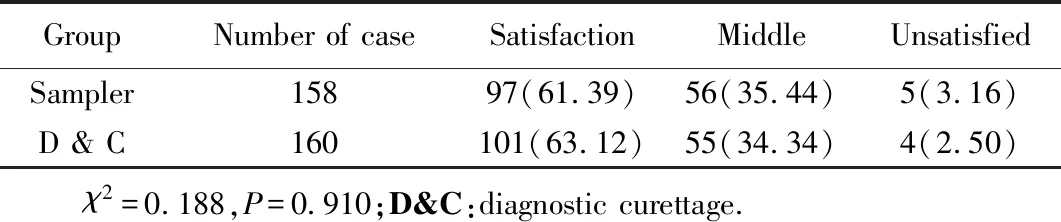
表2 两组取材标本满意度评价Tab.2 Satisfaction evaluation of two groups of samples n (%)
2.2.2 两组子宫内膜标本组织学诊断一致性比较
本研究病理组织切片由两位病理科医生随机双盲进行病阅片,得到病理诊断,两组子宫内膜组织病理诊断结果的一致性为92.56%(137/148),其不一致的病理相差级别为一级,经Kappa一致性检验(Kappa=0.870,P<0.001),两者一致性良好(表3、图2)。1例诊断性刮宫病理诊断为高分化子宫内膜样腺癌,取样器病理诊断为不典型增生。1例诊断性刮宫病理子宫内膜复杂增生,取样器病理为子宫内膜复杂增生伴局灶不典型性增生。
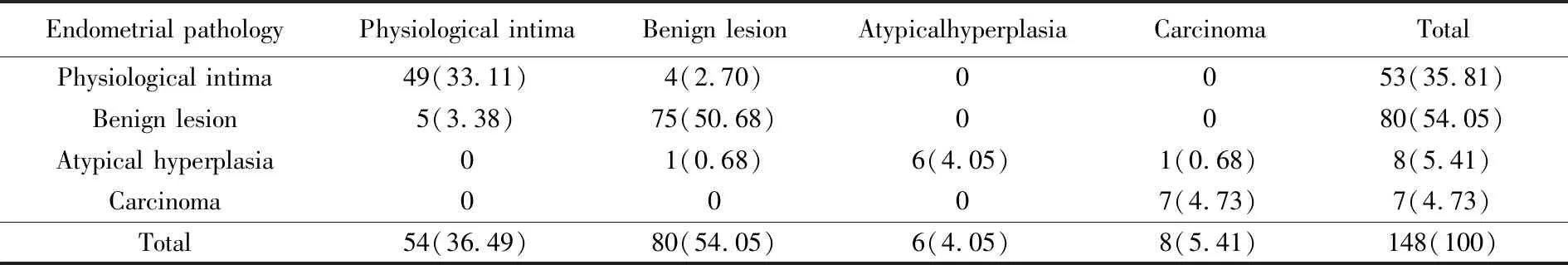
表3 子宫内膜组织临床病理资料Tab.3 Clinical and pathological data of endometrial tissue n(%)
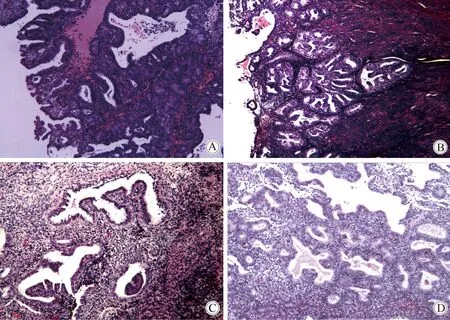
图2 两种方法获取子宫内膜组织结果Fig.2 Endometrial tissue by the two sampling methods(HE staining,40×)
2.2.3 两组未获得组织学诊断的比例和原因分析
182例患者中取样器取材失败24例,制片失败5例;诊断性刮宫失败22例,制片失败4例。两组取材和制片总的病理诊断失败率分别15.93%(29/182)和14.28%(26/182),经χ2检验,差异无统计学意义(χ2=0.193,P=0.770)。取样器组进行单因素分析显示:绝经后(χ2=25.116,P<0.001)、纳入指征(χ2=56.650,P<0.001)、年龄(Z=-3.295,P<0.001)及子宫内膜厚度(Z=-5.602,P<0.001)是取样器取材失败的危险因素。二元Logistic分析:子宫内膜厚度是取材失败的独立危险因素[B=-2.535,Walds=7.824,P=0.005,OR=0.079(95%CI:0.013~0.488)]。诊断性刮宫组单因素分析显示:绝经后(χ2=32.98,P<0.001)、纳入指征(χ2=60.720,P<0.001)、年龄(Z=-4.167,P<0.001)及子宫内膜厚度(Z=-6.143,P<0.001)是取样失败的危险因素。二元Logistic分析:子宫内膜厚度是取材失败的独立危险因素[B=-3.209,Walds=8.281,P=0.004,OR=0.040(95%CI:0.005~0.359)]。显而易见子宫内膜厚度是取样器和诊断性刮宫取材失败的唯一独立危险因素。
2.3 子宫内膜取样器不良事件分析
182例患者在非麻醉状态下用子宫内膜取样器抽吸取样,症状记录显示34例患者诉操作过程中下腹部不适,但能够耐受,1例患者主诉下腹不适明显,停止操作后症状缓解。1例患者NRS疼痛评分6分,其余最高评分4分。两组均无严重不良事件发生。
3 讨论
本前瞻性自身对照研究显示子宫内膜取样器获取子宫内膜组织的成功率及标本的满意度均可达到良好做出组织学诊断的标准。与诊断性刮宫取材相比取样结果的一致性良好(McNemar法,P=0.791),子宫内膜组织的质量评价差异无统计学意义。取样器取材组织量不足或组织形态改变,影响病理判断的比例3.16%(5/158),与宫腔镜下子宫内膜诊断性刮宫术后不满意的比例相近[8]。子宫内膜组织量受到很多因素的影响,如年龄、绝经状态、子宫内膜疾病史等。取材失败者多见于绝经后子宫内膜菲薄、生育年龄子宫内膜黏连、瘢痕化。Agostini等[9]的研究中发现子宫内膜变薄萎缩时,只有23%的活组织检查能够满足组织学评估及诊断,与本研究结果相近。本研究取样失败的单因素分析显示:两种取样方法均显示绝经后、纳入指征、年龄及子宫内膜厚度是取样失败的危险因素。纳入指征中绝经后子宫内膜增厚或/和绝经后出血患者取样失败率最高,其次是绝经前子宫内膜瘢痕或/和月经过少。多因素分析显示仅子宫内膜厚度是两种方式取样失败的独立危险因素。子宫内膜厚度与年龄、绝经状态有关,多因素共同分析中其作用涵盖在子宫内膜厚度中。危险因素的分析反向提示取样成功与否反映子宫内膜的状态。
评价取样器可靠性的另一个重要指标是对癌前病变及子宫恶性肿瘤的诊断率、漏诊率。本研究仅1例取样器病理诊断为不典型增生,诊断性刮宫病理诊断为高分化子宫内膜癌。不符合的程度限于1级、无肿瘤病变遗漏。可能与取样器不能全面取材以及取材的深度不及刮匙取样有关。与不典型子宫内膜增生与高分化子宫内膜癌病理特征极其相近有关。对肿瘤性病变诊断率。多数研究者[7-10]认为子宫内膜取样器对子宫内膜癌的诊断特异性、敏感度很高,Huang等[10]回顾分析360例子宫内膜癌病例,Pipelle de Cornier取样器与诊断性刮宫对低级别内膜癌诊断敏感度分别为93.8%和97.0%;对高级别子宫内膜癌的诊断敏感度分别为99.2%和100%。子宫内膜取样器诊断子宫内膜癌,既减少子宫内膜癌确诊时间,同时避免了宫腔镜检查膨宫引起的子宫内膜癌扩散的担忧。但对于取样器取样及制片失败患者宫腔镜下子宫内膜诊断性刮宫是必需补充。必须明确子宫内膜取样器不能窥视宫腔情况、只能子宫内膜活检,不能全面刮宫。
本研究虽为前瞻性自身对照研究,但病例数有限,先取样器取样后宫腔镜下诊断性刮宫,对于子宫内膜菲薄的患者存在诊断性刮宫取样失败的结局,对取样器可靠性评估存在高估。需要组织多中心随机对照研究,明确其安全性、可靠性,适应人群及相对禁忌证,判断其应用于门诊的可能性及可信性。
综上所述,子宫内膜取样器操作轻便、无须麻醉、创伤小、操作时间短,取材成功率、标本满意度均与诊断性刮宫无明显差异,病理诊断一致性良好,无严重不良事件发生,可取代大部分常规诊断性刮宫。但对于绝经后、子宫内膜瘢痕化等情况下,宫腔镜下子宫内膜活检或刮宫是很好的补充。对于子宫内膜癌的高危患者,要谨慎对待子宫内膜取样器阴性结果。

