血管紧张素-(1-7)可改善球囊损伤后血管的舒张功能探讨
陈伟燕,邓武坚,杨其霖
(广州医科大学附属第二医院 1.重症医学科;2.普外科,广东 广州 510260)
冠脉再灌注治疗仍然是目前急性心肌梗死、稳定或不稳定性心绞痛等冠状动脉粥样硬化性疾病的主要治疗手段。但是统计发现仍有10%的患者在接受了成功的介入治疗后出现冠脉再狭窄[1]。众所周知,血管损伤,尤其是内皮损伤是球囊扩张术后再狭窄的主要原因。内皮具有维持血流动力学稳定,调节血细胞-血管壁相互作用,抑制血栓形成,调节血管平滑肌细胞生长等的作用。内皮损伤诱发损伤的自我修复,引起血管平滑肌细胞迁移至动脉内膜、增殖,合成细胞外基质,过度的修复最终引起血管腔的狭窄,血管舒缩功能受影响,顺应性明显下降[2]。
大量的研究报道肾素-血管紧张素系统(renin-angiotensin system,RAS) 在血管再狭窄过程中具有重要的作用。特别是血管紧张素(angiotensin,ANG)II被证实具有明显的加剧血管平滑肌细胞增殖、迁移和细胞外基质沉积的作用[3-4]。而作为RAS家族的新成员,ANG-(1-7)被认为具有与ANG II相反的作用,可减轻血管平滑肌细胞增殖、迁移,减少血管外基质沉积,影响凋亡,减轻动脉粥样硬化和再狭窄[5]。本研究主要通过持续给予ANG-(1-7)4周,观察ANG-(1-7)对球囊损伤后血管再狭窄的影响,及是否具有改善内皮依赖的血管舒张作用。
资料与方法
一、一般材料
ANG-(1-7)与A-779购于美国Bachem公司;渗透压微型泵(型号2m l4) 和球囊导管购于Durect公司;阿司匹林来自拜耳公司生产。
二、动物及分组
24只健康新西兰白兔,雌雄不限,重约1.7~2.2kg。所有动物行腹主动脉球囊损伤术后随机分为3组,每组8例:⑴对照组:术后经渗透压微型泵持续静脉给予生理盐水2.5μL/h,共4周;⑵ANG-(1-7)组:术后经渗透压微型泵持续静脉给予ANG-(1-7)576μg·kg-1·d-1,共4周;⑶ANG-(1-7)+A-779组:以下简称A-779组,术后经渗透压微型泵持续静脉给予ANG-(1-7)576μg·kg-1·d-1和A-779 576μg·kg-1·d-1共4周。
三、腹主动脉球囊损伤术
所有动物术前1d开始给予阿司匹林50mg口服,术前12h开始禁食,4h开始禁水。用3%戊巴比妥钠(1m l/kg) 静脉注射进行麻醉并固定于手术台上。右侧腹股沟备皮,消毒,铺巾后在股动脉搏动最明显处行纵切口,分离股动脉,应用21号桡动脉穿刺针穿刺,导入导引钢丝,并沿导引钢丝置入4F桡动脉鞘。回抽证实血流通畅后注入肝素钠200U/kg肝素化。接心电生理记录仪记录心率(heart rate,HR)、血压(blood pressure,BP)。然后经动脉鞘置入导引钢丝至膈下,沿导丝送入3.5mm×23mm球囊至腹主动脉膈下处,用压力泵以15个大气压充盈球囊,回抽球囊至有阻力,释放球囊内压力,如此反复3次,每次间隔1m in。拔除动脉鞘管后局部缝合包扎。另外颈部皮肤备皮,消毒铺巾后分离暴露颈静脉,结扎远心端,在中间作一小切口,将渗透压微型泵装好药后通过导管连接于颈静脉近心端,缝线固定,并把渗透压微型泵埋于附近皮下,缝合皮肤。术后通过耳缘静脉给予肝素钠5000U,并肌注庆大霉素8万U/d,连续3d。术后一直口服阿司匹林50mg/d[6]。
四、腹主动脉血流频谱测定
球囊损伤术前、术后和4周后,暴露腹主动脉,在右肾动脉开口上方约1cm处,利用多导生理记录仪(Biopac Systems Inc)超声探头记录局部血流频谱,包括收缩期峰值流速(peak systolic velocity,PSV)、舒张末期流速(end diastolic velocity,EDV)和平均血流速度(mean velocity,Vmean)。而阻力指数(resistance index,RI)和搏动指数(pulse index,PI)通过以下公式计算:RI=(PSV-EDV)/PSV;PI=(PSV-EDV) /Vmean。其中球囊损伤前后4周后分别持续记录5m in,球囊损伤术后持续记录15m in。
五、HE染色计算新生内膜及狭窄率
术后4周取右肾动脉开口上方1cm处腹主动脉行石蜡切片,然后用苏木精-伊红(HE)染色。HE染色玻片在显微镜下拍照,用Image Pro-Plus软件进行分析,计算官腔面积、内弹力板周径、外弹力板周径、内膜和中膜厚度。内膜厚度=(内弹力板周径-管腔周径) /2π;中膜厚度=(外弹力板周径-内弹力板周径) /2π。新生内膜面积=内弹力板围绕面积-管腔面积。狭窄率=新生内膜面积/(管腔面积+新生内膜面积)×100%。每张切片测量3次,取平均值[7]。
六、统计学分析
结 果
一、球囊损伤后血流频谱随时间的短期变化情况
如图1,球囊损伤后即刻,通过多导心电生理记录仪可记录到损伤血管局部Vmean和RI在术后1min,3min,5m in,7m in,10m in和15m in始终保持稳定,而EDV和舒张压(diastolic blood pressure,DBP)随时间延长呈逐渐升高趋势,直到10m in开始较1m in和3m in出现明显的统计学差异(P<0.05)。另一方面,PSV和PI随时间延长呈逐渐下降趋势,直到10m in开始较1m in和3m in出现明显的统计学差异(P<0.05)。而SBP(systolic blood pressure,SBP) 和心率在各时间点无明显变化(P>0.05)。
二、ANG-(1-7)可改善球囊损伤引起的血管舒张受限
如图2所见,基线和术后即刻的BP,HR,PSV,EDV,Vmean,RI,PI在各组间无明显差异。球囊损伤后即刻可引起各组局部血管PSV较术前明显升高 (P<0.05),而EDV和Vmean明显下降(P<0.05)。其中术后即刻的PSV在对照组为(81.57±21.55)cm/s,在ANG-(1-7)组为(76.73±14.36) cm/s。RI[对照组:术后 (1.25±0.08) vs.术前 (1.14±0.06),P<0.05;ANG-(1-7)组:术后(1.13±0.11) vs.术前 (1.05±0.11),P<0.05]和PI[对照组:术后(6.41±1.21) vs.术前(3.97±0.82),P<0.05;ANG-(1-7)组:术后 (5.46±1.74) vs.术前 (3.12±0.80),P<0.05]在各组也较术前明显升高。
4周后,PSV和Vmean在各组均较术前和术后即刻出现明显下降(P<0.05)。而EDV,RI和PI均较术后有不同程度下降(P<0.05),但较基线变化不明显 (P>0.05)。持续给予ANG-(1-7)周,与对照组比较可明显降低RI[(0.99±0.10) vs.(1.13±0.08),P<0.05]和PI[(2.90±0.60) vs.(5.19 ±1.83),P<0.05]。ANG-(1-7) 特异性受体拮抗剂A-779可部分逆转ANG-(1-7)对PI的作用[(4.15±1.3) vs.(2.90±0.60),P<0.05]。球囊损伤后4周的BP和HR在各组间无明显差异(P>0.05)。
三、ANG-(1-7)对球囊损伤后血管内膜的影响

图1 球囊损伤后血流动力学的变化

图2 ANG-(1-7)对球囊损伤后血流动力学的影响
静脉持续给予ANG-(1-7)4周后,HE染色可见,见图3,球囊损伤引起新生血管内膜形成。表1数据说明,ANG-(1-7)较对照组可明显减轻新生内膜厚度 [(0.21±0.02) μm vs.(0.52±0.02) μm,P<0.05],新生内膜面积 [(0.29±0.01) mm2vs.(0.50±0.02) mm2,P<0.05]和管腔狭窄率[(29.9±2.7) %vs.(43.2±2.9) %,P<0.01],而对中膜厚度没有影响(P>0.05)。A-779可在一定程度上抵消ANG-(1-7)的保护作用(P<0.05)。

图3 腹主动脉HE染色(20×20)
表1 球囊损伤4周后新生内膜情况(±s)
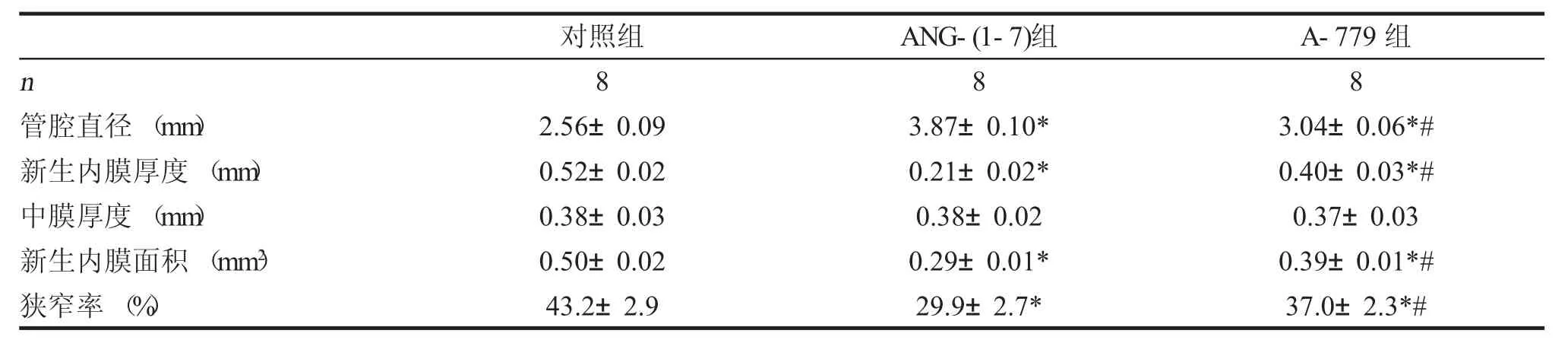
表1 球囊损伤4周后新生内膜情况(±s)
注:*vs.对照组,P<0.05;#vs.ANG-(1-7)组,P<0.05。
对照组n 8管腔直径(mm) 2.56±0.09 ANG-(1-7)组8 3.87±0.10*A-779组8 3.04±0.06*#新生内膜厚度(mm) 0.52±0.02 0.21±0.02* 0.40±0.03*#中膜厚度 (mm) 0.38±0.03 0.38±0.02 0.37±0.03新生内膜面积(mm2)0.50±0.02 0.29±0.01*0.39±0.01*#狭窄率(%) 43.2±2.9 29.9±2.7*37.0±2.3*#
讨 论
血管损伤可致内皮依赖性血管舒张受损,进而发展为动脉粥样硬化或血管再狭窄。而球囊损伤后血管再狭窄的机制十分复杂,其中包括了血管收缩、重构、内膜增生、血管平滑肌细胞出现、增殖和细胞外基质沉积等[2]。RAS系统被认为在血管再狭窄中扮演重要角色。ANG II通过作用于血管紧张素受体可引起细胞表型改变、促进细胞增生,甚至通过调节基因表达促进心肌细胞肥大、纤维化等[4]。
ANG-(1-7)作为RAS系统中的活性七肽,已被报道具有多种心血管保护作用。Freeman等人发现ANG-(1-7)可以抑制血清或血小板来源的生长因子和ANG II刺激导致的血管平滑肌细胞的增殖[7]。Tallant等人报道ANG-(1-7)可抑制ANG II激活的丝裂酶原反应和细胞外信号调节酶反应[8]。我们既往的研究也发现ANG-(1-7)可减轻血管损伤后的血管再狭窄[9]。
本研究中发现,ANG-(1-7)可明显减轻球囊损伤所致的血管内膜形成及管腔狭窄,说明ANG-(1-7)具有减轻血管非正常损伤修复的作用。众所周知,内皮具有维持血流动力学稳定,调节血管舒缩的功能。尤其是血管的舒张功能依赖于内皮功能的完整,血管内皮受损或修复异常,均可引起内皮依赖的舒张功能失调。PSV和EDV作为心血管疾病的危险因素已有较多报道[10-11]。Chuang等人发现颈总动脉EDV与颈动脉内膜-中膜厚度呈负相关,而颈动脉内膜-中膜厚度被认为是动脉粥样硬化疾病的不良标志[12]。本研究通过观察球囊损伤术前、术后即刻和4周后腹主动脉局部的血流频谱发现,PSV在术后即刻出现明显升高,4周后明显下降,而EDV和Vmean在术后即出现明显下降,4周后进一步降低。以上均说明球囊损伤术后血管局部的收缩和舒张功能受损,甚至出现血管再狭窄。持续给予ANG-(1-7)4周,可以明显提高EDV,而ANG-(1-7)特异性受体拮抗剂可抵消部分ANG-(1-7)的作用,这说明ANG-(1-7)在一定程度上具有改善球囊损伤所致的内皮依赖性血管舒张功能下降。
尽管PSV和EDV可以预测心脑血管事件的作用,但它们被认为在超声检查中受较多因素影响,如探测技术和生理状态等,具有较大可变性。本研究采用的超声探头为固定在血管表面,具有角度较为恒定的优点,受探测技术影响较小,结果更为可靠。当然,RI和PI能更稳定反映血管阻力和顺应性,受影响因素较小,和动脉硬化程度相关[13]。Lee等人发现颈动脉的RI可用于高血压患者进行患冠心病的危险分层[14]。另外,PI增高被发现与血管弥漫性病变独立相关。本研究发现ANG-(1-7)可降低球囊损伤术后PI和RI的值,一方面进一步说明ANG-(1-7)可减轻血管损伤后的血管阻力升高,改善血管舒张功能,另一方面可能从侧面反映ANG-(1-7)对动脉硬化或血管狭窄有保护作用。

