染料木素共聚物纳米胶束冻干粉的制备及性质*
覃雯,成秋宸,卓朗
(广西壮族自治区药用植物园,南宁 530023)
染料木素(genistein,GS)化学名为4',5,7-三羟基异黄酮,广泛存在于大豆、山豆根、槐角等豆科植物根部,具有抗氧化、抗肿瘤、抑菌、降血脂等多种生物学活性,且对大多数动物的毒性极低[1-2],开发应用前景广阔。1996年,美国国家肿瘤研究中心已将染料木素列入肿瘤化学预防药物临床发展计划[3]。目前,国内外已有多种以染料木素为主药的制剂,包括染料木素胶囊、骨宝昕肾片、血脂康胶囊、染料木素阴道片、痔特佳片等。染料木素可以溶于二甲亚砜(DMSO)、丙酮、乙醇等有机溶剂,但是其在水中溶解度极低,仅为1.43 μg·mL-1[4],由于受到水溶性的影响,生物利用度极低。
纳米药物是一种将药物纳米化或者将药物载入纳米药物载体中的一种新型药物制剂方法,纳米药物可实现药物的缓控释性和靶向性,提高药物溶解性[5]。纳米聚合物胶束载体可以是天然化合物或化学合成聚合物,二者均要求具有良好的生物可降解性和安全性[6-8]。化学合成物可根据药物的性质进行合成设计。聚乙二醇-聚乳酸(polyethylene glycol-polylactic acid,PEG-PLA)是由聚乙二醇(PEG)和聚乳酸(PLA)通过共聚反应生成的一种共聚物,具有亲水和亲油两种基团,是一种两亲性化合物。聚合物纳米载药系统是纳米载药系统中的一种,制备方法包括聚合法、溶剂挥发法、纳米沉淀法等。本研究选用共聚物PEG-PLA为染料木素的药物载体,在溶剂挥发法的基础上稍做改进,制备染料木素共聚物纳米胶束,以增加其分散性,从而提高其生物利用度。
液体制剂存在易引起化学降解、霉变和体积大等缺点,不利于长期运输、存储和携带。笔者选用冷冻干燥法制备出染料木素共聚物纳米胶束(genistein micellar,GS-ML)冻干粉,以不同冻干保护剂制备的冻干粉外观、再分散性、复溶后的粒径和Zeta电位为考察指标,确定冻干保护剂及冻干工艺,以期制备出易于存储且在水中分散性较好的GS-ML冻干粉。
1 仪器与试药
1.1仪器 LGJ-10E型冷冻干燥机(北京四环科学仪器厂有限公司),Malven ZS90X型马尔文纳米粒度仪(英国Malven公司 ),磁力搅拌器(美国Scilogex公司),CP224S型万分之一电子天平(德国Sartorius公司),高压灭菌锅(上海博讯实业有限公司医疗设备厂),透射电镜(日本,HTACHI公司,H-7650型)。
1.2药品与试剂 PEG-PLA(规格:20 g,含量:90%,PEG封端,PEG 相对分子质量5000,聚消旋乳酸(PLLDA )相对分子质量45 000,PEG:PLLDA=5:95,西安瑞禧生物科技有限公司,批号:RJ017196),GS(规格:100 g,含量:98.25%,南京泽朗医药科技有限公司,批号:ZL140615063YY),聚山梨酯-80为药用级(规格:500 mL,江西益普生药业有限公司),甘露醇、乳糖均为分析纯(规格:500 g,山东西亚化学工业有限公司),甘氨酸、肌醇、聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)均为分析纯(规格:500 g,天津市科密欧化学试剂有限公司),蔗糖为分析纯(规格:500 g,成都金山化学试剂有限公司)、葡萄糖为分析纯(规格:500 g,西陇化工股份有限公司),丙酮、PEG400均为分析纯(规格:500 mL,天津市大茂试剂厂),可溶淀粉、山梨醇均为分析纯(规格:500 g,天津市大茂试剂厂),麦芽糖、右旋糖酐、半乳糖均为分析纯(规格:500 g,合肥志宏生物技术有限公司),海藻糖为分析纯(规格:500 g,上海麦克林生化科技有限公司),DMSO、硫酸亚铁(FeSO4)均为分析纯(规格:500 mL,天津市富宇精细化工有限公司),过氧化氢(H2O2,规格:500 mL,含量:30%,成都市科龙化工试剂厂),水杨酸为分析纯(规格:500 g,天津市博迪化工股份有限公司),无水乙醇(规格:2500 mL,成都市科隆化学品有限公司)。
2 方法与结果
2.1实验方法
2.1.1GS-ML的制备 溶剂挥发法制备GS-ML[9-12]。分别称取PEG-PLA 40 mg,GS 5 mg、聚山梨酯-80 165 mg溶于6 mL丙酮中,混匀。将混匀的丙酮混合溶液加入搅拌状态的纯化水60 mL中,磁力搅拌8 h,挥发溶液中的丙酮,得到GS-ML。
改良溶剂挥发法制备GS-ML[9-12]。分别取PEG-PLA 40 mg、GS 5 mg、聚山梨酯-80 165 mg溶于丙酮6 mL中,混匀。将混匀的丙酮混合溶液加入搅拌状态的纯化水60 mL中,磁力搅拌8 h,挥发溶液中的丙酮,得到GS-ML混合溶液。参考高压均质法[13],用高压灭菌锅在温度121 ℃、0.3 MPa条件下高压GS-ML混合溶液20 min,冷却,即得GS-ML。将采用溶剂挥发法和改良溶剂挥发法制备的GS-ML静置,观察两种胶束体系的稳定性。
称取适量冻干保护剂加入GS-ML中,混匀,进行预冻和冻干,得到GS-ML冻干粉。
2.1.2染料木素共聚物纳米胶束的形态观察 取少量染料木素共聚物纳米胶束清液于铜网上,晾干后进行透射电镜测试,电压为100 kV,放大300 000倍,观察样品形态。
2.1.3冻干保护剂的选择 ①冻干保护剂种类的初步筛选。按设定程序进行预冻和冻干,分别考察以甘露醇、甘氨酸、蔗糖、乳糖、葡萄糖、PVP、PEG400、可溶淀粉、山梨醇、肌醇、麦芽糖、右旋糖酐、半乳糖、海藻糖为冻干保护剂制备GS-ML冻干粉的冻干效果[14]。同时设立无冻干保护剂的空白对照。分别取各处方冻干样品,观察冻干粉的外观,加入纯化水复溶测定冻干粉再分散性,记录再分散时间,用马尔文激光纳米粒度仪测定冻干样品粒径、Zeta电位,初步筛选出冻干效果较好的冻干保护剂。
②冻干保护剂具体用量的确定。通过评价不同浓度冻干保护剂GS-ML冻干粉的冻干效果,确定冻干保护剂的具体用量。
③冷冻干燥的工艺研究。对共聚物纳米胶束进行预冻过程参数测定,绘制出物料预冻过程中的物料温度-时间曲线,以此估计共晶点温度。样品升华干燥过程的第一阶段温度必须低于共晶点温度,通过搁板控温控制样品的升华干燥过程,绘制出物料升华干燥过程中的物料温度-时间曲线。
2.1.4GS-ML冻干粉理化性质考察 ①分散性:取筛选出冻干剂制备的GS-ML冻干粉重新分散于纯化水中,观察GS-ML在水中的分散性。②对羟自由基清除作用:根据Fenton反应原理产生·OH,H2O2的量和Fenton反应产生的·OH量成正比。取GS 10 mg溶于DMSO 200μL或含GS 10 mg的GS-ML冻干粉溶于水200 μL中,分别配置成含1.25,2.5,5,10,20,40,80,160 μg·mL-1GS溶液。吸取60 μL 不同浓度样品于96孔板中,加入10 mmol·L-1FeSO4溶液60 μL,再加入10 mmol ·L-1水杨酸-乙醇溶液60 μL,最后加入8.8 mmol·L-1H2O220 μL启动反应。37 ℃反应30 min,以纯化水作参比,测定不同样品在510 nm下的吸光度值[15]。
A0:空白对照液的吸光度;Ax:样品溶液的吸光度;Ano:不加显色剂H2O2样品溶液本底的吸光度。
2.2实验结果
2.2.1染料木素共聚物纳米胶束的稳定性和形态 将溶剂挥发法和改良溶剂挥发法制备的GS-ML静置观察。3 d后采用溶剂挥发法制备的GS-ML出现白色沉淀,改良溶剂挥发法制备的GS-ML在7 d内为略带蓝光的溶液体系且无明显沉淀,故选择改良溶剂挥发法进行后续GS-ML制备实验。
改良溶剂挥发法制备的GS-ML透射电镜图如图1所示,形态为一个圆环状中空光圈,粒径约100 nm,大小均匀。

图1 染料木素共聚物纳米胶束透射电镜图
Fig.1MorphologyofgenisteinmicelleobservedbyTEM
2.2.2冻干保护剂的选择 ①冻干保护剂种类的初步筛选:大部分药物冻干时加入冻干保护剂浓度为4%~25%,冻干样品以颜色均匀、孔隙致密、保持冻干前体积、性状基本不变,形成疏松团块结构为宜[16]。用不同冻干保护剂冻干制备出的GS-ML冻干粉的状态和溶解性见表1,粒径和多分散性指数(polydispersity index,PDI)见表2。初步筛选结果显示,选用20%蔗糖、20%海藻糖作为冻干保护剂,冻干样品呈粉饼状且样品平整饱满,粒径约200 nm,PDI<0.3,再分散时间<30 s,冻干效果较好,初步确定蔗糖和海藻糖可作为GS-ML的冻干保护剂。
表1 GS-ML冻干保护剂的初步筛选
Tab.1ThepreliminaryscreeningofcryoprotectantforGS-MLn=3

保护剂冻干样品状态再分散时间/s空白不符合要求不符合要求20%海藻糖呈白色,粉饼状,饱满,无塌陷1020%甘氨酸呈白色,粉饼状,饱满,无塌陷1010%乳糖呈白色,粉饼状,饱满,无塌陷1020%蔗糖呈白色,粉饼状,饱满,无塌陷3020%甘露醇呈白色,粉饼状,饱满,无塌陷3020%麦芽糖呈白色,粉饼状,饱满,无塌陷3010%PVP呈白色,粉饼状,饱满,无塌陷6020%葡萄糖呈白色,有大量孔隙6020%PEG400不符合要求1020%山梨醇不符合要求3010%肌醇呈白色,粉饼状,饱满,无塌陷不符合要求20%半乳糖呈白色,有大量孔隙不符合要求20%右旋糖呈白色,有大量孔隙不符合要求10%可溶淀粉不符合要求不符合要求
表2 GS-ML冻干粉的粒径及PDI
Tab.2ParticlesizeandPDIofGS-MLlyophilizedpowder

不同保护剂制备的GS-ML冻干粉粒径/nmPDI20%海藻糖226.10±32.420.110±0.03420%甘氨酸1 095.40±342.370.209±0.13010%乳糖660.27±52.810.219±0.15120%蔗糖234.43±17.180.210±0.07320%甘露醇351.97±44.440.353±0.05920%麦芽糖696.83±127.780.154±0.13210%PVP1 281.90±580.080.190±0.09820%葡萄糖243.27±11.640.162±0.00920%PEG400258.77±112.120.296±0.10420%山梨醇644.63±25.830.390±0.091
②冻干保护剂具体用量的确定:分别以5%,10%,20%,30%蔗糖或海藻糖为冻干保护剂冻干GS-ML,确定两种冻干保护剂的具体用量。以不同浓度蔗糖或海藻糖为冻干保护剂制备冻干样品的再分散性及PDI值见表3,粒径和Zeta电位见图2。不同浓度蔗糖为冻干保护剂再分散后的粒径差异有统计学意义(F=38.39,P<0.01);Zeta电位差异有统计学意义(F=10.18,P<0.01)。不同浓度海藻糖为冻干保护剂再分散后的Zeta电位差异有统计学意义(F=10.87,P<0.01)。未冻干GS-ML溶液和以5%蔗糖为冻干保护剂再分散后粒径分布见图3,4。结果显示,选择5%蔗糖作为冻干保护剂的冻干样品冻干效果较好,确定5%蔗糖为GS-ML的冻干保护剂。
表3 蔗糖或海藻糖为冻干保护剂的再分散性及PDI值

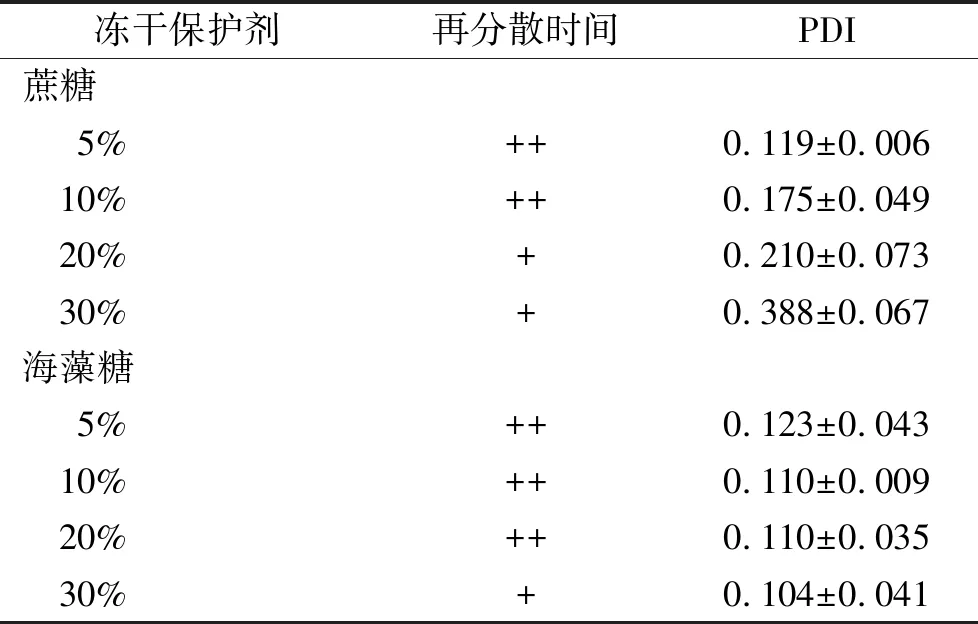
冻干保护剂再分散时间PDI蔗糖 5%++0.119±0.006 10%++0.175±0.049 20%+0.210±0.073 30%+0.388±0.067海藻糖 5%++0.123±0.043 10%++0.110±0.009 20%++0.110±0.035 30%+0.104±0.041
+:30 s内溶解完全;++:10 s内溶解完全。
+:Completely dissolved in 30 s;++:Completely dissolved in 10 s.
2.2.3冷冻干燥的工艺研究 ①预冻阶段:冻结过程的降温速率对冻干样品的性质有较大影响,样品降温速率越快,晶核越多结晶越小,冻干产品结构均一且细腻。预冻过程中若样品不完全冻结,升华干燥过程会出现喷瓶现象,预冻时必须在共晶点以下保持2~3 h[12]。将样品置于-60 ℃冷肼中预冻,对共聚物纳米胶束进行预冻过程参数测定,绘制出冷冻干燥机物料温度-时间曲线,如图5所示,样品在约-7 ℃出现了温度回升,提示该样品的最低共晶点区间在约-7 ℃。预冻时间设置为5 h,样品完全冻结,温度达到-50 ℃,升华干燥过程不出现喷瓶的现象。
②升华干燥阶段:冷冻干燥机通过搁板控温进行样品的升华干燥。升华阶段设定为-35 ℃,升温1 min,恒定2 h;-33 ℃,升温1 min,恒定5 h;-30 ℃,升温1 min,恒定5 h;0 ℃,升温1 min,恒定2 h;25 ℃,升温1 min,恒定2 h。样品升华过程中物料温度-时间曲线,如图6所示。升华干燥16 h后,样品达到17 ℃,升华干燥阶段结束。
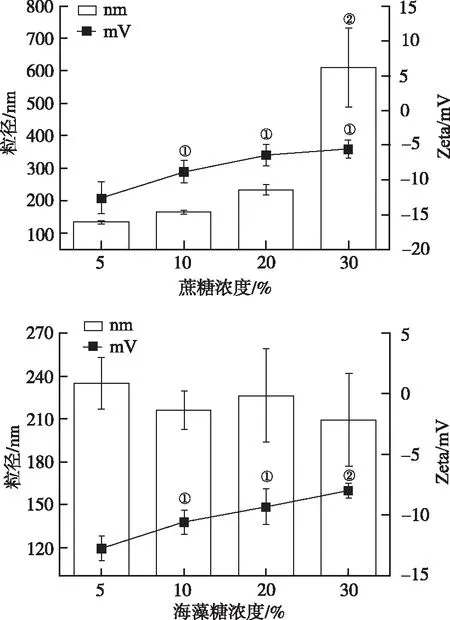
①与含5%冻干保护剂组比较,P<0.05;②与含5%冻干保护剂组比较,P<0.01。

①Comparison with 5% cryoprotectant,P<0.05;②Comparison with 5% cryoprotectant,P<0.01.


图3 未冻干GS-ML粒径分布图
Fig.3ParticlesizedistributionofGS-MLwithoutfreeze-drying

图4 以5%蔗糖为冻干保护剂再分散后GS-ML粒径分布图
Fig.4ParticlesizedistributionofGS-MLwith5%sucroseascryoprotectantafterredispersion

图5 冷冻干燥机预冻阶段物料温度-时间曲线
Fig.5Materialtemperature-timecurveoffreezedryingatpre-freezingstage
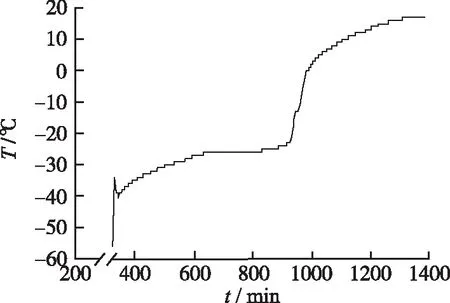
图6 冷冻干燥机升华干燥阶段物料温度-时间曲线
Fig.6Materialtemperature-timecurveoffreezedryingatsublimationstage
2.2.4GS-ML冻干粉理化性质考察 ①分散性:取GS-ML冻干粉0.2 g,加入纯化水500 μL,得到略带淡蓝色乳光的胶束体系,静置后不分层,体系中GS含量达到333.32 μg·mL-1。
②羟自由基清除作用:含不同浓度GS的单体和GS-ML冻干粉的羟自由基清除率如图7所示。结果显示,GS浓度在1.25~80 μg·mL-1范围内,GS-ML冻干粉的羟自由基随着体系中GS浓度的升高清除率逐渐增强;而GS单体的羟自由基清除率随着浓度的增加先增大后减小。
3 讨论
GS是一种具有抗氧化性和较好稳定性的异黄酮类化合物,由于溶解性差使其生物利用度极低[4,17-19]。共聚物聚己内酯-聚乙二醇(PEG-PCL)和中链三酰甘油曾被作为GS的药物载体,PEG-PLA也曾作为表没食子儿茶素没食子酸的药物载体,提高了表没食子儿茶素没食子酸的药效[4]。借鉴此思路制备GS纳米乳,可提高GS的溶解性、缓控释性,解决了GS生物利用度低的问题[20]。溶剂挥发法是将聚合物和药物溶于有机溶剂中,加入含有表面活性剂的溶液中,通过连续搅拌等方式把有机溶剂挥发除去。但此法制备出的纳米胶束通常粒径不够均匀,且胶束体系不稳定。本研究在溶剂挥发法的基础上稍作修改,增加类似于均质化过程的高压步骤,制备出了尺寸均匀、粒径达纳米级的GS-ML。
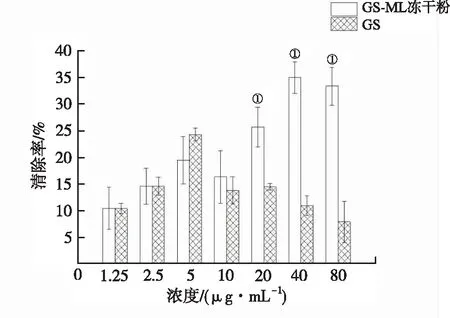
①与GS比较,P<0.01。

①Compared with GS,P<0.01.

纳米胶束系统具有热力学不稳定性的特点,为实现纳米制剂的长期保存,可选用冷冻干燥法进行冻干。研究表明,冷冻干燥法是通过升华作用实现样品干燥的,但在冷冻干燥过程中由于易使样品样品发生团聚,加入冻干保护剂可避免样品发生团聚而保持其物理化学性质[21]。本研究中,不加冻干保护剂的空白样品由于没有冻干保护剂的支撑保护作用,样品冻干后聚集、萎缩、呈膜状,无法在纯化水中再分散。加入冻干保护剂的样品在纳米胶束之间形成空间保护层,可维持纳米胶束的空间结构,从而起到了防止GS-ML团聚的作用。研究发现不同类型的冻干保护剂对冻干的影响很大,可能与不同类型糖基与共聚物及药物之间的相互作用有关。冻干保护剂蔗糖的用量对GS-ML冻干粉冻干状态、再分散效果及粒径大小有较大影响,加入更多的蔗糖并不能提高GS-ML的稳定性,反而使得GS-ML更易聚集在一起,形成胶束之间的黏连。预冻过程中,在初步确定了共聚物胶束共晶点范围的基础上,建立了共聚物胶束冻干工艺曲线。冻干过程通过搁板控温进行样品的升华干燥,实现的样品冻干过程不出现喷瓶现象,得到符合冻干制剂外观要求的样品。
分散性实验结果显示,体系中GS含量达到333.32 μg·mL-1,是文献报道的GS在水中溶解度1.43 μg·mL-1的233倍,GS-ML体系显著提高GS在水溶液体系中的含量。GS-ML冻干粉在水溶液体系中分散性好,粒径也较小,随着加入量的增多并不会聚集成大颗粒;而GS在水中的溶解度比较低,加入量越多使得GS单体聚集成大颗粒,影响GS的生物利用度,从而降低了GS单体的羟自由基清除率。
在此冻干保护剂和冻干工艺的基础上制备出的冻干粉粒径及Zeta电位变化较小,且大大提高了GS的溶解度,增强GS的体外羟自由基清除率,该工艺可以较大程度发挥GS的生物学效应,为深入探讨GS的生物学机制奠定基础。

