植物源活性物质对鲁氏接合酵母抑菌活性评价及抑菌机制研究
王虎玄,张淑晴,廖 川,钟小荣,孙宏民
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
0 引言
鲁氏接合酵母(Zygosaccharomycesrouxii)属于掷孢酵母科,具有嗜高渗、耐酸等特性,能够引起蜂蜜、浓缩果蔬汁、果酱、饼干、糕点、面包等食品腐败变质[1].该菌的污染负面影响食品的外观、口感风味以及营养价值,对人体健康具有一定潜在危害.该菌还能代谢产气,引发胀包,特别是玻璃瓶密封包装,严重胀包会引发爆瓶,对消费者身体造成物理伤害[2,3].因此,研究建立安全、高效的控制方法,及时去除Z.rouxii污染,切实保证相关食品的质量安全,对保障消费者健康具有现实意义.
目前,对食品储存过程中腐败酵母的污染主要通过低温和添加防腐剂进行防控.但低温只能减缓腐败的发生,并不能防止腐败;传统防腐剂存在效果差、具有潜在毒性等弊端.随着现代食品质量标准的提高,对天然、无害、高效食品防腐剂的研究已成为热点[4].
植物源抑菌物质是指来源于植物的根、茎、叶、花、果、种子或其次生代谢产物,具有抑菌作用的活性物质[5].植物源抑菌物质在自然界分布广泛,具有多种生理活性,符合目前食品产业提倡的天然、营养、功能化食品添加剂的发展方向,并且来源广泛,消费者认可程度高[6,7].研究表明,来源于不同草本植物的精油提取物由于含有大量具有生理活性的次级代谢产物从而表现出高效抑制甚至杀灭细菌[8]、酵母菌[9]和霉菌[10]防腐效果.但有关植物源活性物质对食品中鲁氏接合酵母污染的防控研究尚未见报道.
基于此,本研究选取包括多酚类、黄酮类、醌类、萜类和皂苷类等16种天然植物源化合物为潜在食品防腐剂,首先通过抑菌试验筛选对鲁氏接合酵母菌(标准菌株和食品来源分离菌株)具有高效抑菌活性的植物源物质,然后从细胞膜通透性、完整性等方面对目标植物源物质的潜在抑菌机制进行解析,最后通过场发射扫描电镜观察细胞形态变化,以验证植物源抑菌物质对酵母细胞膜特性的影响.实验结果可为天然、高效食品防腐剂开发并有效防控食品中鲁氏接合酵母的污染奠定理论基础.
1 材料和方法
1.1 菌种与试剂
酵母菌种:鲁氏接合酵母(Zygosaccharomycesrouxii)分离菌株B-WHX-12-53及鲁氏接合酵母标准菌株ATCC 2623由西北农林科技大学食品科学与工程学院健康食品制造实验室提供.
植物源抑菌物质:硫辛酸(1077-28-7)、咖啡酸(331-39-5)、没食子酸(149-91-7)、大蒜素(539-86-6)、表儿茶素(490-46-0)、绿原酸(327-97-9)、丁香酸(530-57-4)、丹皮酚(552-41-0)、阿魏酸(1135-24-6)、槲皮素(117-39-5)、柠檬醛(5392-40-5)、原儿茶酸(2954-52-1)、香荆芥酚(499-75-2)、百里醌(490-91-5)、肉桂醛(104-55-2)、麝香草酚(89-83-8),以上植物源抑菌物质均由上海源叶生物科技有限公司提供,且均为食品级标准品,纯度99%以上.
YPD培养基:葡萄糖20 g,蛋白胨20 g,酵母浸粉10 g,蒸馏水1 000 mL,如需固体培养基加入琼脂粉20 g.
生理盐水:氯化钠8.5 g,用蒸馏水定容至1 000 mL.
磷酸缓冲液(pH 7.4):A液(0.2 M NaH2PO4·H2O),称取2.76 g NaH2PO4·H2O溶于蒸馏水,稀释定容至100 mL;B液(0.2 M Na2HPO4·H2O),称取5.36 g Na2HPO4·H2O溶于蒸馏水,稀释定容至100 mL.取A液19.00 mL,B液81.00 mL混合,测定混合液pH.
2.5%戊二醛:10 mL 50%戊二醛,加蒸馏水定容至200 mL.
1.2 主要仪器及设备
JM-B20001型电子天平,余姚市纪铭称重校验设备有限公司;手提式高压灭菌锅,上海申安医疗器械厂;SW-CJ-2F 超净工作台,苏州安泰空气技术有限公司;101-2型电热鼓风干燥箱,北京科伟永兴仪器有限公司;TDL-40B型台式离心机,上海安亭科学仪器厂;SHA-BA 恒温振荡器,常州澳华仪器有限公司;SP-756P紫外可见分光光度计,上海光谱仪器有限公司;DDS-11D电导率仪,上海仪电科学仪器股份有限公司;飞纳Phenom pro台式扫描电镜,飞纳科学仪器(上海)有限公司;Imager M2荧光显微镜,卡尔蔡司光学(中国)有限公司.
1.3 试验方法
1.3.1 菌种活化
将冻存于-40 ℃的鲁氏接合酵母在YPD培养基中活化两次.挑取单菌落接种于YPD液体培养基中,置于27 ℃培养48 h后经离心(6 000 g,10 min)收集菌体,并使用磷酸盐缓冲液(pH 7.4)洗涤菌体3次.随后使用磷酸盐缓冲液重悬菌体,测定并调整菌悬液OD600,使菌悬液菌体浓度约为6.0 log CFU/mL(血球计数板计数).
1.3.2 抑菌圈的测定
使用滤纸片扩散法进行抑菌圈测定[11].取100μL菌悬液均匀涂布于YPD培养基上,静置5 min.取直径6 mm左右的无菌滤纸片分别于各植物源化合物溶液(10 mg/mL,YPD液体溶解)中浸泡10 min.然后夹取浸泡滤纸片轻置于YPD培养基上.随后将培养基正置于27 ℃培养72 h后用游标卡尺测量抑菌圈直径.以不含有植物源化合物的YPD液体作为对照组.每个样品做3次平行测定.
1.3.3 最小抑菌浓度(MICs)的测定
采用双倍稀释法测定最小抑菌浓度[12].利用无菌YPD液体培养基将植物源化合物稀释成系列双倍浓度梯度的溶液,分别取10 mL置于无菌试管中.向每支试管中加入50μL菌悬液,充分混匀后置于摇床培养48 h(27 ℃,200 rpm).采用紫外分光光度计测定培养液OD600,运用t检验对0 h(接种后立即所测光密度值)和48 h光密度值进行比较,如果0 h与48 h测量值无显著差异(p<0.05),则认为该植物源化合物浓度为MIC.以不含有植物源化合物的YPD培养基作为对照组.每种处理做3次平行测定.
1.3.4 优选植物源化合物对鲁氏接合酵母菌生长曲线的影响
参照前人研究方法[13],调整菌悬液OD600= 0.1并按1%的接种量接种于YPD培养液中.然后向培养液中加入优选植物源化合物溶液(使用YPD配制),使其终浓度分别为1/2MIC、MIC和 2MIC.将样品置于27 ℃培养48 h,每隔4 h测定培养液OD600.样品对照组不添加植物源化合物,空白对照组不添加菌悬液和植物源化合物.每种处理做3次平行测定.
1.3.5 优选植物源化合物对鲁氏接合酵母菌细胞膜通透性的影响
参考郭崇婷[14]的方法采用电导率仪进行细胞膜通透性测定.离心收集酵母菌体,磷酸盐缓冲液(pH 7.4)洗涤3次后用无菌生理盐水稀释菌体浓度至6.0~7.0 log CFU/mL.按1%的接种量取菌悬液接种至YPD液体培养基中,随后向培养基中添加优选植物源化合物溶液,使其终浓度分别为MIC和2MIC.将培养基置于摇床培养(27 ℃,150 rpm),分别于0 h、2 h、4 h、6 h、8 h、10 h、12 h各取5 mL菌悬液,离心(6 000 g,10 min)取其上清液检测电导率.以不添加优选植物源化合物的培养液为对照组,各处理平行测定3次.
1.3.6 优选植物源化合物对鲁氏接合酵母菌细胞膜完整性的影响
参照黄云坡等[15]的方法,利用PI染料荧光特性探究优选植物源化合物对鲁氏接合酵母细胞膜完整性的影响.离心收集酵母菌体,磷酸盐缓冲液(pH 7.4)洗涤3次后重悬.向离心管中分别加入2 mL的菌液,分成A、B管:A管加入2 mL磷酸缓冲液(阴性对照);B管中加入2 mL优选植物源化合物溶液,使其终浓度为MIC.27 ℃处理2 h后分别在A、B管中加入终浓度为10μg/mL的PI溶液,4 ℃下沾染20 min.离心收集菌体(6 000 g,10 min),磷酸盐缓冲液(pH 7.4)洗涤3次后重悬.分别取10μL A管和B管菌液滴在载玻片上,室温半干后盖上盖玻片,荧光显微镜下观察,得到绿光激发下的图像.各处理平行测定3次.
1.3.7 优选植物源化合物对鲁氏接合酵母菌细胞形态的影响
参考Vivek等[16]的方法采用场发射扫描电镜解析优选植物源化合物对鲁氏接合酵母细胞形态的影响.离心收集酵母菌体,磷酸盐缓冲液(pH 7.4)洗涤3次后加入优选植物源化合物溶液,使其终浓度分别为MIC和2MIC,27 ℃下摇床处理(120 rpm)处理6 h.使用磷酸缓冲液(0.1 mol/mL,pH 7.4)洗涤菌体3次后重悬浮于2.5%戊二醛中,4 ℃过夜固定.固定后菌体使用乙醇溶液(30%、50%、70%、90%、100%,v/v)梯度逐级脱水.脱水菌体60 ℃烘干12 h后镀金处理并置于扫描电镜下观察并拍照.以不含优选植物源化合物的菌悬液为对照组,各处理平行测定3次.
1.3.8 数据处理
数据以平均值±标准差的形式表示,使用SPSS软件对数据进行必要统计分析.
2 结果与讨论
2.1 植物源化合物对鲁氏接合酵母的抑制活性测定
采用滤纸片扩散法对16种植物源化合物抑制鲁氏接合酵母菌株LB生长的活性进行了测定.结果如表1所示,16种植物源化合物对鲁氏接合酵母均有一定的生长抑制活性.麝香草酚、香荆荠酚和百里醌表现出较强抑制活性,抑菌圈直径超过14 mm;肉桂醛、槲皮素、柠檬醛、原儿茶酸、丹皮酚和阿魏酸也具有一定抑制作用,抑菌圈直径介于13~14 mm之间.其余化合物的抑制活性相对较弱,抑菌圈直径小于13 mm.总的来说,麝香草酚抑制活性最强,没食子酸抑制作用最弱.
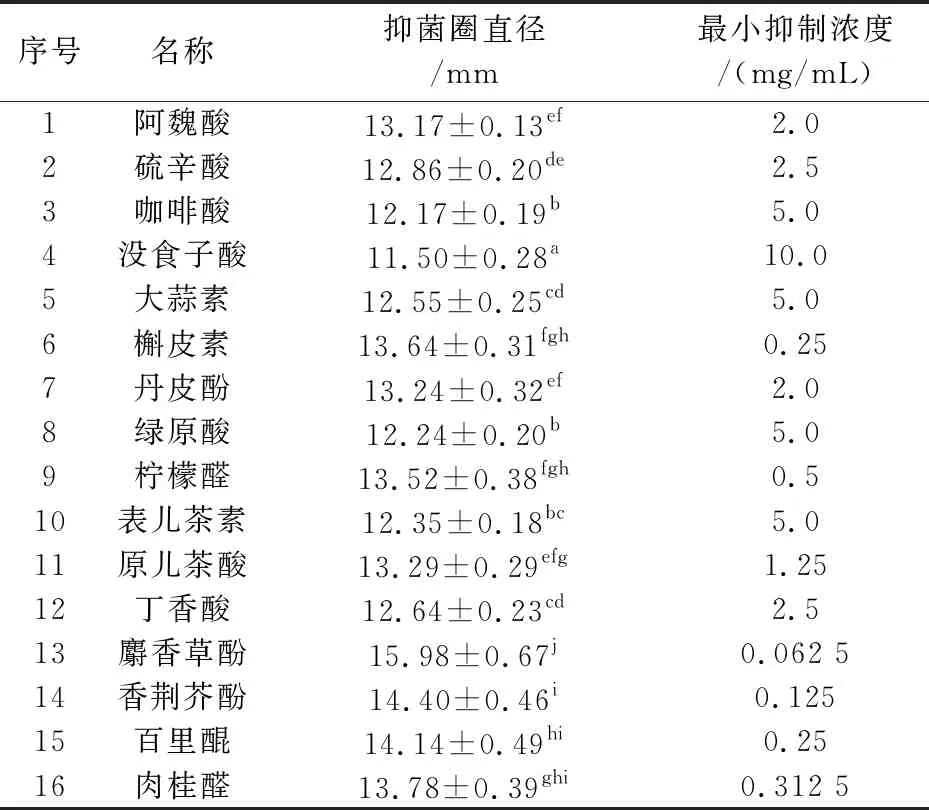
表1 16种植物源化合物对鲁氏接合酵母的抑菌圈直径和最小抑制浓度
注:不同上标字母表示差异显著(p <0.05,邓肯检验)
进一步采用双倍稀释法检测了16种植物源化合物对鲁氏接合酵母的最小抑菌浓度,如表1所示.结果表明:在所检测的16种物质中,麝香草酚和香荆芥酚对鲁氏接合酵母具有较强的抑制效果,其MICs分别为0.062 5 mg/mL和0.125 mg/mL.槲皮素、百里醌和肉桂醛对鲁氏接合酵母也有较好的抑制活性,其MICs分别为0.25 mg/mL、0.25 mg/mL和0.312 5 mg/mL.而没食子酸对鲁氏接合酵母的抑菌效果最差,MIC高达10.0 mg/mL.结合抑菌圈测定结果,可以看出麝香草酚对鲁氏接合酵母的生长抑制效果最好,而没食子酸的抑制效果最差.因此麝香草酚即为优选出来的植物源化合物进行后续研究.
本文选取了16种植物源活性物质,其中多酚类化合物有10余种(阿魏酸、绿原酸等),由实验结果可知,除没食子酸外的其他酚类物质对鲁氏接合酵母有较强的抑制活性(MICs≤5 mg/m L).多酚类化合物化学结构多样化,是生物体次级代谢产物中结构变化较多的一类化合物,其-OH与抑菌活性密切相关.此外,该类化合物也被证实可与细胞膜相互作用,破坏膜结构引起胞内物质泄露,从而起到抑菌效果[11].
在本研究中,麝香草酚、香荆芥酚、百里醌和肉桂醛对鲁氏接合酵母具有较好的抑菌效果,上述物质已经被美国药品监督管理局(FDA)批准为食品添加剂,也被欧盟委员会(EU)批准可作调料添加于食品中.前人研究也表明上述物质对一些致病菌和食品腐败菌具有较好的抑制效果[11,17].因此,上述化合物有潜力作为天然植物源防腐剂添加于食品中,或应用于食品加工、包装、储存、运输和销售过程的抑菌处理.
2.2 麝香草酚对鲁氏接合酵母菌生长的影响
麝香草酚对鲁氏接合酵母测试菌株生长影响的实验结果如图1和图2所示.由图可以看出,样品对照组(CK)在0~8 h处于迟滞期,菌体生长缓慢,其后进入对数生长期,菌体快速增殖.麝香草酚处理后,1/2MIC组生长迟滞期延长至12 h,其后进入对数生长期,这表明1/2MIC浓度的麝香草酚对鲁氏接合酵母测试菌株的生长均产生了抑制作用,将两菌株的对数生长期推迟了4 h.而MIC和2MIC处理下两株菌的生长曲线平坦,酵母菌生长基本被完全抑制,表明麝香草酚的抑菌效果与其浓度正相关,随着麝香草酚的浓度增高其对鲁氏接合酵母生长的抑制作用逐渐增强.
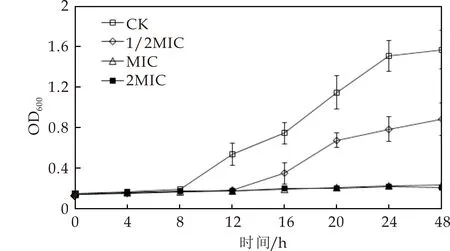
图1 麝香草酚对LB菌株生长的影响
图2 麝香草酚对1130菌株生长的影响
2.3 麝香草酚对鲁氏接合酵母细胞膜通透性的影响
微生物细胞液电导率变化是衡量微生物细胞膜通透性变化的一个重要指标[18].从图3及图4可以看出,未经麝香草酚处理的鲁氏接合酵母菌悬液(CK)的电导率呈现微小上升趋势,如LB菌液由0 h的3.08 mS/cm上升到12 h的3.15 mS/cm,1130菌液由0 h的3.17 mS/cm上升到12 h的3.32 mS/cm,这可能是由于菌体生长过程中少量活性较差的菌体细胞降解死亡引起胞内电解质外流,造成菌液电导率小幅增加.而麝香草酚处理后的鲁氏接合酵母菌液电导率上升幅度明显增大,如MIC组LB菌液电导率由0 h的3.15 mS/cm上升到12 h的3.91 mS/cm,1130菌液的电导率由0 h的3.12 mS/cm上升到12 h的3.85 mS/cm;2MIC组LB菌液的电导率进一步增加到4.24 mS/cm,1130菌液的电导率进一步增加到4.30 mS/cm.可以看出,麝香草酚对菌液电导率的影响程度依次为2MIC>MIC>CK,与麝香草酚浓度正相关.麝香草酚之所以引起菌液电导率增加,可能是由于该植物源活性成分可靶向作用于鲁氏接合酵母细胞膜,与细胞膜某些结构成分相互作用,从而影响细胞膜结构,膜渗透性增大,导致胞内电解质如K+、Ca2+、Mg2+外泄增加,从而造成菌液电导率增加[19].且随着麝香草酚浓度的提高对鲁氏接合酵母细胞膜的破坏作用也随之加强,胞内离子泄漏量逐渐增多,这与何静如等[20]研究植物源抗菌物质β-蒎烯对沙门氏菌菌悬液电导率影响结果一致.有研究表明[21],酚类物质能够与细胞膜磷脂分子相作用、抑制麦角固醇的合成来改变细胞膜的结构,增强膜通透性,但该机制是否可用于解释麝香草酚对鲁氏接合酵母的抑制作用,尚需进一步研究.
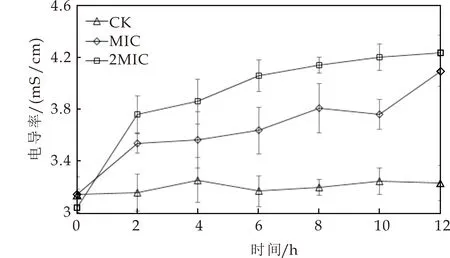
图3 麝香草酚对LB菌株细胞液电导率的影响
2.4 麝香草酚对鲁氏接合酵母细胞完整性的影响
采用激光共聚焦倒置荧光显微镜分析麝香草酚对鲁氏接合酵母细胞膜完整性的影响.本实验在绿光激发下观察PI染料发出的红色荧光,从而观察PI进入破损细胞后的状态.空白对照组在PI通道荧光显微图中没有细胞被染色,即a组(图5 中a1和a2)未出现红色荧光,而经过麝香草酚MIC浓度处理2 h后的b组(图5 中b1和b2)可以看到有明显的红色荧光.
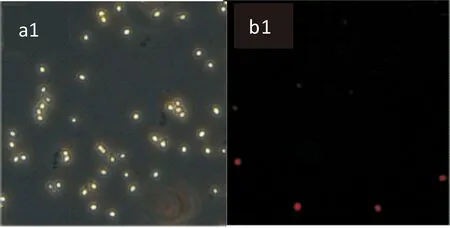
a1:LB菌株荧光显微镜白光图(×200);b1:LB菌株荧光显微镜PI通道荧光图(×200)

a2:1130菌株荧光显微镜白光图(×200);b2:1130菌株荧光显微镜PI通道荧光图(×200)图5 麝香草酚对鲁氏接合酵母细胞膜完整性的影响
荧光显微镜将紫外线作为光源,在激发波长下使被检测的物质能够产生可检测到的发射波长(即荧光).在避光条件下,对被检测物进行照射,然后在荧光显微镜下观察物体所在的位置及其形状.荧光显微镜可以观察到细胞内物质的分布、运输、吸收及定位等[22].PI能够进入死亡细胞并结合核酸发出红色荧光,却不能通过活细胞的细胞膜,因此PI染色程度可以反映细胞膜的破损程度和细胞死亡程度[23,24].结果表明麝香草酚MIC处理对鲁氏接合酵母菌细胞膜产生了破坏作用,并最终导致菌体细胞死亡.有研究显示[21]细胞膜是大多数外源抗菌物质的作用位点,通过改变细胞膜结构或破坏细胞膜结构导致细胞正常生长受到抑制,甚至死亡,从而达到抑菌或杀菌的目的.
基于此,结合本文2.3中实验结果,可初步推测麝香草酚对鲁氏接合酵母的作用位点也可能在细胞膜上,当麝香草酚在鲁氏接合酵母细胞膜表面聚集到一定程度时,会改变细胞形态,破坏细胞膜完整性,膜上出现破裂或孔洞,细胞膜通透性增加,胞外PI染料可以进入胞内与核酸作用发出红色荧光,胞内小分子物质则大量外流导致菌液电导率增加,同时这些胞内小分子物质的流失直接影响细胞内环境稳态,继而干扰正常新陈代谢,最终造成细胞生长抑制或死亡.
2.5 麝香草酚对鲁氏接合酵母细胞形态的影响
采用场发射扫描电镜观察麝香草酚处理后鲁氏接合酵母1130细胞形态的变化.结果如图6所示,空白对照组鲁氏接合酵母细胞呈现正常的椭圆形(图6(a)),菌体形状饱满,表面光滑无裂纹,细胞之间的界限清晰明了;而经麝香草酚处理后的鲁氏接合酵母细胞形态发生明显变化(图6(b)和6(c)),酵母细胞出现不同程度的破裂、黏结现象,细胞表面出现凹陷,细胞膜壁出现不同程度穿孔性损伤,细胞形态受到严重破坏,且破坏程度与麝香草酚处理浓度呈正相关.基于前文电导率测定及PI染色结果,可初步认为麝香草酚通过破坏鲁氏结合酵母细胞膜结构抑制其生长.以场发射扫描电镜观察经麝香草酚处理后的鲁氏接合酵母细胞形态,可以进一步验证麝香草酚处理后鲁氏接合酵母细胞膜出现通透孔道、内容物外泄,从而导致细胞生长抑制甚至死亡这一推断,符合一些研究外源抑菌物质抑菌机理的学者提出的“孔道形成理论”[25].
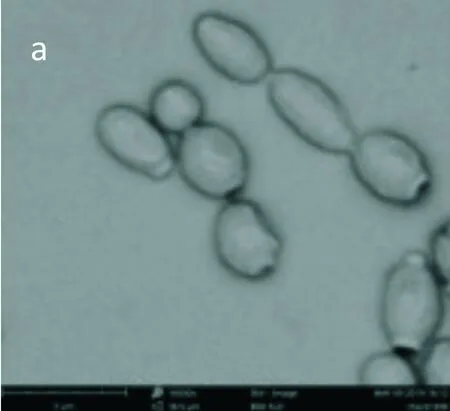
(a)未处理1130菌株(×13 000)
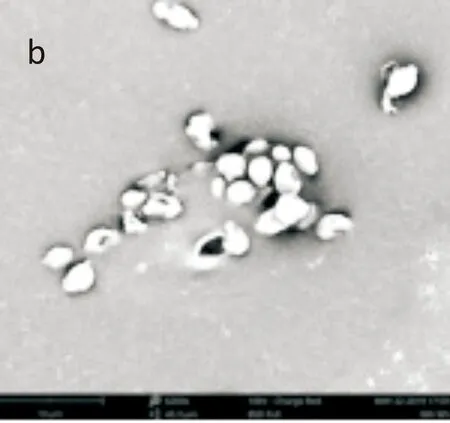
(b)MIC处理1130菌株(×8 000)
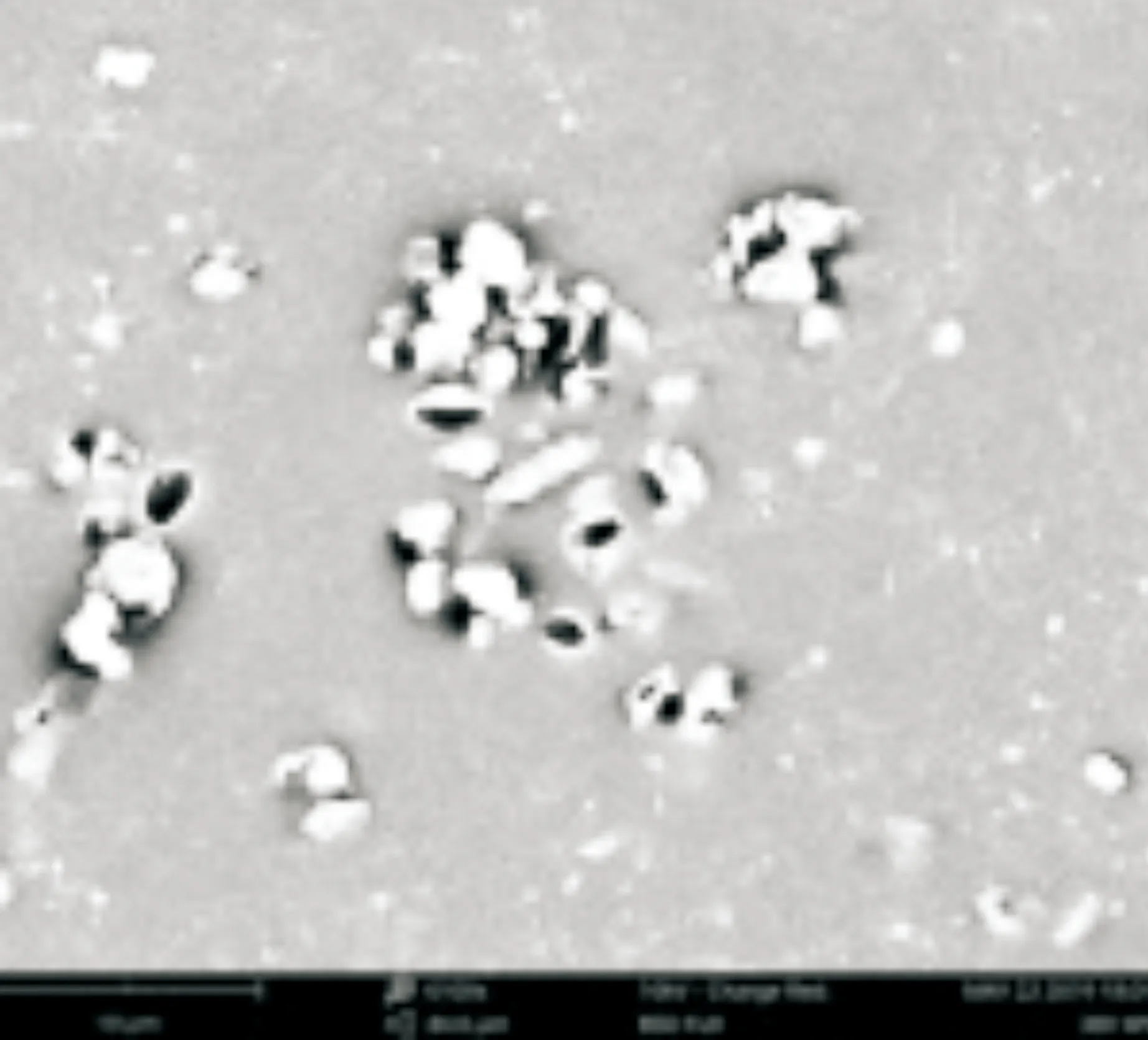
(c)2MIC处理1130菌株(×8 000)图6 麝香草酚处理后鲁氏接合酵母菌的细胞形态
3 结论
本研究对16种植物源化合物抑制鲁氏接合酵母活性进行了评价,筛选出对鲁氏接合酵母抑制活性最强的麝香草酚,其抑菌圈直径和最小抑菌浓度分别为15.98±0.67 mm和0.062 5 mg/mL;进一步研究表明麝香草酚可引起菌液电导率增加并破坏酵母细胞膜完整性,导致细胞膜通透性增大,胞内生物活性物质大量泄露,胞内环境紊乱,导致菌体生长抑制;最后通过扫描电镜观察到麝香草酚处理后鲁氏接合酵母细胞出现黏结、破裂甚至完全破碎,验证了细胞膜通透性和完整性研究结果.研究结果为后期天然、高效食品防腐剂开发并有效防控食品中鲁氏接合酵母的污染奠定了理论基础.本文仅从细胞形态和细胞膜结构方面对麝香草酚抑制鲁氏接合酵母生长的机制进行了初步解析,后续还应从不同角度(基因表达、代谢调控、细胞凋亡等)深入探究其抑菌机制.

