南、北五味子“辨色论质”机制及其定性识别模型研究
焦美钰 佟月 吴浩善 康廷国 张慧
摘 要 目的:探讨南、北五味子药材颜色判断质量(“辨色论质”)的内在机制,构建基于颜色量化值的定性识别模型。方法:采用高效液相色譜法测定39批药材样品中6种有效成分的含量,采用色差仪测定其三色空间值[明暗程度值(ΔL*)、红绿色色调值(Δa*)、黄蓝色色调值(Δb*)],采用SPSS 24.0软件对6种有效成分含量与三色空间值的相关性进行Pearson分析,采用SIMCA-P14.1软件进行主成分分析。结果:五味子醇甲、五味子醇乙、五味子甲素、五味子乙素、五味子丙素、五味子酯甲检测进样量的线性范围分别为0.204 8~2.560 0、0.049 3~0.616 3、0.098 4~1.230 0、0.046 3~0.578 8、0.010 6~0.132 0、0.100 0~1.500 0 μg(r均大于0.999 0);精密度、稳定性(12 h)、重复性试验的RSD均小于3%,加样回收率分别为98.14%~101.53%(RSD=1.08%,n=6)、97.16%~101.05%(RSD=1.54%,n=6)、98.29%~101.41%(RSD=1.29%,n=6)、97.17%~100.36%(RSD=1.20%,n=6)、97.32%~102.43%(RSD=1.77%,n=6)、98.02%~100.40%(RSD=0.84%,n=6)。39批南、北五味子中上述6种成分的平均含量分别为3.25~7.39、0.96~1.98、0.46~4.74、1.62~2.60、0.06~0.58、0.48~6.11 mg/g。北五味子的平均ΔL*为-80.79~-70.54,平均Δa*为2.54~5.34,平均Δb*为5.20~12.83,平均ΔE*为71.13~81.23;南五味子的平均ΔL*为-75.90~-69.16,平均Δa*为3.77~7.82,平均Δb*为8.59~17.23,平均ΔE*为69.99~77.92。相关性分析结果显示,五味子醇甲、五味子醇乙、五味子甲素、五味子乙素、五味子酯甲的含量与ΔL*、Δa*、ΔE*均呈显著相关性(P<0.01),与Δb*均不相关(P>0.05);五味子丙素的含量与ΔL*、Δa*呈显著负相关性(P<0.05),与Δb*、ΔE*不相关(P>0.05)。主成分分析结果显示,前2个主成分的累积方差贡献率为89.8%,且南、北五味子可明显区分。结论:北五味子中五味子醇甲含量较高,南五味子中五味子酯甲含量较高,且南五味子中未检出五味子醇甲、五味子醇乙和五味子乙素。南、北五味子的三色空间值存在差异,即北五味子亮度小,颜色偏黑,南五味子颜色偏红、偏黄。南、北五味子有效成分含量与三色空间值具有相关性,即药材颜色越暗、红色程度越弱,五味子醇甲、五味子醇乙、五味子乙素、五味子丙素的含量越高;药材表面颜色越亮、红色程度越高,五味子甲素、五味子酯甲的含量越高;所建含量测定方法精密度高、稳定性好,可用于测定南、北五味子的含量;所建颜色定性识别模型可用于南、北五味子的鉴别。
关键词 南五味子;北五味子;高效液相色谱法;含量测定;三色空间值;相关性分析;辨色论质;定性识别模型
ABSTRACT OBJECTIVE: To investigate the internal mechanism of Schisandra sphenanthera and Schisandra chinensis in determining quality by color (“color discrimination grading”) of medicinal materials, and to construct a qualitative identification model based on color quantization value. METHODS: HPLC method was used to determine the contents of 6 active components from 39 batches of samples. The colorimeter was used to determine 3-color spatial value [lightness value (ΔL*), red-green value (Δa*), yellow-blue value (Δb*)]. SPSS 24.0 statistical software was used to analyze the correlation between the contents of 6 active components and 3-color spatial values. Principal component analysis (PCA) was performed by using SIMCA-P14.1 software. RESULTS: The linear range of schizandrol A, schizandrol B, schisandrin A, schisandrin B, schisandrin C, schisantherin A were 0.204 8-2.560 0, 0.049 3-0.616 3, 0.098 4- 1.230 0, 0.046 3-0.578 8, 0.010 6-0.132 0, 0.100 0-1.500 0 μg (r>0.999 0); RSDs of precision, stability (12 h) and repeatability tests were all less than 3%. The recoveries were 98.14%-101.53%(RSD=1.08%,n=6), 97.16%-101.05%(RSD=1.54%,n=6), 98.29%-101.41%(RSD=1.29%,n=6), 97.17%-100.36%(RSD=1.20%,n=6), 97.32%-102.43%(RSD=1.77%,n=6)and 98.02%-100.40%(RSD=0.84%,n=6), respectively. Among 39 batches of S. sphenanthera and S. chinensis, average contents of above 6 components were 3.25-7.39, 0.96-1.98, 0.46-4.74, 1.62-2.60, 0.06-0.58, 0.48-6.11 mg/g, respectively. Average ΔL* of S. chinensis was -80.79--70.54, average Δa* was 2.54-5.34, average Δb* was 5.20-12.83, average ΔE* was 71.13-81.23; average ΔL* of S. sphenanthera was -75.90- -69.16, average Δa* was 3.77-7.82, average Δb* was 8.59-17.23, average ΔE* was 69.99-77.92. The results of relationship analysis showed that the contents of schizandrol A, schizandrol B, schisandrin A, schisandrin B and schisantherin A were significantly correlated with ΔL*, Δa*, ΔE* (P<0.01), with no significant correlation with Δb*(P>0.05). There was a negative correlation of the content of schisandrin C with ΔL* and Δa* (P<0.05), and there was no significant correlation with Δb* and ΔE* (P>0.05). Results of PCA showed that accumulative variance contribution rate of primary 2 main components was 89.8%, and S. sphenanthera and S. chinensis could be identified significantly. CONCLUSIONS: The content of schizandrol A in S. chinensis is high relatively, and content of schisantherin A in S. sphenanthera is high relatively. Schizandrol A, schizandrol B and schisandrin B were not detected in S. sphenanthera. The 3-color spatial value of S. sphenanthera and S. chinensis are different, that is, the brightness of S. chinensis is small and the color is slant black, while the color of S. sphenanthera is slant red and yellow. The contents of active components of S. sphenanthera and S. chinensis is related to the surface 3-color spatial values, that is, the darker the color is, the weaker the red degree is, and the higher the contents of schizandrol A, schizandrol B, schisandrin B and schisandrin C are; the brighter the surface color is, the stronger the red degree is, and the higher the contents of schisandrin A and schisantherin A are. The established content determination method is precise and stable, and can be used for the content determination of S. sphenanthera and S. chinensis. The color qualitative identification model can be used for the identification of S. sphenanthera and S. chinensis.
KEYWORDS Schisandra sphenanthera; Schisandra chinensis; HPLC; Content determination; 3-color spatial value; Correlation analysis; Color discrimination grading; Qualitative identification model
五味子為木兰科植物五味子Schisandra chinensis(Turcz.)Baill.的干燥成熟果实,习称“北五味子”,主要分布于我国吉林、辽宁、黑龙江等省;南五味子为木兰科植物华中五味子Schisandra sphenanthera Rehd. et Wils的干燥成熟果实,主要分布于我国陕西、山西、河南等省[1-2]。两药均有收敛固涩、益气生津、补肾宁心之功效[1],具有保肝、镇静催眠、调节心血管系统等作用[3-5],且二者化学成分相似,均含有木脂素类、挥发油、多糖等成分[3]。其中,五味子甲素、五味子乙素、五味子醇甲、五味子醇乙、五味子酯甲具有调节中枢神经系统的作用[6-7],五味子醇乙、五味子乙素、五味子丙素和五味子酯甲具有保护肝细胞作用[8]。但历代医家认为,北五味子为正品,功效偏于补益心肾,而南五味子则偏于敛肺止咳,滋阴药当入北五味子为宜,可见南、北五味子在传统用药上存在差异[3]。虽然二者植物来源不同,但为同科属植物,其性状、显微特征和化学成分也相似[9],因此通过常规的鉴别方法难以区分,导致南、北五味子药材市场混乱现象严重,故亟需建立一种快速的鉴别方法。
中药“辨状论质”理论是指根据药材的外在性状评价其质量的真伪、优劣,颜色是药材外在性状鉴别的关键要素之一[10]。据《本草纲目》记载,“五味今有南北之分,南产者色红,北产者色黑,入滋补药必用北产者良”[11],且行业内评价五味子的“辨状论质”标准为“以粒大、果皮紫红、肉厚、柔润者为佳”[12],该标准是目前药材市场流通领域鉴别药材质量的共识方法,可见颜色是判定五味子质量的一个重要因素,应用历史悠久,且已被证实具有科学性[13]。但中药“辨色论质”的内在机制,即通过颜色判断五味子质量的科学内涵是什么,目前尚未有合理诠释。
色度学是研究颜色视觉规律、颜色测量理论和技术的科学,现代色度学的基础是国际照明委员会(CIE)标准色度系统,是基于每种颜色都能用3个选定的原色按适当比例混合而成的基本事实建立起来的[14]。分光测色仪(即色差仪)可通过探测样品的光谱成分确定其颜色参数,精度高、稳定性好,可反映波长反射率光谱曲线图的变化[15]。基于此,本研究在以高效液相色谱法(HPLC)测定两药中活性成分(五味子醇甲、五味子醇乙、五味子甲素、五味子乙素、五味子丙素、五味子酯甲)含量的基础上,采用色差仪测定了南、北五味子药材的三色空间值[明暗程度值(ΔL*)、红绿色色调值(Δa*)、黄蓝色色调值(Δb*)],并通过分析含量与颜色的相关性来揭示南、北五味子“辨色论质”的内在机制,同时构建南、北五味子的定性识别模型,旨在为其质量控制提供参考。
1 材料
1.1 仪器
1260型HPLC仪,包括G1312C型二元泵、G1316A型柱温箱、G1314F-VWD型紫外检测器、ChemStation C.O 1.03工作站(美国Agilent公司);NR-10QC型色差仪(深圳三恩时科技有限公司);AR2140型万分之一电子分析天平[奥豪斯仪器(上海)有限公司];AB135-S型十万分之一电子天平(瑞士Mettler Toledo公司);KQ-250D型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 药品与试剂
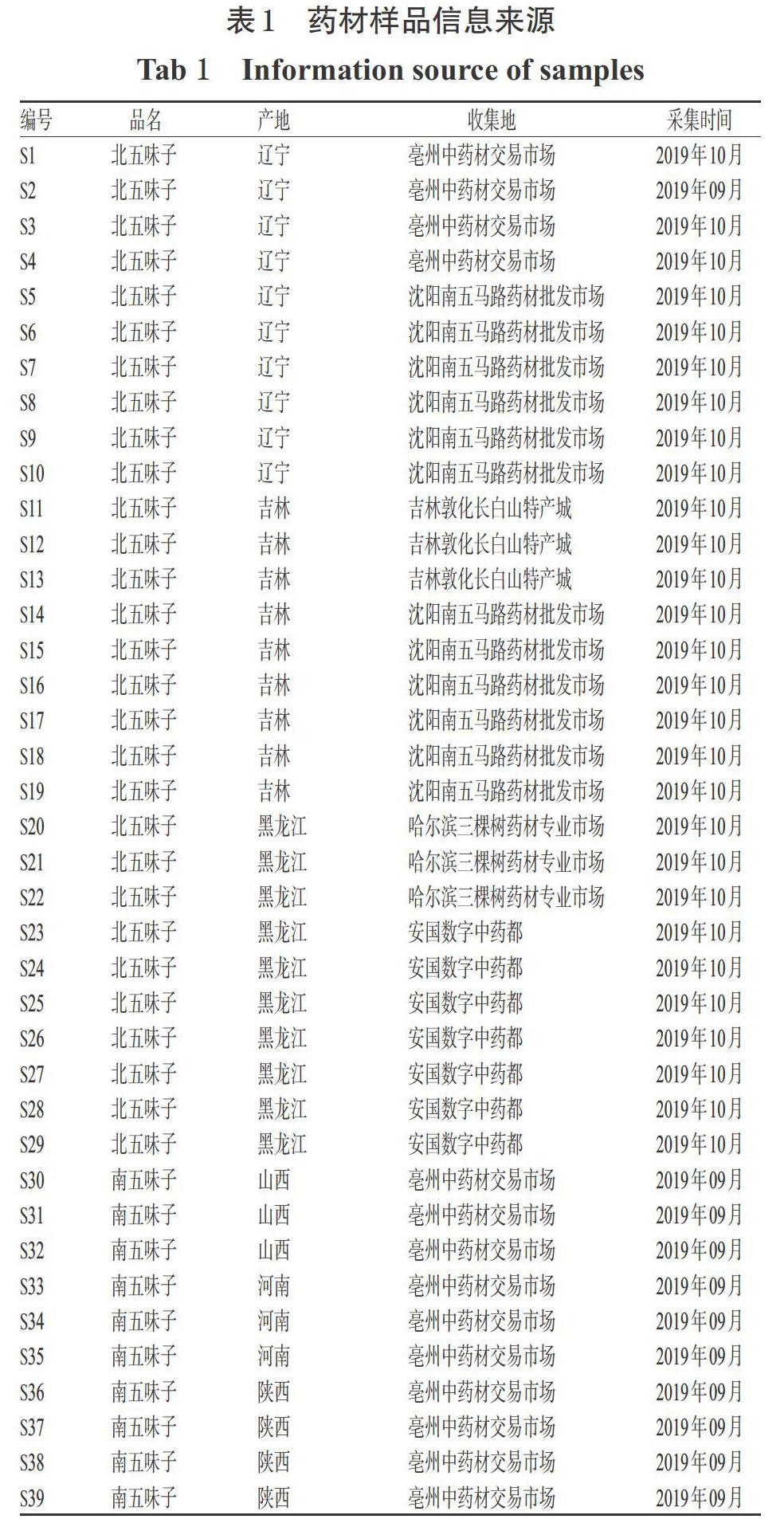
南、北五味子药材共39批[编号:S1~S29(北五味子),S30~S39(南五味子)],经辽宁中医药大学药学院张慧教授鉴定分别为木兰科植物五味子S. chinensis(Turcz.)Baill的干燥成熟果实和木兰科植物华中五味子S. sphenanthera Rehd. et Wils的干燥成熟果实,其样品信息来源见表1。五味子醇甲对照品(批号:110857- 201815,纯度:99.7%)、五味子甲素对照品(批号:110764-201714,纯度:99.3%)、五味子乙素对照品(批号:110765-201813,纯度:99.1%)、五味子酯甲对照品(批号:111529-201706,纯度:95.2%)均购自中国食品药品检定研究院;五味子醇乙对照品(批号:P28S6F3984,纯度:≥98%)、五味子丙素对照品(批号:P28J8F3696,纯度:≥98%)均购自上海源叶生物科技有限公司;乙腈为色谱纯,其余试剂均为分析纯,水为纯净水。
2 方法与结果
2.1 南、北五味子中活性成分的含量测定
2.1.1 色谱条件 色谱柱:菲罗门XB-C18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-水(B),梯度洗脱[洗脱条件1(五味子醇甲、五味子醇乙、五味子甲素、五味子乙素、五味子丙素):0~10 min,50%A;10~15 min,50%A→75%A;15~25 min,75%A;25~30 min,75%A→50%A;洗脱条件2(五味子酯甲):0~40 min,59%A;40~45 min,59%A→95%A;45~55 min,95%A;55~60 min,95%A→59%A];检测波长:217 nm;柱温:30 ℃;流速:1.0 mL/min;进样量:10 μL。
2.1.2 对照品溶液的制备 精密称取五味子醇甲、五味子醇乙、五味子甲素、五味子乙素、五味子丙素对照品适量,加甲醇溶解制得上述成分质量浓度分别为2.048 0、0.493 0、0.984 0、0.463 0、0.106 0 mg/mL的混合对照品贮备液;精密量取该贮备液1 mL,置于10 mL量瓶中,加甲醇稀释至刻度,混匀,即得质量浓度分别为0.204 8、0.049 3、0.098 4、0.046 3、0.010 6 mg/mL的混合对照品溶液,于2~4 ℃冷藏,备用。另取五味子酯甲对照品适量,精密称定,加甲醇溶解并定容至10 mL量瓶中,混匀,制得质量浓度为1.0 mg/mL的单一对照品溶液,于2~4 ℃冷藏,备用。
2.1.3 供试品溶液的制备 分别取南、北五味子药材,粉碎,过50目筛,取粉末约0.5 g,精密称定,置于具塞锥形瓶中,加入甲醇25 mL溶解,称定质量,超声(功率:250 W,频率:20 kHz)处理30 min,放至室温,再次称定质量,用甲醇补足减失的质量,静置,经0.45 μm微孔滤膜滤过,取续滤液,即得。
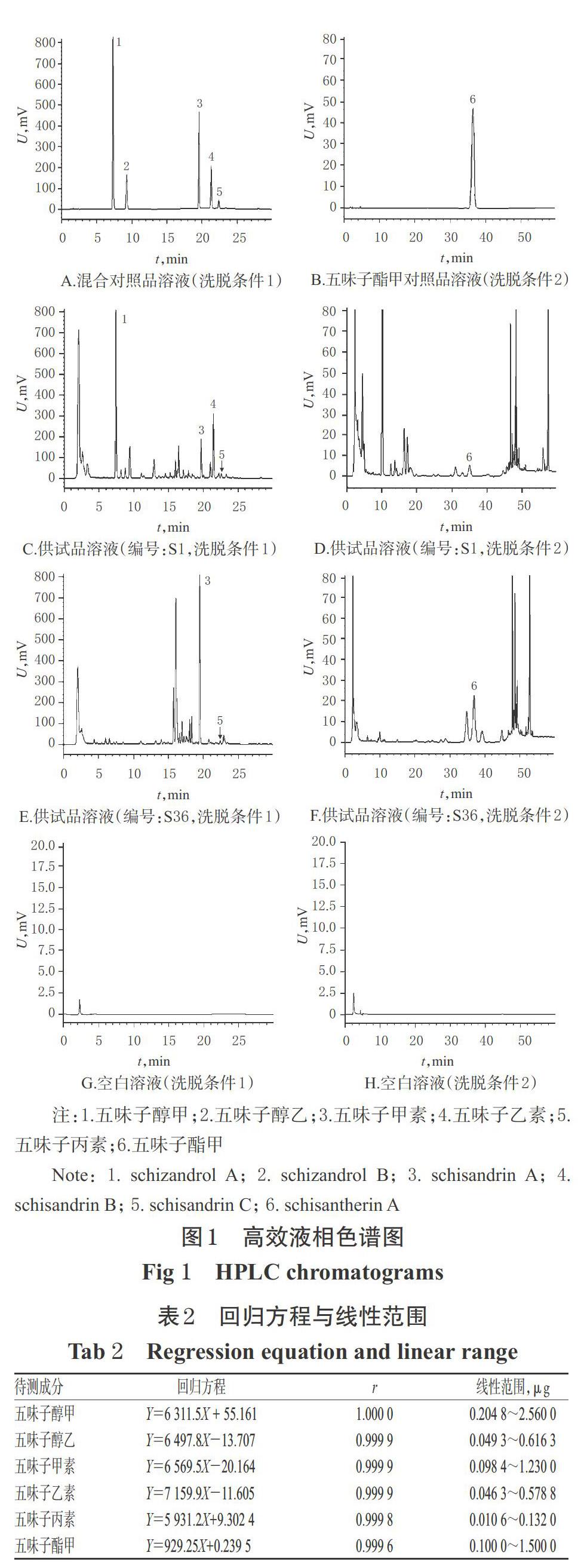
2.1.4 系统适用性试验 分别吸取上述两种对照品溶液、供试品溶液和空白溶液(甲醇),按“2.1.1”项下色谱条件进样测定,记录色谱图。结果,各成分均基线分离,其分离度均大于1.5,理论板数以五味子醇甲计均大于3 000;空白溶液对测定无干扰,详见图1。
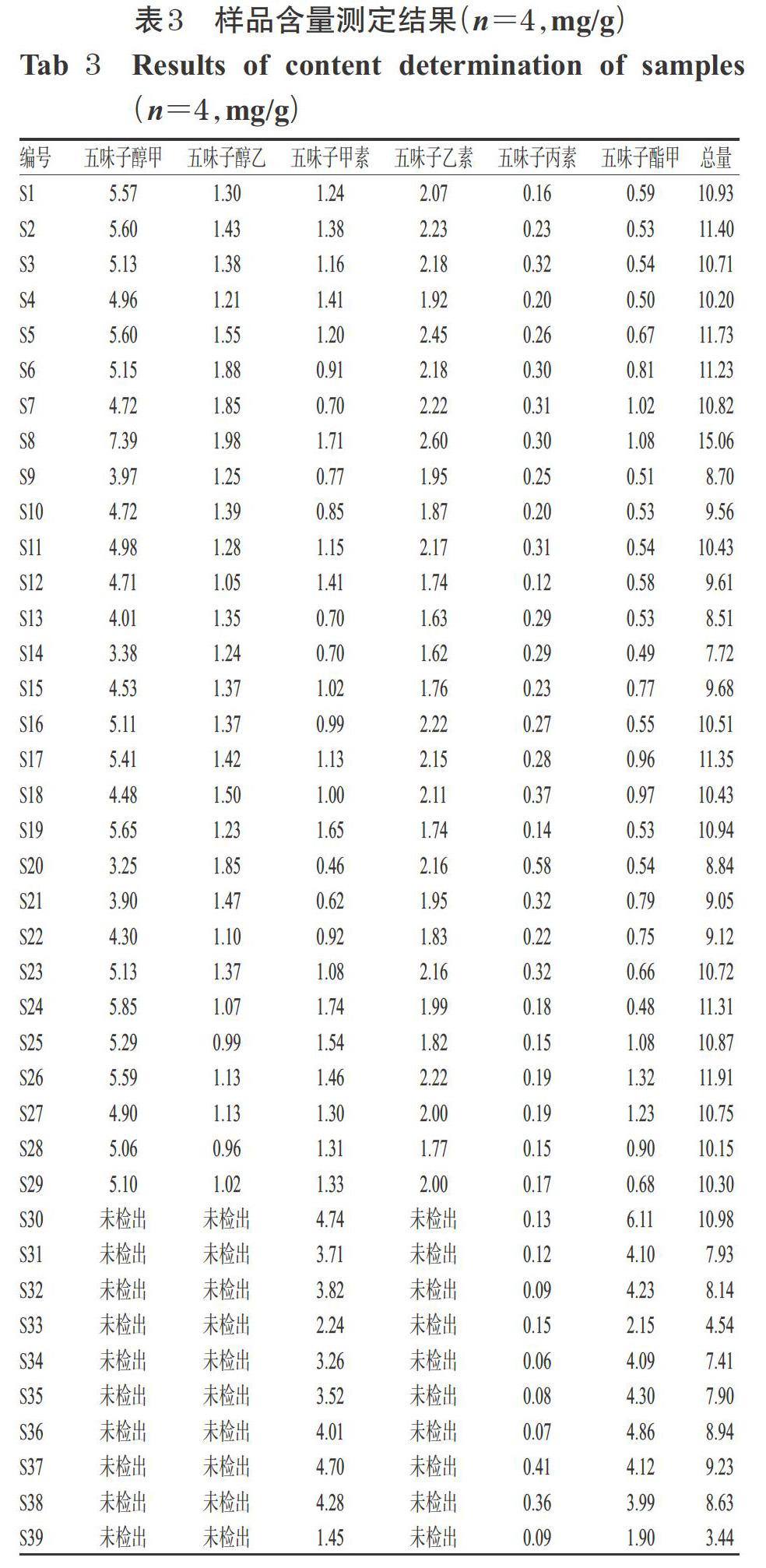
2.1.5 线性关系考察 取“2.1.2”项下混合对照品贮备液0.10、0.25、0.50、0.75、1.00、1.25 mL,分别置于10 mL量瓶中,加甲醇稀释至刻度,混匀;另取五味子酯甲单一对照品溶液0.10、0.25、0.50、1.00、1.25、1.50 mL,分别置于10 mL量瓶中,加甲醇稀释至刻度,混匀。分别精密吸取上述溶液各10 μL,按“2.1.1”项下色谱条件进样测定,记录色谱图。以各待测成分进样量(X,μg)为横坐标、峰面积(Y)为纵坐标进行线性回归,结果见表2。
2.1.6 精密度试验 取“2.1.3”项下供试品溶液(编号:S1)适量,按“2.1.1”项下色谱条件连续进样测定6次,记录峰面积。结果,五味子醇甲、五味子醇乙、五味子甲素、五味子乙素、五味子丙素、五味子酯甲峰面积的RSD均小于3%(n=6),表明方法精密度良好。
2.1.7 重复性试验 取样品粉末(编号:S1)约0.5 g,共6份,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定,记录峰面积并按外标一点法计算样品含量。结果,五味子醇甲、五味子醇乙、五味子甲素、五味子乙素、五味子丙素、五味子酯甲含量的RSD均小于3%(n=6),表明方法重复性良好。
2.1.8 稳定性试验 取“2.1.3”项下供试品溶液(编号:S1)适量,分别于室温下放置0、2、4、6、8、12 h时按“2.1.1”项下色谱条件进样测定,记录峰面积。结果,五味子醇甲、五味子醇乙、五味子甲素、五味子乙素、五味子丙素、五味子酯甲峰面积的RSD均小于3%(n=6),表明供试品溶液于室温下放置12 h内稳定性良好。
2.1.9 加样回收率试验 取已知含量的样品粉末(编号:S1),约0.25 g,共6份,分别加入“2.1.2”项下两种对照品溶液适量,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定,记录峰面积并计算加样回收率。结果,五味子醇甲、五味子醇乙、五味子甲素、五味子乙素、五味子丙素、五味子酯甲的加样回收率分别为98.14%~101.53%(RSD=1.08%,n=6)、97.16%~ 101.05%(RSD=1.54%,n=6)、98.29%~101.41%(RSD=1.29%,n=6)、97.17%~100.36%(RSD=1.20%,n=6)、97.32%~102.43%(RSD=1.77%,n=6)、98.02%~ 100.40%(RSD=0.84%,n=6)。
2.1.10 样品含量测定 取39批南、北五味子样品粉末适量,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定,每样品平行测定4次,记录峰面积并按外标一点法计算样品含量,结果见表3(表中,均以检测结果的平均值表示,下同)。由表3可知,北五味子中五味子醇甲含量较高,南五味子中五味子酯甲含量较高,且南五味子中未检出五味子醇甲、五味子醇乙和五味子乙素。
2.2 颜色测定
2.2.1 三色空间值的测定方法 每批药材样品随机选取一定量,平铺满整个测试器皿。每份样品随机选10处,平行3份,采用色差仪测定ΔL*、Δa*、Δb*,取平均值,以白纸为标准样品。其中,ΔL*与亮度呈正相关,ΔL*越大,样品颜色越明亮;Δa*为红-绿色轴,Δa*越大表示样品越红,越小表示样品越绿;Δb*为黄-蓝色轴,Δb*越大表示样品越黄,越小表示样品越蓝;ΔE*表示待测样品颜色的总色差,ΔE*=(ΔL*2+Δa*2+Δb*2)1/2[16] 。
2.2.2 精密度试验 取样品(编号:S1)适量,置于测试器皿中,按“2.2.1”项下方法于同一时间连续测定三色空间值6次。结果,ΔL*、Δa*、Δb*的RSD分别为1.84%、2.44%、2.25%(n=6),表明方法精密度良好。
2.2.3 不同光照强度下的稳定性试验 取样品(编号:S1)适量,置于测试器皿中,按“2.2.1”项下方法分别于同日内8:00、10:00、12:00、13:00、15:00、17:00时测定三色空间值,每个时间点平行测定3次,取平均值。结果,ΔL*、Δa*、Δb*的RSD分别为1.63%、2.92%、2.46%(n=6),表明不同光照强度对试验结果的稳定性影响较小。
2.2.4 样品稳定性试验 取样品(编号:S1)适量,置于测试器皿中,按“2.2.1”项下方法于室温下连续5天在同一時间点测定三色空间值。结果,ΔL*、Δa*、Δb*的RSD分别为1.85%、2.65%、2.82%(n=5),表明样品稳定性良好,在短期内表面颜色无明显变化。
2.2.5 重复性试验 取样品(编号:S1)适量,共6份,置于测试器皿中,按“2.2.1”项下测定方法在同一时间测定三色空间值。结果,ΔL*、Δa*、Δb*的RSD分别为1.81%、2.81%、2.95%(n=6),表明样品颜色重复性较好。
2.2.6 样品三色空间值的测定 取39批南、北五味子药材样品适量,置于测试器皿中,按“2.2.1”项下方法测定三色空间值,每样品平行测定3次,结果见表4。由表4可知,南、北五味子的三色空间值存在一定差异,其中北五味子的ΔL*整体偏小,亮度小,即颜色偏黑;南五味子的Δa*、Δb*整体均大于北五味子,即南五味子相对于北五味子颜色偏红、偏黄。
2.3 相关性分析
采用SPSS 24.0软件对39批南、北五味子的ΔL*、Δa*、Δb*、ΔE*与6种木脂素类成分含量的相关性进行Pearson分析。以相关系数(r)>0.5且双尾检验概率(显著性)<0.05或0.01为显著正相关,以r<-0.5且双尾检验概率(显著性)<0.05或0.01则为显著负相关[16],结果见表5。由表5可知,五味子醇甲、五味子醇乙、五味子乙素的含量与ΔL*、Δa*均呈显著负相关性(P<0.01),与ΔE*呈显著正相关性(P<0.01),与Δb*不相关(P>0.05);五味子甲素、五味子酯甲的含量与ΔL*、Δa*呈显著正相关性(P<0.01),与ΔE*呈显著负相关性(P<0.01),与Δb*不相关(P>0.05);五味子丙素的含量与ΔL*、Δa*呈负相关性(P<0.05),与Δb*、ΔE*不显著(P>0.05)。
2.4 南、北五味子化学识别模型构建分析
以37批样品的ΔL*、Δa*、Δb*为指标,采用SIMCA-P14.1软件进行主成分分析(因S2为陈五味子可导致颜色改变,S39含量与颜色普遍低于正常水平,故剔除这2批样品数据),得到前2个主成分的方差贡献率分别为56.5%、33.3%,累积方差贡献率为89.8%(>50%),提示前2个主成分可以反映药材样品的整体信息。根据主成分分析结果,构建主成分分析得分图,结果见图2。由图2可知,南、北五味子分布在模型的两个区域,南五味子位于得分图的右侧,北五味子位于得分图的左侧,能够实现有效区分。
3 讨论
本课题组在试验前期通过对甲醇-水、乙腈-水、甲醇-乙腈-水等不同流动相进行考察,最终确定了分离度好、基线平稳的乙腈-水(梯度洗脱)为流动相。含量测定结果显示,北五味子中五味子醇甲含量较高,南五味子中五味子酯甲含量较高,且南五味子中未检出五味子醇甲、五味子醇乙和五味子乙素。随后,本研究基于色差原理测定了39批南、北五味子药材的三色空间值。结果显示,南、北五味子的三色空间值存在一定差异,其中北五味子的ΔL*整体偏小,亮度小,即颜色偏黑,南五味子的Δa*、Δb*整体均大于北五味子,即南五味子相对于北五味子颜色偏红、偏黄。这提示通过颜色可以区分南、北五味子,测定结果符合《本草纲目》记载的“五味今有南北之分,南产者色红,北产者色黑”的论述[11] 。
相关性分析结果显示,南、北五味子的三色空间值与6种成分均具有相关性,即药材颜色越暗、红色程度越弱、总色差值越大,则五味子醇甲、五味子醇乙、五味子乙素、五味子丙素的含量越高;药材表面颜色越亮、红色程度越强、总色差值越小,则五味子甲素、五味子酯甲的含量越高。主成分分析结果显示,本研究所构建的主成分分析模型可用于鉴别南、北五味子。
综上所述,所建含量测定方法精密度高、稳定性好,可用于测定南、北五味子的含量,所建颜色判别模型可用于南、北五味子的鉴别。本研究初步探讨了中药“辨色论质”的内在机制,构建了鉴别模型,通过颜色指标的测定,同时结合化学计量学分析方法,实现了中药材鉴别的数据化、客观化,有效提高了鉴别的稳定性和准确性,有利于中药材的快速准确鉴别,为建立更加准确、可靠的中药品质评价体系提供了新的思路和方法。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:66-67、244.
[ 2 ] 王佳豪.五味子药材的质量标志物:Q-Marker研究[D].沈阳:辽宁中医药大学,2019.
[ 3 ] 刘宇灵,付赛,樊丽姣,等.南北五味子化学成分、药理作用等方面差异的研究进展[J].中国实验方剂学杂志,2017,23(12):228-234.
[ 4 ] 罗运凤,高洁,柴艺汇,等.五味子药理作用及临床应用研究进展[J].贵阳中医学院学报,2019,41(5):93-96.
[ 5 ] ZHU PL,LI JK,FU XQ,et al. Schisandra fruits for the management of drug-induced liver injury in China:a review[J]. Phytomedicine,2019. DOI:10.1016/j.phymed. 2018.11.020.
[ 6 ] 刘杰,徐剑,郭江涛.五味子活性成分及药理作用研究进展[J].中国实验方剂学杂志,2019,25(11):206-215.
[ 7 ] 姚辛敏,王琪,周妍妍,等.五味子醇甲对中枢神经系统药理作用的实验研究进展[J].中医药学报,2018,46(1):125-127.
[ 8 ] 任海风,王世华.五味子药理作用研究进展[J].中国医院用药评价与分析,2018,18(8):1151-1152.
[ 9 ] 李伟,刘亚丽,宋永贵,等. UPLC-Q-TOF-MSE结合OPLS-DA模式快速鉴定南、北五味子化学成分与识别差异标志物[J].中草药,2015,46(15):2212-2218.
[10] 刘天睿,金艳,孟虎彪,等.论中药“辨状论质”之辨色泽与品质评价的生物学内涵研究[J].中国中药杂志,2020,45(19):4545-4554.
[11] 李时珍.本草纲目[M].王辉,主编.西安:陕西旅游出版社,2002:64.
[12] 康廷國.中药鉴定学[M].北京:中国中医药出版社,2016:277-278.
[13] 汤国华,何铸.五味子的本草考证[J].中药材,1989,12(4):47.
[14] 徐曼菲,吴志生,刘晓娜,等.从辨色论质谈中药质量评价方法[J].中国中药杂志,2016,41(2):177-181.
[15] 殷放宙,吴晓燕,毛春芹,等.光谱颜色科学研究进展及其在中药领域中应用前景分析[J].光谱学与光谱分析,2013,33(9):2315-2320.
[16] 何婉婉,张建逵,李云静,等.北豆根药材粉末色泽与有效成分的相关性[J].中国实验方剂学杂志,2017,23(5):57-62.
(收稿日期:2020-08-09 修回日期:2020-11-04)
(编辑:陈 宏)

