碳量子点-金纳米复合材料修饰电极测定亚硝酸盐
卜晓阳,郑 修,李 丽
化学与化工研究
碳量子点-金纳米复合材料修饰电极测定亚硝酸盐
卜晓阳1,郑 修1,李 丽2
(1. 皖南医学院 药学院,安徽 芜湖 241002;2. 安徽师范大学 化学与材料科学学院,安徽 芜湖 241003)
采用水热法制得碳量子点作为还原剂还原氯金酸,得到碳量子点-金纳米复合材料。用滴涂的方法将此材料修饰在玻碳电极表面,构建了电化学生物传感器,用循环伏安法、交流阻抗法以及计时电流法考察了该电极的电化学行为。结果表明,此传感器对亚硝酸盐具有良好的电催化活性,不受其他电活性物质的干扰。最佳条件下,NaNO2浓度为0.5 μM-1 000 μM范围内,响应电流与NaNO2浓度呈良好线性关系:Δp(μA)=-0.445 2 + 0.091(μmol·L-1),相关系数=0.999 3,检测限为0.08 μmol·L-1(S/N=3)。
碳点;金纳米材料;电化学传感器;亚硝酸盐
目前,亚硝酸盐的检测方法主要有分光光度法[1-5]、化学发光法[6,7]以及高效液相色谱分析法[8]等。近年来,电化学分析法由于其操作简单、灵敏度高,成本低等特点,而被广泛地应用于亚硝酸盐的检测[9-11]。
金纳米材料由于其高导电性、高稳定性和良好的电化学活性,常作为制备优良传感器的首选材料。另一方面,碳量子点作为一种直径小于10 nm的新型“零维”碳纳米材料颗粒,具有大量2杂化轨道的共轭体系,可加速电子迁移,并同时兼具电子供体和电子受体的功能[12]。
本文采用一步水热法制备碳量子点(CDs,简称碳点),利用CDs的还原性直接还原氯金酸,制备碳点-金纳米复合材料(Au-CDs)。通过滴涂将此复合材料修饰到玻碳电极上,得到Au-CDs/ GCE电极,并将该电极用于亚硝酸盐的检测。
1 实验部分
1.1 仪器与试剂
CHI660B电化学工作站(上海辰华仪器有限公司)、三电极系统(以Ag/AgCl电极为参比电极,Pt丝电极为对电极,裸玻碳电极或修饰玻碳电极作为工作电极)。
蔗糖、NaNO2、K3Fe(CN)6、K4Fe(CN)6均购自国药集团化学试剂有限公司。磷酸盐缓冲溶液(PBS)由KH2PO4、K2HPO4和KCl配制,用pH计调节pH值。实验所用试剂均为分析纯,实验用水为去离子水。
1.2 碳量子点的制备
根据Chen[13]的方法,将10 g蔗糖和20 mL油酸混合完全后倒入水热反应釜中,加热到215 ℃,在氮气保护下磁力搅拌油浴反应5 min。蔗糖缓慢融化,体系从橙黄色的悬浮液变为透明棕黄色溶液。将上清液倒出,得到褐色沉淀物用20 mL水溶解,并用己烷萃取溶液数次以除去多余的油酸。所得到的棕色分散液用截留分子量为1 000透析膜透析24 h,除去未反应的小颗粒,用水定容至500 mL,得到碳点分散液。在4 ℃下避光保存。
1.3 碳量子点-金纳米复合材料的制备
图1为Au-CDs复合材料制备示意图。

图1 Au-CDs复合材料制备示意图
将100 μL的HAuCl4(10 mg·mL-1)水溶液加到100 μL的碳点水溶液中,剧烈搅拌,在100℃下反应80 min,得到稳定的淡紫色溶液,即为Au-CDs复合材料。
1.4 修饰电极的制备
将玻碳电极分别用粒径为1.00 μm、0.50 μm、0.01 μm氧化铝粉末、麂皮打磨,冲洗干净后,在无水乙醇和去离子水中各超声5 min,用氮气吹干备用。将5 μL的Au-CDs复合溶液滴涂到已经处理好的电极表面,室温下干燥得到Au-CDs/ GCE修饰电极。
2 结果与讨论
2.1 碳点和修饰电极的表征
碳点透射电镜结果如图2所示。碳点具有良好的结晶性和单分散性,平均粒径为4.5 nm。
通过交流阻抗技术对修饰电极进行表征,如图3所示。

图2 碳点的透射电镜图
如图3所示,裸GCE的阻抗值为46.0 Ω,CDs修饰到电极表面后,即CDs/ GCE的阻抗值增大到234.6 Ω。这可能由于碳点的表面带负电,阻碍了[Fe(CN)6]3-/4-传递至电极表面[14]。当用Au-CDs复合材料修饰电极后,即Au-CDs/ GCE阻抗减小到122.0 Ω,说明Au-CDs复合材料能促进了电极表面的电子转移,金纳米粒子和碳点产生了协同作用,加速了电子的传输。
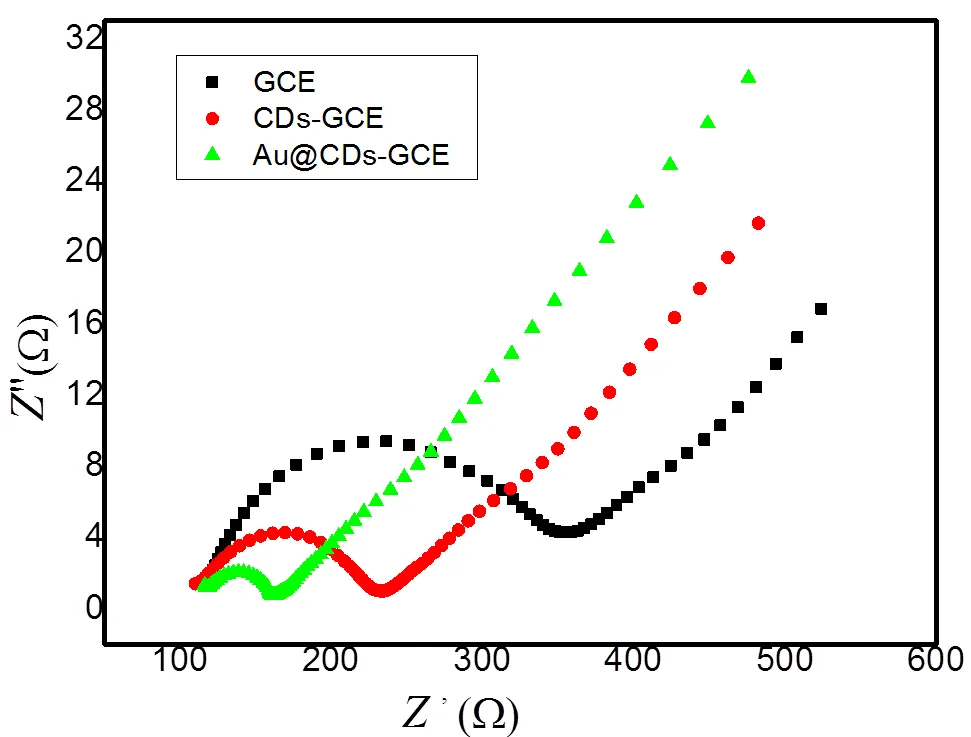
图3 不同修饰电极的交流阻抗图
2.2 修饰电极对亚硝酸盐的电化学催化
图4为采用循环伏安法考察所得不同电极对1.0 mmol·L-1的NaNO2的电化学响应。

图4 在含有1.0 mmol·L-1 NaNO2的0.10 mol·L-1的PBS(PH=7)溶液中不同电极的循环伏安图
由图4可见,裸GCE在1.0 V处有个NaNO2氧化峰,电极经CDs修饰后,氧化峰位置明显负移,且峰电流略有增大。这是由于碳量子点具有非常大的比表面积和超高的电子传递速率,能促进NO2-离子与电极之间的电子转移。在电极表面引入Au-CDs复合材料后,NaNO2氧化峰位置相比裸GCE负移了0.17 V,峰电流信号大幅提升,表明Au-CDs/GCE对NaNO2具有良好的催化性能,这可能是金纳米粒子提高了电极的导电性。另一方面,Au-CDs复合材料能均匀地分布在电极上,产生了协同催化的效果。
2.3 pH值和扫速的影响
图5为采用循环伏安法考察所得不同pH值的PBS溶液对NaNO2在Au-CDs/GCE氧化峰电流的影响。

图5 NaNO2在不同pH值PBS溶液中的循环伏安图
注:插图为pH值对氧化峰电流的影响,实验扫速:100 mV·s-1
由图5可见,pH值从4.0-7.0,NaNO2的响应电流随pH值增大而增大,pH 7.0时最大;随后pH增大,响应电流则减小。这可能是由于在酸性环境中,NO2-容易转变为NO和NO3-,导致NO2-浓度降低,氧化峰电流随之减小[15]。pH>7时,电流减小可能由于电极上的微环境改变而造成的。后面实验选择PBS电解质溶液pH=7。NaNO2氧化峰位置随体系pH值增大出现负移趋势,其氧化峰电位和pH值线性关系式为:
pa(V) = 1.118 - 0.049 5 pH(=0.996 9)。
图6为pH=7.0的PBS缓冲体系中,扫描速度对NaNO2氧化峰电流的影响。

图6 Au-CDs/GCE电极在不同扫速下循环伏安图
注:插图为NaNO2氧化峰电位值与扫描速率对数的线性关系
由图6可见,在20~100 mV·s-1范围内,Au-CDs/GCE在含有NaNO2的PBS溶液中的循环伏安图。NaNO2氧化峰电流随扫描的速度增大而增大,且呈线性关系,线性方程为:
p(μA) = -1.924 5 - 0.040 2(mV·s-1),
相关系数R=0.994,表明NaNO2在电极表面受吸附控制。
NaNO2氧化峰电位值和lg之间存在线性关系,其关系为(2=0.998):
pa(V)=0.074 6 lg(mV·s-1)+0.715
根据Laviron方程式[16]:

可计算出NO2-氧化反应的转移电子数约为2,与实际反应方程式相符。
2.4 线性范围和检测限
在最佳实验条件下,采用计时电流法对不同浓度NaNO2进行检测,如图7所示。
连续加入浓度逐渐增大的NaNO2溶液,在0.5 μM-1 000 μM范围内,响应电流持续出现阶跃且和NaNO2浓度呈良好线性关系:
Δp(μA) = -0.445 2 + 0.091(μmol·L-1)
相关系数=0.999 3,灵敏度为0.091,检测限为0.08 μmol·L-1(S/N=3)。

图7 Au-CDs /GCE 电极检测NaNO2的电流时间曲线(扫速100 mV·s-1)
注:插图为电流差值和浓度的线性关系。
对比不同电极对NaNO2的线性范围和检测限,如表1所示。
由表1可见,本文传感器有更宽的线性范围和较低的检测限。

表1 不同修饰电极对亚硝酸盐的检测性能比较
2.5 干扰实验
在实际的亚硝酸盐检测体系中,一些可能共存的电活性物质会产生干扰。为此采用计时电流法,在最佳实验条件下,研究了20倍浓度的硫酸镁、硝酸钾、氯化钙、碳酸钠、硫酸铵和葡萄糖等的加入对电化学信号的影响,结果无明显现象,说明此传感器具有较好的抗干扰能力。
2.6 传感器的重现性与稳定性
采用循环伏安法测量了5根平行电极在NaNO2浓度为1.0 mmol·L-1时的电化学响应电流,相对标准偏差为4.20%。表明此传感器具有较好的重现性。将传感器置于4 ℃冰箱中保存10天,测得电化学信号的相对标准偏差为8.2%,说明此传感器具有良好的稳定性。
2.7 实际样品检测
利用此传感器检测某湖水中的亚硝酸盐的含量,检测结果为6.201 μmol·L-1;利用国家标准分光光度法对同一样品进行检测,所得结果为6.002 μmol·L-1,说明此传感器对实际样品的检测准确性较高。

表2 传感器的回收率试验
表2为采用标准加入法测得的回收率实验结果,平均回收率为100.8%,表明此传感器用于实际样品的检测的可靠性。
3 结论
采用水热法制得碳点,以碳点作为还原剂直接制得了碳点-金纳米复合材料(Au-CDs)。此材料具有良好的水溶性和分散性,利用滴涂法将此材料固定在玻碳电极表面,制得的Au-CDs/GCE电极对亚硝酸盐表现出良好的检测性能。此传感器制备简单,重现性和稳定性好,抗干扰能力强,线性范围宽,可用于实际样品的检测。
[1] Greer F R, Shannon M. Infant methemoglobinemia: The role of dietary nitrate in food and water[J]. Pediatrics, 2005, 116(3): 784-6.
[2] Jay B F, Francis B S. The determination of nitrite: a critical review[J]. Anal Chem, 2008, 15(3): 283-313.
[3] Ojani R, Raoof J B, Zarei E. Electrocatalytic reduction of nitrite using ferricyanide; Application for its simple and selective determination[J]. Electrochimica Acta, 2006, 52(3): 753-759.
[4] Jiang L Y, Wang R X, Li X M, et al. Electrochemical oxidation behavior of nitrite on a chitosan-carboxylated multiwall carbon nanotube modified electrode[J]. Electrochem Commun, 2005, 7(6): 597-601.
[5] Pasquali C E, Hernando L P F A, Alegrıa J S D. Spectrophotometric simultaneous determination of nitrite, nitrate and ammonium in soils by flow injection analysis[J]. Anal Chim Acta, 2007, 600(1): 177-182.
[6] Lagalante A F, Greenbacker P W. Flow injection analysis of imidacloprid in natural waters and agricultural matrixes by photochemical dissociation, chemical reduction, and nitric oxide chemiluminescence detection [J]. Anal Chim Acta, 2007, 590(2): 151-158.
[7] Kodamatani H, Yamazaki S, Saito K, et al. Selective determination method for measurement of nitrite and nitrate in water samples using high-performance liquid chromatography with post-column photochemical reaction and chemiluminescence detection[J]. J Chro- matogr A, 2009, 1216(15): 3163-3167.
[8] Ferreira I, Silva S. Quantification of residual nitrite and nitrate in ham by reverse-phase high performance liquid chromatography/diode array detector[J]. Talanta, 2008, 74(5): 1598-1602.
[9] Ramdance-Terbouche C A, Terbounche A, Djebbar S, et al. Electrochemical sensors using modified electrodes based on copper complexes formed with algerian humic acid modified with ethylenediamine or triethylene- tetramine for determination of nitrite in water[J]. Talanta, 2014, 119(15): 214-225.
[10] Mani V, Dinesh B, Chen S M, Saraswathi R. Direct electrochemistry of myoglobin at reduced graphene oxide-multiwalled carbon nanotubes-platinum nano- particles nanocomposite and biosensing towards hydrogen peroxide and nitrite[J]. Biosens Bioelectron, 2014, 53(15): 420-427.
[11] Yuan B Q, Xu C Y, Liu L, et al. Polyethylenimine- bridged graphene oxide-gold film on glassy carbon electrode and its electrocatalytic activity toward nitrite and hydrogen peroxide[J]. Sens Actuators B, 2014, 198(31): 55-61.
[12] S Zhu, Y Song, X Zhao. The photoluminescence mechanism in carbon dots (graphene quantum dots, carbon nanodots, and polymer dots): Current state and future perspective[J]. 纳米研究, 2015, 8(2): 355-381.
[13] Chen B, Li F, Li S, et al. Large scale synthesis of photoluminescent carbon nanodots and their applica- tion for bioimaging[J]. Nanoscale, 2013, 5(5): 1967- 1971.
[14] Qitong H, Hanqiang Z, Shirong H, et al. A sensitive and reliable dopamine biosensor was developed based on the Au@carbon dots-chitosan composite film[J]. Bio- sensors & Bioelectronics, 2014, 52(7): 277-280.
[15] Brylev O, Sarrazin M, Roue L, Belanger D. Nitrate and nitrite electrocatalytic reduction on Rh-modified pyrolytic graphite electrodes[J]. Electrochim Acta, 2007, 52(21): 6237-6247.
[16] Laviron E. General expression of the linear potential sweep voltammogram in the case of diffusionless electrochemical systems[J]. Journal of Electro-analy- tical Chemistry, 1979, 101(1): 19-28.
Determination of Nitrite by Carbon Quantum Dots-Gold Nanocomposite Modified Electrode
BU Xiao-yang1, ZHENG Xiu1, LI Li2
(1. School of Pharmacy, Wannan Medical College, Wuhu 241002, China; 2. Department of Chemistry and Materials Science, Anhui Normal University, Wuhu 241003, China)
Carbon quantum dots were prepared by hydrothermal method, and the chloroauric acid was reduced by using carbon dots as a reducing agent to prepare carbon quantum dot-gold nanocomposites, which was modified on the surface of glassy carbon electrode by drop-coating method to construct an electrochemical biosensor. The electrochemical behavior of the electrode sensor was investigated by cyclic voltammetry, alternating current impedance and chronoamperometry. The results show that this sensor has good electrocatalytic activity for nitrite and can eliminate the interference of other electroactive substances. Under optimal conditions, the NaNO2concentration in the range of 0.5 μM-1 000 μM has a good linear relationship, Δp(μA)=-0.445 2 +0.091(μmol·L-1) with a correlation coefficient of=0.999 3, and the detection limit was 0.08 μmol·L-1(S/N=3).
carbon dots; gold nanomaterials; electrochemical sensors; nitrite
O661
A
1009-9115(2019)06-0001-05
10.3969/j.issn.1009-9115.2019.06.001
国家自然科学基金项目(21375002),安徽省大学生创新创业训练项目(201810368076),皖南医学院中青年科研基金项目(WK201804)
2019-05-17
2019-09-20
卜晓阳(1987-),女,安徽马鞍山人,硕士,实验师,研究方向为分析化学。
(责任编辑、校对:琚行松)

