植物β-半乳糖苷酶研究进展
李军玲 闫双勇 张融雪 王晓静 孙玥 苏京平 孙林静

摘要 植物β-半乳糖苷酶是一类糖苷水解酶,能够从β-D-半乳聚糖或寡聚糖支链非还原末端切除β-D-半乳糖残基。β-半乳糖苷酶广泛分布于各种植物中,通过对细胞壁的重塑参与植物生长发育过程。总结了植物β-半乳糖苷酶生化与分子生物学方面的最新研究进展,并就其结构域及催化机制、生化特性、亚细胞定位和表达模式、生理功能等方面展开详述。
关键词 β-半乳糖苷酶;基因家族;生理功能;亚细胞定位
中图分类号 Q 946.5文献标识码 A文章编号 0517-6611(2020)01-0015-04
doi:10.3969/j.issn.0517-6611.2020.01.004
开放科学(资源服务)标识码(OSID):
Research Progress on Plant β Galactosidase
LI Jun ling,YAN Shuang yong,ZHANG Rong xue et al
(Tianjin Crop Research Institute, Tianjin Key Laboratory of Crop Genetics and Breeding, Tianjin 300384)
Abstract Plant β galactosidase is a kind of glycoside hydrolase, which can remove terminal β D galactose residues from the non reducing end of β D galactan or the branched side chain of oligosaccharide. It is widely distributed in various plants and participates in plant growth and development through remodeling cell walls. In this paper, the latest advances in biochemical and molecular biology of plant β galactosidase were summarized. The structure domain, catalytic mechanism, biochemical characteristics, subcellular localization and expression patterns, physiological functions and so on were described in detail.
Key words β galactosidase;Gene family;Physiological function;Subcellular localization
β-半乳糖苷酶(β-galactosidases,BGALs)(EC3.2.1.23)是一類糖苷水解酶(glycoside hydrolases,GHs),能够从β-D-半乳聚糖或寡聚糖支链非还原末端切除β-D-半乳糖残基,广泛分布于植物、动物和微生物中。GH1、GH2、GH3、GH35、GH42、GH50和GH59水解酶家族中都发现了具有BGALs水解酶活性的成员,其中所有的植物源BGALs属于GH35家族[1]。
BGALs在生物体内起着重要作用。例如,人类GH35家族的GLB1基因参与消除溶酶体中神经节苷脂末端半乳糖残基,GLB1缺失导致毒性神经节苷脂积累进而引起神经节苷脂沉积症[2];人类GH59家族的GALC基因参与消除半乳糖神经酰胺半乳糖残基,基因缺陷后将导致Krabbe疾病[3];分子生物学中常用的大肠杆菌LacZ基因编码GH2家族BGAL,是细菌在葡萄糖饥饿条件下乳糖代谢所必需的[4]。植物源BGALs属于多基因家族,是一类与细胞壁多糖代谢相关的酶,从各种植物中分离得到的BGALs表明其参与多种生理过程,如种子萌发、花粉发育、果实成熟等。极少部分植物BGALs基因已被克隆并进行了功能鉴定,如拟南芥AtBGAL6和AtBGAL10基因失活分别导致种子黏液释放减少和荚果萼片变短[5-6];番茄TBG4的下调导致果实硬度增加等[7];但绝大多数植物BGALs在发育中的生理功能尚未明确。笔者总结了目前植物BGALs在细胞与分子生物学方面的最新研究进展,并就结构域及催化机制、生化特性、亚细胞定位和表达模式、生理功能等方面展开详述,同时,从水稻中克隆了OsBGAL1和OsBGAL6这2个基因,并分别构建了其过表达和基因敲除转基因株系,为后续生理功能研究提供了生物材料。
1 植物BGALs家族、结构域及其催化机制
所有的植物BGALs基因都属于GH35家族,是多基因家族,不同植物含有不同数目BGALs基因。拟南芥(Arabidopsis thaliana)基因组含有17个BGALs基因[8];番茄(Lycopersicon esculentum Mill.)基因组含中有17个BGALs基因[9];水稻(Oryza sativa)基因组含中有15个BGALs基因[10];其他植物如日本梨(Pyrus pyrifolia)[11]、油菜(Brassica campestris ssp.chinensis)[12]、桃(Prunus persica(L.)Batsch)[13]、亚麻(Linum usitatissimum)[14]、苹果(Malus pumila)[15]中分别含有8、16、17、43、13个BGALs基因成员。
已发现的植物BGALs蛋白含有的结构域类型包含N-信号肽、GH35保守序列、GH2N、BetaGal4_5、PRP_N、Gal-凝集素等。所有GH35家族的BGALs都含有GH35保守活性序列G-G-P-[LIVM](2)-x(2)-Q-x-E-N-E-[FY];Gal-凝集素和N-信号肽在BGALs序列中可单独存在,也可同时存在或不存在;其他如GH2N、BetaGal4_5、PRP_N等结构域只存在于少数特殊的BGALs中。
BGALs催化反应遵循Koshland保持机制,从β-异头碳构象端释放半乳糖。在CAZy数据库中,GH35家族属于GH-A分支,折叠成含有2个谷氨酸残基的(α/β)8跨膜桶状结构域,其中一个谷氨酸残基作为质子供体,另一谷氨酸残基作为催化反应的亲核基团,攻击底物异头碳形成的糖基-酶复合物[16]。植物中β-D连接的半乳糖残基可见于糖脂(如monogalactosyldiacyl -glycerol,MGDG)[17]、蛋白多糖(如arabinogalactan proteins,AGPs)[18]和细胞壁多糖[如木葡聚糖(xyloglucans)和鼠李半乳糖醛酸聚糖I(rhamnogalacturonan I,RGI)][19]等。
2 植物BGALs生化特性
自1994年以来,研究人员陆续从拟南芥、番茄、草莓、甜椒、苹果、萝卜、水稻、芒果、香蕉、樱桃、杨桃、柿子、鹰嘴豆、豌豆、芸豆等植物中分离得到多种活性BGALs,如表1所示。BGALs的pH适应范围较广,霉菌属来源的BGALs最适pH为2.5~5.4,酵母和细菌来源的BGALs最适pH为6.0~7.0[20],而已发现的植物BGALs最适pH为2.8~5.0,温度为37~67 ℃。植物BGALs可催化水解β-(1,2)-、β-(1,3)-、β-(1,4)-、β-(1,6)-等多种类型糖苷键[21],其底物涉及半乳聚糖(galactan)、阿拉伯半乳聚糖(arabino-galactans)、阿拉伯半乳聚糖蛋白(arabinogalactan proteins,AGPs)、木葡聚糖(xyloglucans)、半乳糖脂(galactolipids)和糖蛋白(glycoproteins)等多种细胞壁组分。
3 植物BGALs亚细胞定位及表达
拟南芥BGALs已有研究的基因全部定位于细胞壁。Gantulga等[22]利用免疫金标记方法证明AtBGAL1和AtBGAL12蛋白定位于木质部细胞壁;Dean等[5]构建AtBGAL6的GFP融合蛋白并在烟草中瞬时表达,表明AtBGAL6定位于细胞壁;Gantulga等[23]利用点杂交的方法发现拟南芥细胞壁组分中存在AtBGAL2和AtBGAL5;Wei等[24]利用蛋白质组学方法同样在拟南芥细胞壁检测到AtBGAL8。苹果Mdβ-Gal1、Mdβ-Gal2、Mdβ-Gal5基因的GFP融合表达载体在洋葱表皮细胞瞬时表达结果证明3个基因全部定位于细胞壁[15]。这些BGALs的亚细胞壁定位结果表明其在细胞壁重塑中有重要作用。
拟南芥BGALs基因在不同组织器官中呈现差异化表达,AtBGAL17主要在茎秆表达,AtBGAL7、AtBGAL11、AtBGAL13主要在花器官中表达,AtBGAL12、AtBGAL14、AtBGAL16则在检测的组织中很少表达,其余AtBGALs成员则在多个组织中均有表达[9]。同样地,在水稻、亚麻等其他植物BGALs基因家族成员的表达都是有组织差异性和特异性。这说明BGALs广泛参与了植物生长发育过程。
4 植物BGALs的生理功能
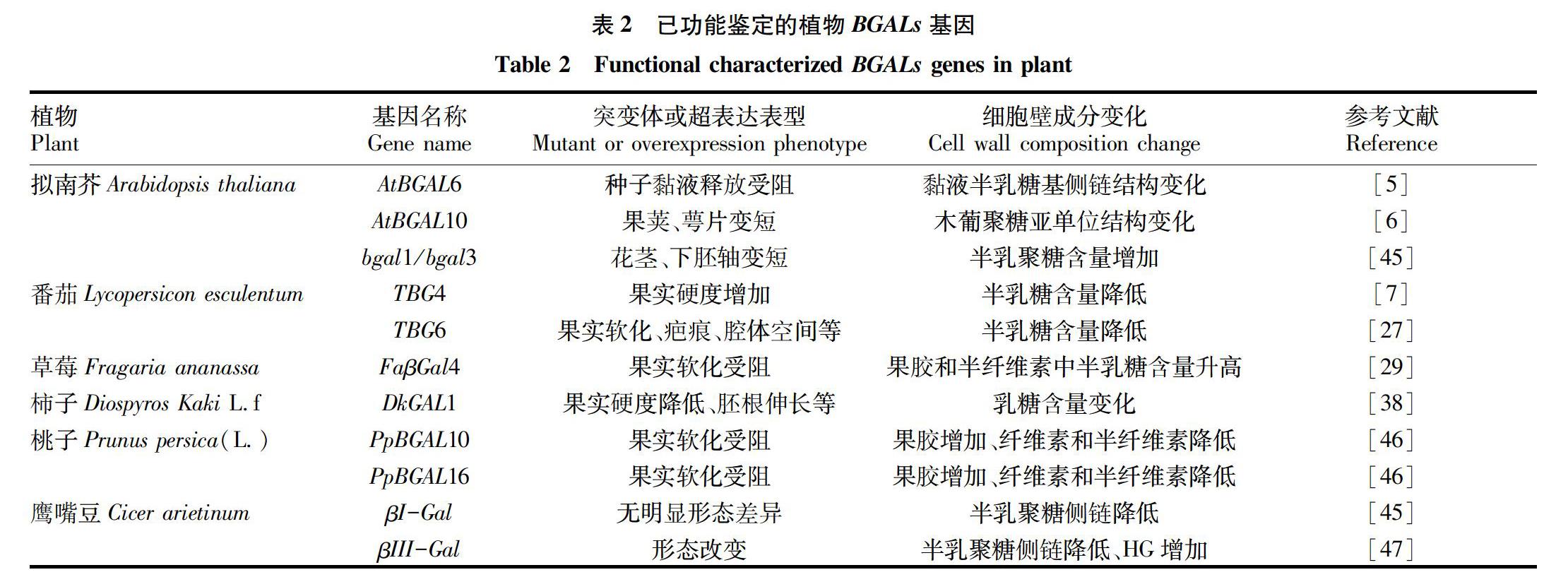
植物细胞壁参与了许多重要生理过程,如维持控制细胞生长、物质运输和信息传递、防御反应、细胞黏附及其他应激反应等[42-43]。植物BGALs的作用底物包含多种细胞壁组分,表明BGALs是通过对细胞壁的重塑而参与植物生长发育的。目前已明确生理功能的BGALs基因匯总见表2,主要体现在以下几个方面:①参与果实成熟软化过程。果实成熟软化过程与细胞壁成分变化息息相关,主要是果胶多糖结构的改变,如在甲酯酶、果胶裂解酶、半乳糖醛酸酶和BGALs作用下果胶多糖结构改变,从而促进果实软化成熟;如表2中TBG4、TBG6、FaβGal4、DkGAL1、PpBGAL10、PpBGAL16等基因都与果实软化相关。②参与花器官的发育。如将矮牵牛花中的6个BGALs基因同时敲除后,其花瓣中果胶半乳聚糖含量增加,但花瓣的强度降低[44];AtBGAL10突变体表现出萼片及果荚变短。③参与种子萌发、胚根伸长等其他生长发育过程。如拟南芥bgal1/bgal3双突变体花茎和下胚轴变短。
48卷1期李军玲等 植物β-半乳糖苷酶研究进展
5 植物BGALs的应用
微生物源BGALs是一种重要的食用生物催化剂,被广泛应用于乳品行业中的乳糖水解,这些BGALs具有热稳定性或低温活性。低温(如4 ℃)BGALs应用于食品工业从热敏感乳制品中去除乳糖污染[48];高温(如70 ℃)条件下有最佳水解活性的BGALs,被用于工业生产无乳糖奶[49]。除了水解酶活性,某些微生物BGALs具有转糖苷活性,可将半乳糖残基转移至乳糖形成一种人类益生元膳食β-低聚半乳糖(β-galacto-oligo-saccharides,GOS)[50],BGALs转糖苷研究逐渐成为近年来功能性低聚糖开发和技术应用的新热点。
BGALs虽然已经实现商品化,但其应用仍受到热稳定、产物抑制、转糖苷活性低等问题的限制,植物BGALs具有数量多、低成本、易获得、污染风险低等优势,可作为新的酶源,开发出具有特殊催化功能的BGALs,满足工业化生产的需求。如从豌豆中分离得到的PsBGAL具有高乳糖亲和性、高水解效率,并被进一步开发成固定酶类Sephadex-PsBGAL和Chitosan-PsBGAl[51];鹰嘴豆CpGAL也同样可开发成为固定化酶[52]。
6 植物BGALs未来研究方向
关于植物BGALs的生物学和生化作用研究方興未艾,主要有以下几个主要问题有待解决:首先,除了GH35保守序列和信号肽,BGALs中其他结构域的功能是什么?如前人研究表明一个水稻BGAL1(LOC_Os03g06940)的凝集素结构域有凝集素活性,可能与BGALs底物特异性识别有关[53]。目前“结构-功能”关系的分子调控研究滞后,如何将已有的酶学数据与分子结构和功能信息结合,深入研究催化机理和调控机制是BGALs研究领域的探索方向之一。第二是BGALs时空表达问题。作为一个大的基因家族,要明确每个BGAL的生化功能首先需要对BGAL进行纯化,而某些BGALs难以纯化;而且可能存在功能冗余,导致明确其生理功能存在一定难度,如拟南芥AtBGAL1、AtBGAL2、AtBGAL3、AtBGAL4、AtBGAL5、AtBGAL12这6个基因单基因敲除后,其突变体没有明显的表型变化[54],但bgal1/bgal3双突变体则表现出花序茎和下胚轴变短等。第三,BGALs的天然底物是什么,释放的β-半乳糖去向哪里?半乳聚糖、糖脂和蛋白多糖中都存在β-D-半乳糖残基,细胞壁结构复杂且是动态变化的,那么植物各种生理过程中BGALs的具体底物会差异显著。而BGALs水解释放的半乳糖残基可能有3种去向:①作为能量来源;②作为底物用于构建新的糖缀合物;③作为信号分子启动信号级联反应。在植物中,糖分子如葡萄糖和蔗糖既可作为能源,也可作为信号分子。葡萄糖在细胞凋亡和器官发育过程中起着重要作用[55];蔗糖可作为信号分子调控果聚糖和花青素的生物合成[56]。那么乳糖能否作为信号分子将是一个新的研究方向。
参考文献
[1] LOMBARD V,GOLACONDA R H,DRULA E,et al.The carbohydrate active enzymes database(CAZy)in 2013[J].Nucleic Acids Res,2014,42:490-495.
[2] OHTO U,USUI K,OCHI T,et al.Crystal structure of human β galactosidase:Structural basis of Gm1 gangliosidosis and morquio B diseases[J].J Biol Chem,2012,287(3):1801-1812.
[3] DEANE J E,GRAHAM S C,KIM N N,et al.Insights into Krabbe disease from structures of galactocerebrosidase[J].Proc Natl Acad Sci USA,2011,108(37):15169-15173.
[4] JUERS D H,MATTHEWS B W,HUBER R E.LacZ β galactosidase:Structure and function of an enzyme of historical and molecular biological importance[J].Protein Sci,2012,21(12):1792-1807.
[5] DEAN G H,ZHENG H Q,TEWARI J,et al.The Arabidopsis MUM2 gene encodes a β galactosidase required for the production of seed coat mucilage with correct hydration properties[J].Plant Cell,2007,19(12):4007-4021.
[6] SAMPEDRO J,GIANZO C,IGLESIAS N,et al.AtBGAL10 is the main xyloglucan β galactosidase in Arabidopsis,and its absence results in unusual xyloglucan subunits and growth defects[J].Plant Physiol,2012,158(3):1146-1157.
[7] SMITH D L,ABBOTT J A,GROSS K C.Down regulation of tomato β galactosidase 4 results in decreased fruit softening[J].Plant Physiol,2002,129(4):1755-1762.
[8] AHN Y O,ZHENG M Y,BEVAN D R,et al.Functional genomic analysis of Arabidopsis thaliana glycoside hydrolase family 35[J].Phytochemistry,2007,68(11):1510-1520.
[9] CHANDRASEKAR B,VAN DER HOORN R A.Beta galactosidases in Arabidopsis and tomato A mini review[J].Biochem Soc Trans,2016,44(1):150-158.
[10] TANTHANUCH W,CHANTARANGSEE M,MANEESAN J,et al.Genomic and expression analysis of glycosyl hydrolase family 35 genes from rice(Oryza sativa L.)[J].BMC Plant Biol,2008,8:1-17.
[11] TATEISHI A,NAGASHIMA K,MATHOOKO F M,et al.Differential expression of members of the β galactosidase gene family during Japanese Pear(Pyrus pyrifolia L.)fruit growth and on tree Ripening[J].J Amer Soc Hort Sci,2005,130(6):819-829.
[12] LIU J L,GAO M H,LV M L,et al.Structure,evolution,and expression of the β galactosidase gene family in Brassica campestris ssp.chinensis[J].Plant molecular biology reporter,2013,31(6):1249-1260.
[13] GUO S L,SONG J,ZHANG B B,et al.Genome wide identification and expression analysis of β galactosidase family members during fruit softening of peach[Prunus persica(L.)Batsch][J].Postharvest biology & technology,2018,136:111-123.
[14] HOBSON N,DEYHOLOS M K.Genomic and expression analysis of the flax(Linum usitatissimum)family of glycosyl hydrolase 35 genes[J].BMC Genomics,2013,14:1-14.
[15] YANG H J,LIU J L,DANG M L,et al.Analysis of β galactosidase during fruit development and ripening in two different texture types of apple cultivars[J].Front Plant Sci,2018,9:1-13.
[16] ROJAS A L,NAGEM R A P,NEUSTROEV K N,et al.Crystal structures of β galactosidase from Penicillium sp.and its complex with galactose[J].J Mol Biol,2004,343(5):1281-1292.
[17] SIEBERTZ M,HEINZ E.Galactosylation of different monogalactosyldiacylglycerols by cell free preparations from pea leaves[J].Hoppe Seylers Z Physiol Chem,1977,358(1):27-34.
[18] SHOWALTER A M.Arabinogalactan proteins:Structure,expression and function[J].Cell Mol Life Sci,2001,58(10):1399-1417.
[19] YAPO B M.Rhamnogalacturonan I:A structurally puzzling and functionally versatile polysaccharide from plant cell walls and mucilages[J].Polymer reviews,2011,51(4):391-413.
[20] 董藝凝,陈海琴,张灏,等.β-半乳糖苷酶的研究现状与进展[J].食品与生物技术学报,2018,37(4):337-343.
[21] DWEVEDI A,KAYASTHA A M.Plant β galactosidases:Physiological significance and recent advances in technological applications[J].Journal of plant biochemistry and biotechnology,2010,19(1):9-20.
[22] GANTULGA D,AHN Y O,ZHOU C H,et al.Comparative characterization of the Arabidopsis subfamily a1 β galactosidases[J].Phytochemistry,2009,70(17/18):1999-2009.
[23] GANTULGA D,TURAN Y,BEVAN D R,et al.The Arabidopsis At1g45130 and At3g52840 genes encode β galactosidases with activity toward cell wall polysaccharides[J].Phytochemistry,2008,69(8):1661-1670.
[24] WEI H,BRUNECKY R,DONOHOE B S,et al.Identifying the ionically bound cell wall and intracellular glycoside hydrolases in late growth stage Arabidopsis stems:Implications for the genetic engineering of bioenergy crops[J].Front Plant Sci,2015,6:1-14.
[50] ESKANDARLOO H,ABBASPOURRAD A.Production of galacto oligosaccharides from whey permeate using β galactosidase immobilized on functionalized glass beads[J].Food Chem,2018,251:115-124.
[51] DWEVEDI A,KAYASTHA A M.Optimal immobilization of β galactosidase from Pea(PsBGAL)onto Sephadex and chitosan beads using response surface methodology and its applications[J].Bioresource technology,2009,100(10):2667-2675.
[52] KISHORE D,KAYASTHA A M.Optimisation of immobilisation conditions for chick pea β galactosidase(CpGAL)to alkylamine glass using response surface methodology and its applications in lactose hydrolysis[J].Food Chem,2012,134(3):1650-1657.
[53] JIANG S Y,MA Z G,RAMACHANDRAN S.Evolutionary history and stress regulation of the lectin superfamily in higher plants[J].BMC Evol Biol,2010,10:1-24.
[54] MONEO S NCHEZ M,IZQUIERDO L,MART N I,et al.Knockout mutants of Arabidopsis thaliana β galactosidase.modifications in the cell wall saccharides and enzymatic activities[J].Biol Plantarum,2018,62(1):80-88.
[55] WINGLER A,MASCLAUX DAUBRESSE C,FISCHER A M.Sugars,senescence,and ageing in plants and heterotrophic organisms[J].J Exp Bot,2009,60(4):1063-1066.
[56] TOGNETTI J A,PONTIS H G,MART NEZ NOL G M.Sucrose signaling in plants:A world yet to be explored[J].Plant Signal Behav,2013,8(3):1-10.

