临床措施对重型颅脑损伤病人肠内营养耐受性影响的回顾性研究
房玉丽,艾山木,梁泽平,姚 娟,朱京慈*
(1.中国人民解放军陆军军医大学,重庆 400038;2.陆军特色医学中心)
重型颅脑损伤(severe traumatic brain injury,STBI)发生后,由于中枢神经系统受损、脑肠轴功能紊乱以及肠道血供减少等原因,致使肠内营养(enteral nutrition,EN)期间喂养不耐受(feeding intolerance,FI)高发[1]。喂养不耐受是妨碍肠内营养顺利实施、影响病人营养状况及预后的主要原因[2]。因此,国内外学者就喂养不耐受发生机制、防治措施及影响因素等开展积极探索[3]。既往研究显示,除疾病本身及病人营养、免疫等机体状态方面外[4‐5],临床措施也被证实可诱发喂养不耐受[6]。随着医疗技术的日益发展,临床措施对重型颅脑损伤病人胃肠功能的影响也趋于复杂。本研究旨在探析目前临床常用措施对于重型颅脑损伤病人肠内营养喂养不耐受的危险因素及保护因素,为采用更合理的临床措施,进一步降低喂养不耐受发生率提供参考。
1 对象与方法
1.1 研究对象 本研究为单中心、回顾性研究,收集2013 年3 月—2019 年3 月重庆市某三级甲等医院综合重症监护室(ICU)收治的重型颅脑损伤病人的资料。纳入标准:符合2016 年中国神经科学学会神经损伤与修复分会的诊断标准[7],有明确脑外伤病史,且经头颅CT 和/或MRI 检查证实为颅脑损伤;格拉斯哥昏迷评分(GCS)3~8 分;受伤前无其他脏器病变,无营养、免疫及代谢的相关疾病;年龄≥18 岁。排除标准:已经开始实施肠内营养;ICU 停留时间<5 d 和/或非喂养不耐受原因致肠内营养时间<3 d;合并腹部损伤和/或已存在胃肠动力障碍;孕产妇;住院期间病例资料记录不全者。本研究获医院伦理委员会批准[医研伦审(2019)第04 号]。
1.2 研究方法
1.2.1 喂养不耐受判断标准 本研究喂养不耐受的判定标准参考2012 欧洲危重病学会腹部问题协作组[8]关于喂养不耐受的定义并结合临床实际情况:肠内营养过程中发生腹泻、腹胀、便秘、胃潴留等胃肠道不良反应;临床原因致肠内营养暂停或减少,使病人72 h 内无法达到25~30 kcal/(kg·d)目标热量的80%。其中腹泻指1 d 有多于3 次或更多的松散、水样便,同时便量在200~250 g/d 或1 次松散、水样便明显超过250 g;便秘指连续3 d 未排便;胃潴留指6 h 内累计胃残余量大于250 mL。
1.2.2 资料收集方法 通过电子病历系统查询医嘱信息获取相关临床措施及用药情况;通过重症监护系统收集病人胃肠症状,并使用自行设计病例报告表由两名研究者对相关信息进行收集、录入。
1.2.3 资料收集内容 资料收集内容包括病人一般资料,自肠内营养日起连续5 d 临床主要医疗、护理措施及胃肠症状,以喂养不耐受发生为观察终点。①医嘱提取内容包括脱水剂、抑酸剂、镇痛药、镇静药、抗生素、促动力药、导泻剂、益生菌等重型颅脑损伤病人临床常用药物使用情况,以及是否行早期肠内营养(伤后48 h 内)、间断胃肠减压、联合肠外营养,序贯性给予整蛋白、机械通气、保留灌肠等肠内营养相关医疗、护理措施。②胃肠症状包括每日胃残余量,排便次数与量,是否腹胀、呕吐。
1.2.4 统计学方法 采用EpiData 3.1 软件进行数据录入,SPSS 23.0 进行统计学分析。正态分布计量资料用均数±标准差()表示;非正态分布计量资料用中位数和四分位数间距表示;计数资料用例数、百分比表示,组间比较行χ2检验;对单因素分析中P<0.1的指标行二分类Logistic 回归分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料 6 年间ICU 共收治324 例重型颅脑损伤病人,剔除入ICU 前已进食78 例,ICU 停留时间<5 d 和(或)非喂养不耐受原因致肠内营养时间<3 d 71例;合并腹部损伤和(或)已存在胃肠动力障碍25 例;年龄<18岁7例,孕妇2例,记录不全4例,最终纳 入137 例鼻饲肠内营养病人。其中男101 例,女36 例;年龄48.0(32.0,60.0)岁;GCS 评 分3~5 分39 例,占28.47%;致伤原因主要包括车祸、高处坠落、摔伤以及其他。
2.2 重型颅脑损伤病人肠内营养喂养不耐受发生情况 本研究结果显示,82 例发生喂养不耐受。包括便秘29 例(35.4%)、腹泻20 例(24.4%)、胃潴留14 例(17.1%)、腹胀6 例(7.3%)、呕吐3 例(3.7%)、便秘合并胃潴留4 例(4.9%)、呕吐合并便秘2 例(2.4%)、腹胀合并腹泻1例(1.2%)、腹胀合并胃潴留1例(1.2%)、腹泻合并便秘1 例(1.2%)、呕吐合并腹泻及胃潴留1 例(1.2%),其中4 例病人72 h 未达目标热量的80%;喂养不耐受发生在肠内营养后的(2.80±1.45)d 内。
2.3 一般资料及临床医疗护理措施的单因素分析①一般资料。结果显示,GCS 评分对病人喂养不耐受的发生有统计学意义(P<0.05)。②医疗护理措施。使用脱水剂、保留灌肠、抑酸剂、镇痛剂、促动力药组内比较差异有统计学意义(P<0.05);镇静剂、间断胃肠减压、机械通气、使用抗生素≥3 d、联合肠外营养、早期肠内营养、血管活性药、口服导泻剂、序贯性肠内营养、益生菌组内比较差异无统计学意义(P>0.05)。见表1。
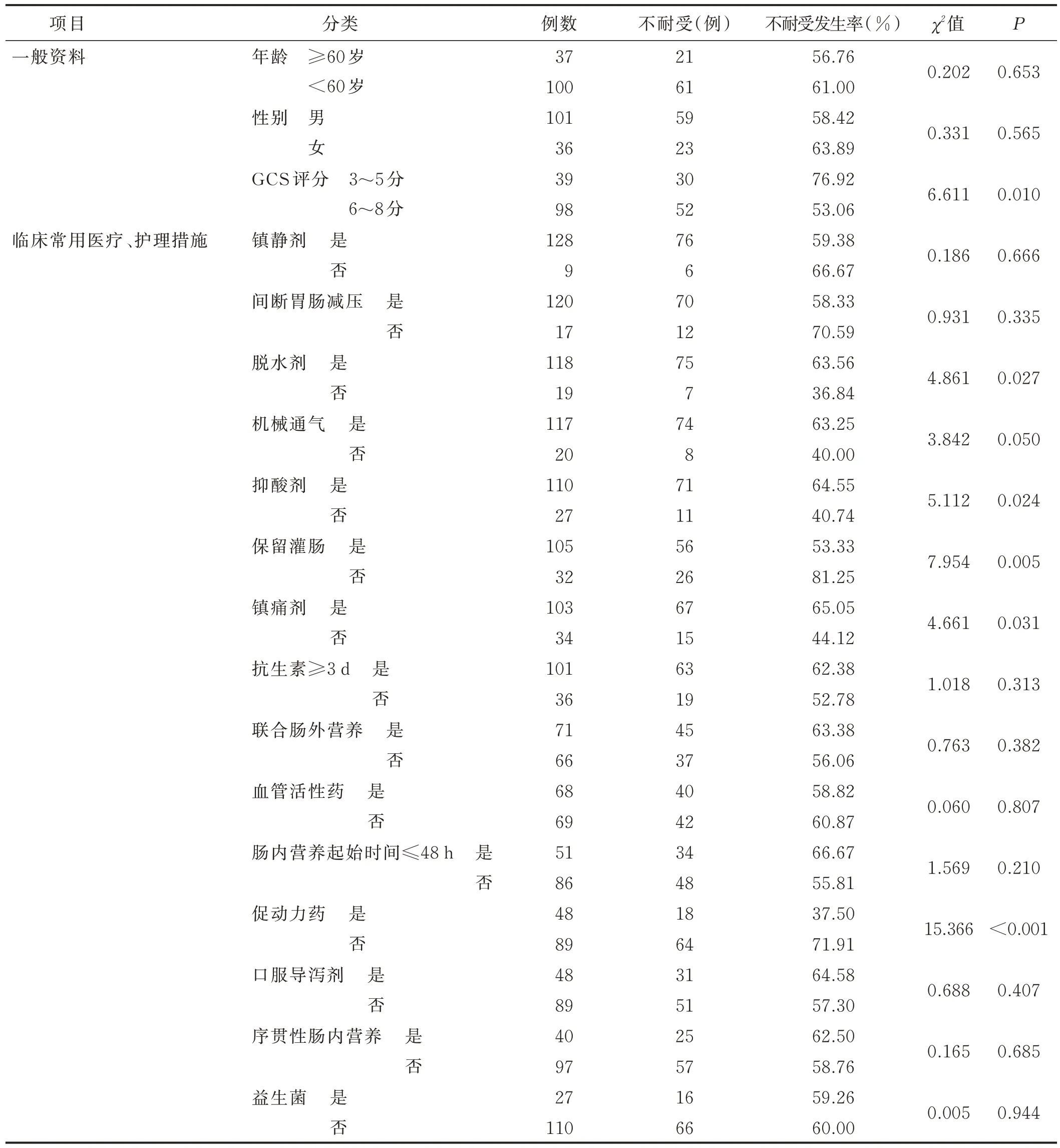
表1 一般资料及临床常用医疗护理措施的单因素分析结果
2.4 临床医疗护理措施的Logistic 回归分析 将单因素分析中P<0.1的医疗护理措施相关指标纳入Logistic回归模型。虽然年龄、性别的单因素分析结果没有统计学意义,但作为影响临床措施实施效果的主要因素,与颅脑损伤程度共同作为混杂因素代入模型并对各自变量赋值(见表2),结果显示,使用促动力药是保护因素,颅脑损伤程度、抑酸剂、镇痛剂是危险因素。见表3。

表2 自变量赋值
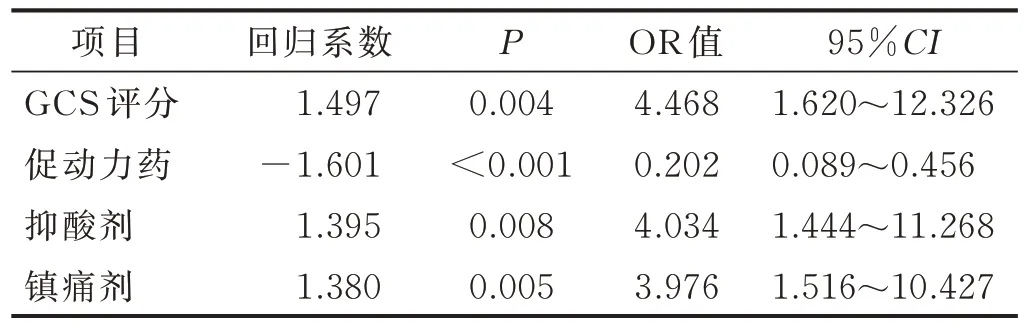
表3 临床常用措施的Logistic 回归分析结果
3 讨论
3.1 重型颅脑损伤病人肠内营养喂养不耐受发生率较高 重型颅脑损伤病人因中枢神经系统损害及炎症反应,胃肠功能障碍较其他创伤病人出现更早、严重程度更高[9]。2007 年,关于肠内营养的一项回顾性研究显示,重型颅脑损伤病人喂养不耐受的发生率高达80%[10]。本研究中该类病人喂养不耐受的发生率为59.9%。分析原因可能为:近年来,临床医疗、护理技术水平的不断提升,对胃肠功能的保护措施更加全面,肠内营养支持技术更加合理规范,促进了重型颅脑损伤病人胃肠功能的恢复,有效降低了喂养不耐受的发生率。但是,重型颅脑损伤病人的喂养不耐受发生率仍处于较高水平,降低喂养不耐受的发生率仍是亟须解决的问题。对本组病例喂养不耐受的临床症状进行分析,发生率最高的为便秘,其次为腹泻、胃潴留等。颅脑损伤相关胃肠功能障碍多表现为胃肠动力下降、肠屏障及吸收功能减弱[11]。颅脑损伤后下丘脑-垂体-肾上腺轴与脑-肠轴活动紊乱、脑肠肽分泌异常[12];肠上皮细胞凋亡致使屏障功能受损,肠道炎症反应加重[13];颅内压升高、应激性血糖升高[14];加之镇痛剂等药物的应用,以上因素均可抑制胃肠运动,导致排便功能障碍和胃潴留。此外,重型颅脑损伤病人常使用脱水剂降低颅内压,易造成肠道水分流失,增加便秘风险[15]。但在本研究多因素分析中,未显示脱水剂是喂养不耐受的危险因素,这可能与脱水剂使用时间主要集中于伤后1 周内脑水肿高峰期,对损伤后期肠内营养耐受性影响较小有关。重型颅脑损伤后发生腹泻与以下原因有关:颅脑损伤后肠道应激性缺血缺氧可致肠绒毛高度、表面积减少致使肠道吸收功能减弱[16],易发生吸收障碍性腹泻。肠内营养实施过程中导致腹泻的因素亦较多,如使用抗生素可引起肠道菌群失调性腹泻[17]。抗生素相关腹泻不但受应用时长的影响,老年、女性、重复用药也可增加其发生风险[18]。本研究病人主要以中青年男性为主,可能是本研究未发现应用抗生素≥3 d 是重型颅脑损伤发生喂养不耐受危险因素的原因。
3.2 临床常用措施对肠内营养耐受性的影响
3.2.1 促动力药 促动力药是通过增加胃肠推进性运动来改善胃轻瘫和肠动力不足,同时还可缩短细菌滞留时间,减少细菌和内毒素易位的机会[19]。多项研究[20‐22]及指南[23]均对促动力药治疗重症病人肠内营养喂养不耐受的效果予以肯定,但对预防性应用促动力药的观点目前并不一致。Diamond 等[24]对近年相关文献进行综述,评价促动力药对重症肠内营养病人的作用及效果,并提出重症病人应尽早、预防性应用促动力药以提高肠内营养耐受性。2015 年加拿大临床实践指南[25]也推荐在肠内营养起始时期可以考虑应用促动力药以更好地促进肠内营养耐受性。而Lewis 等[26]一项评价促动力药在重症病人肠内营养期间应用的有效性Meta 分析显示,预防性用促动力药并没有显著减少重症病人喂养不耐受的发生,但该研究未对不同类型的重症病人做亚组分析。本研究显示,预防性应用促动力药是保护因素,进一步证明了预防性应用促动力药可有效提高重型颅脑损伤病人肠内营养耐受性,减少喂养不耐受的发生。但由于回顾性资料的局限性以及样本量相对较少,下一步尚需要进行大样本前瞻性临床试验以明确预防性用促动力药对重型颅脑损伤病人肠内营养耐受性的影响。
3.2.2 镇静剂和镇痛剂 镇静剂和镇痛剂是重型颅脑损伤病人常用治疗措施,不但可以减轻病人疼痛、防止躁动的发生,还可以提高局部脑血流量和代谢需求的耦合,降低脑血容量及颅内压水平[27‐28]。本研究结果显示,镇痛剂是喂养不耐受发生的独立危险因素。临床镇痛剂包括以吗啡为代表的阿片类镇痛剂以及非甾体类消炎药等非阿片类镇痛剂。阿片类镇痛剂是强效的中枢镇痛剂之一,通过刺激中枢神经系统μ 阿片受体起到镇痛作用,分布在肠道神经系统的μ 受体同样会受到刺激,从而引发幽门、胆管括约肌张力增加;肠、胆管、胰腺分泌物减少,肠道对水吸收增加,最终致使胃肠动力减弱,临床常表现为便秘、腹胀等[29]。现有证据表明非阿片类镇痛剂可以减少阿片类药物的用量和不良反应[30]。但其中非甾体类消炎药因自身呈酸性亦可直接对胃黏膜造成损害,还能通过抑制环氧化酶(COX)活性,阻断PGs 合成,破坏胃黏膜血液循环[31],继而影响胃排空[32]。因此,当病人应用镇痛剂时应对使用效果进行及时评估,以减少镇痛剂的使用频次及剂量,合理应用阿片类及非阿片类镇痛剂,减少其对重型颅脑损伤病人胃肠功能的损害。既往研究表明,临床镇静基本药物丙泊酚以剂量依赖方式抑制胃肠动力,即小剂量对胃肠动力抑制较弱[33],而本研究中未对镇静剂的使用剂量进行记录、分析,可能是导致镇静剂的使用差异无统计学意义的原因。
3.2.3 抑酸剂 本研究结果显示,使用抑酸剂是重型颅脑损伤病人发生喂养不耐受的独立危险因素。应激性溃疡是重型颅脑损伤病人常见并发症之一,临床上通常应用抑酸剂预防应激性溃疡的发生。近期相关综述表明,抑酸剂的应用可导致细菌过度增殖、胃排空延迟、胃内pH 增高、黏液黏度降低以及改变肠道菌群结构等不良反应,还可增加病人发生肺炎及胃肠道感染等概率[34]。一项纳入50 项临床研究的Meta 分析显示,应用抑酸剂可以显著增加住院病人发生艰难梭菌感染风险,继而引起腹泻[35]。临床研究表明,开展早期肠内营养,可有效降低重型颅脑损伤病人发生应激性溃疡风险,减少抑酸剂的应用[36]。因此,对重型颅脑损伤病人于血流动力学稳定后开展早期肠内营养,对减少喂养不耐受的发生具有重要意义。
3.2.4 其他措施 在既往研究中发现,一些临床措施可影响病人的胃肠功能,但在本研究结果中未能进入回归方程,可能与部分措施对胃肠功能影响受多种因素作用有关。例如机械通气病人可由于腹内压增高导致胃肠道血流灌注异常[37],呼吸机性相关肺炎(ventila‐tor‐associated pneumonia,VAP)若发生菌血症[38],可增加腹泻风险。但通气模式[39]及时长[40]会影响腹内压、VAP 的程度。另外依据隆德概念,本组病人早期应用轻微过度通气,可避免脑血管过度收缩,降低脑血容量[41],减少对胃肠动力的抑制,可能是本研究中机械通气未增加重型颅脑损伤病人发生喂养不耐受的原因。对于便秘病人,保留灌肠常作为辅助措施用以促进病人排便。本研究单因素分析中保留灌肠对减少喂养不耐受的发生有统计学意义(P<0.05),但在回归模型中没有得到阳性结果。分析原因:一方面可能与肛管的插入深度、体位有关[42],重型颅脑损伤病人常用镇静、机械通气等措施可影响其体位的有效摆放及肛管置入深度,继而影响灌肠后的排便效果;另一方面,重型颅脑损伤病人可能伤及排便中枢,造成排便反射迟钝,也会影响灌肠后的排便率[43]。此外,在既往研究中发现益生菌具有改善重型颅脑损伤病人胃肠动力[44],降低肠黏膜通透性,提高机体免疫功能[45],促进小肠绒毛增生,加快肠黏膜恢复[46],缩短达到目标喂养天数[47]的作用。但是本研究未发现其对喂养不耐受具有改善作用,这有可能与益生菌的疗效易受到喂养方式、剂量、菌种类别、活性程度、起效时间等影响有关。综上所述,临床一些保护或抑制胃肠功能的措施在实际应用中易受剂量、应用时长、操作技巧等诸多因素的影响,医护人员在实施过程中需要探讨和关注细节,并通过优化实施方案,以确保对胃肠功能的改善作用。
4 小结
重型颅脑损伤病人病情危重、治疗措施复杂,在肠内营养过程中极易发生喂养不耐受。本研究从该类病人临床常用措施的角度分析了不同措施对重型颅脑损伤病人肠内营养耐受性的影响,结果显示,在治疗过程中使用抑酸剂及镇痛剂是肠内营养耐受性的危险因素,预防性应用促动力药是保护性因素,这一发现可为进一步提升重型颅脑损伤病人肠内营养耐受性防治效果提供启示和参考。

