植被恢复的岩溶湿地沉积物细菌群落结构和多样性分析
姜 磊, 凃 月, 侯英卓, 王敦球, 陈文文, 李海翔
桂林理工大学环境科学与工程学院, 广西 桂林 541006
微生物是湿地生态系统中的分解者,参与营养元素的迁移转化及能量循环[1],同时,它也是环境灵敏的指示者[2],其多样性直接受水体环境的影响,所以常被用来表征环境质量. 而较水中悬浮微生物而言,沉积物微生物无论是数量上还是功能上都显得更为丰富[3]. 因而开展天然湿地沉积物微生物群落及环境因子的研究对了解微生物群落在生态系统中的功能和对生态系统的影响有重要意义.
会仙岩溶湿地位于我国广西壮族自治区桂林市会仙镇,被誉为“漓江之肾”,是我国目前已知漓江流域最大的岩溶峰林湖泊型湿地[4],拥有保持水源、维护生物多样性等生态功能. 与其他类型湿地不同的是,岩溶湿地规模小、数量少,且因其地处脆弱的喀斯特地区,所以稳定性较差、相对隐蔽性较高、物质来源匮乏,土壤一般较为贫瘠,具有典型的富钙偏碱性岩溶地球化学背景[5]. 最重要的是,岩溶地区与非岩溶地区湿地在水文特征、水质、土壤和生物生态方面存在本质的区别[5]. 因而,对会仙岩溶湿地进行微生物与环境因子间的研究显得很有必要. 目前,会仙岩溶湿地的环境问题已不容乐观,由于人口素质和经济条件的制约,人为因素对于湿地的干扰愈发明显,如湿地内鸭禽养殖、农业退水、码头生活污水直排等造成湿地水质逐渐变差;另外,耕地与鱼塘面积扩大而造成湿地被支离和碎块化,湿地面积从20世纪70年代末的120 km2萎缩至21世纪初的24 km2左右,且常年有水的面积已不足6 km2[6];湿地生态结构也在逐年退化,包括中华水韭、普通野稻在内的部分国家重点保护植物已难觅踪迹,多数植物群落分布面积小,且已出现片段化的现象,这可能会进一步影响到湿地的生物地球化学循环. 因此,从微生物角度出发,研究湿地沉积物细菌群落结构分布及多样性情况非常重要,这有助于分析微生物与环境因子间的关系,揭示湿地元素迁移转化的机理,也可为湿地的恢复及制定有效合理的管理策略提供科学依据[7].
近年来,针对会仙岩溶湿地微生物的研究主要包括水体细菌学[8]、微生物活性[9]等方面,尚缺乏典型流域微生物群落结构及多样性的研究. 而国内有关湿地微生物群落结构的研究绝大多数采用基于杂交或PCR的分子生物学技术,包括荧光原位杂交(Fluorescence In Situ Hybridization,FISH)[10]、克隆文库[11]等技术. 该研究采用高通量测序技术对典型喀斯特湿地——桂林会仙岩溶湿地内桂柳古运河睦洞河段沉积物细菌群落结构及多样性进行分析,探讨其结构变化特征以揭示植被恢复中会仙岩溶湿地的土壤以及水体质量变化规律[12],初步确定破坏湿地环境的干扰因素,从而为会仙岩溶湿地的生态管理和保护提供参考.
1 材料与方法
1.1 样品采集与理化性质分析
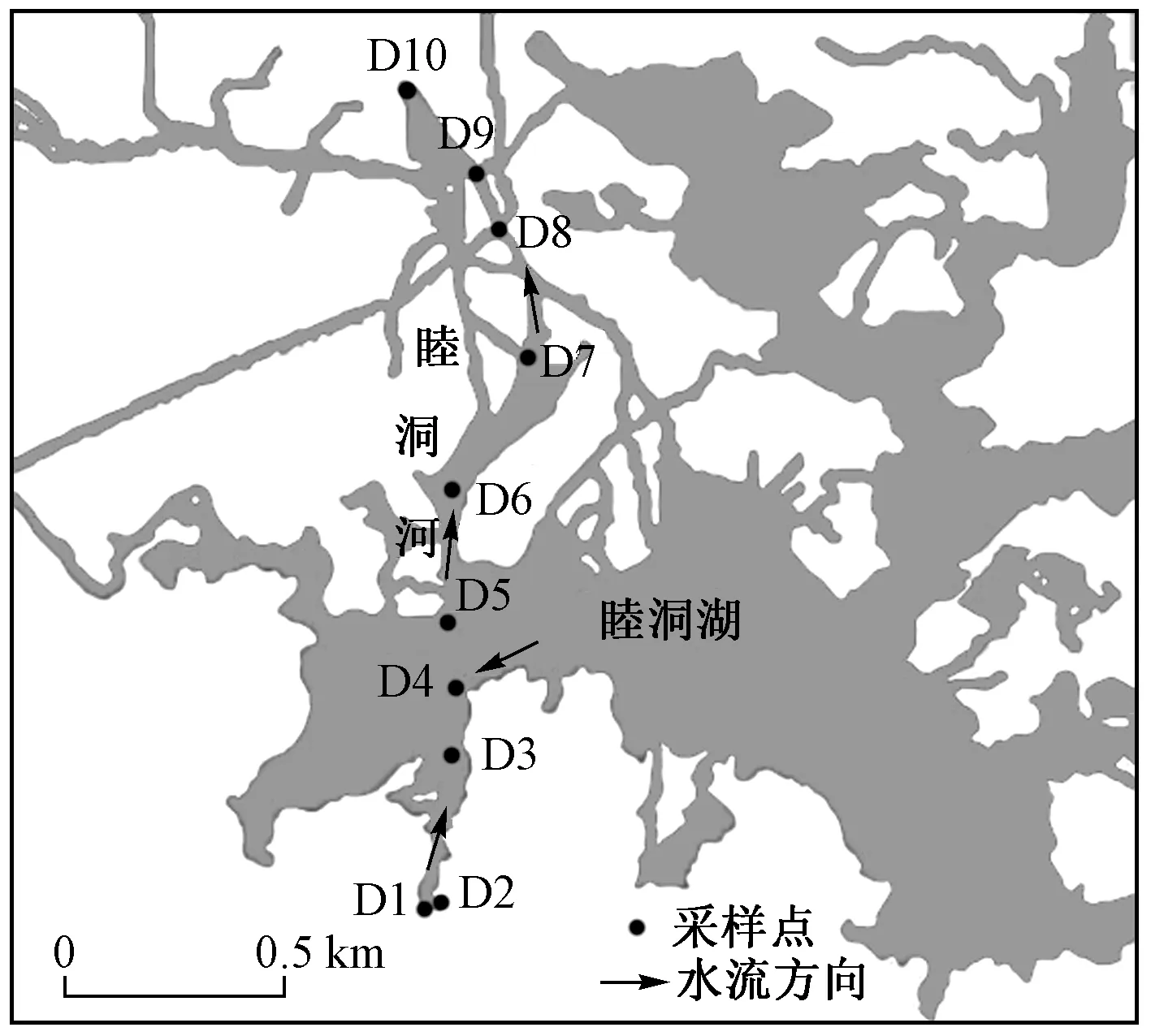
注: D1—七星码头生活污水排污口; D2—七星码头设置浮岛处; D3—三义大桥;注: D4—睦洞河、睦洞湖交汇处; D5—睦洞河禽类散养点; D6—睦洞河中段;D7—睦洞河第三个河道交汇处;D8—睦洞河稻田灌溉水源地;D9—睦洞河稻田;D10—睦洞河水生植被修复区.
2017年10月于桂林会仙喀斯特国家湿地公园采集沉积物及水体样品,采集区域为桂柳古运河沿程睦洞河七星码头至水生植被修复区段,该段位于桂林市西侧的会仙岩溶湿地(25°01′30″N~25°11′15″N、110°08′15″E~110°18′00″E,总面积约120 km2[9])中心区域,属于亚热带季风湿润气候,年均气温约18.8 ℃,降水充沛,年均降水量达 1 894.4 mm,流域内植物群落以芦苇、华克拉莎等挺水植物和苦草、黑藻等沉水植物为主,多样性较低,单优势种群落较多. 沿岸聚集众多村庄,生活污水排放量大,也存在大片鱼塘、禽类养殖点和农田,同时也是目前会仙岩溶湿地的主要景区,因而受人为影响干扰较大,所以在该段选取采样点具有一定代表性,采样点按照水流方向共设置10个(见图1):①生活区码头采样点D1~D3;②河区采样点D4~D6;③河道交汇处采样点D7~D10. 沉积物样品采用直径6 cm的有机玻璃采集器采集,采集深度为0~10 cm,采用五点法采集5个平行样点的沉积物并进行混合,以四分法收集样品约500 g于4 ℃下保存,并重复上述操作于定点周围50 m范围内采集3个重复样,运回实验室. 在去除样品中的植物、动物、石块等杂质并混合均匀后,一部分于-80 ℃下保存,用于DNA提取、细菌群落结构分析、细菌群落多样性及差异性分析,另一部分于4 ℃下保存,用于化学指标测试. 其中细菌群落结构组成分析时将3个重复样混合后进行测序,其余均检测3个重复样. 水体样品采用500 mL硬质玻璃瓶采集,采集深度为水面以下10~50 cm,同样重复操作采集3个重复样,运回实验室后于4 ℃下保存,用于化学指标测试.
沉积物中w(TN)根据HJ 717—2014《土壤质量 全氮的测定 凯式法》测定;w(TP)根据HJ 632—2011《土壤总磷的测定 碱熔-钼锑抗分光光度法》测定. 水体中ρ(TN)根据HJ 636—2012《水质总氮的测定 碱性过硫酸钾消解紫外分光光度法》测定;ρ(NO3--N)、ρ(NO2--N)、ρ(SO42-)采用美国戴安公司的ICS-1000型离子色谱仪测定;ρ(NH4+-N)根据HJ 535—2009《水质氨氮的测定 纳氏试剂分光光度法》测定;ρ(TP)根据GB 11893—1989《水质总磷的测定 钼酸铵分光光度法》测定;pH采用便携式pH计于采样点现场测定. 使用SPSS v19.0软件对水体与沉积物指标采用Duncan′s multiple range test方法进行多组样本间差异显著性分析,检测水平为0.05.
1.2 基因组DNA的提取和PCR扩增及纯化
采用CTAB方法对沉积物样品的基因组DNA进行提取,并采用琼脂糖凝胶电泳法检测其纯度和浓度,使用无菌水稀释至1 ngμL. 以稀释后的基因组DNA为模板,使用带Barcode的特异引物(515 F和806 R)以及高效高保真酶进行PCR扩增. PCR反应体系(30 μL):15 μL Phusion Master Mix(2×)、3 μL Primer(2 μmolL)、10 μL gDNA(1 ngμL)和2 μL H2O. 扩增的反应程序:①98 ℃预变性1 min;②30个循环(98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸30 s);③72 ℃延伸5 min. 使用2%的琼脂糖凝胶电泳检测扩增产物.
1.3 沉积物细菌16S rDNA基因测序
TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒构建文库后,使用HiSeq2500 PE250进行上机测序;将下机数据截去Barcode和引物序列后用FLASH(V1.2.7)[13]对每个样品的Reads进行拼接和过滤[14];对得到的Tags序列通过UCHIME Algorithm与数据库Gold database进行比对检测,并最终去除其中的嵌合体序列[15],得到有效数据(Effective Tags). 整个测序过程在北京诺禾致源科技股份有限公司的Illumina HiSeq平台上进行.
1.4 OTU聚类和物种注释
利用Uparse(v7.0.1001)软件[16]以97%相似性将有效序列聚类成OTU(Operational Taxonomic Unit,可操作分类单元),采用Mothur方法(阈值0.8~1.0)与SSUrRNA数据库[17]进行物种注释分析,获得物种分类学信息并统计样本群落组成. 然后使用MUSCLE(Version 3.8.31)软件[18]进行快速多序列比对并对各样品数据进行均一化处理. 门水平上细菌相对丰度(排名前10位)采用柱状堆积图形式予以展示;属水平上则依据物种注释和丰度信息,选取丰度排名前30位的属以聚类热图的形式表现.
1.5 样品复杂度分析
样品复杂度分析(Alpha Diversity)是用来研究样品内微生物群落的多样性,使用Qiime软件计算Alpha多样性指数,使用R软件进行稀释曲线的绘制,采用Tukey检验和Agricolae包的Wilcox进行检验. 并对指数组间差异使用SPSS v19.0软件的Duncan′s multiple range test方法进行分析,检测水平为0.05.
1.6 多样品比较分析
多样品比较分析(Beta Diversity)是用来对不同样品的微生物群落构成进行比较:①将相同分类的OTU信息合并处理得到物种丰度信息表,使用Qiime软件计算Unifrac距离. ②利用OTU的丰度信息对Unifrac距离进一步计算Weighted Unifrac距离. ③通过主成分分析方法(PCA,Principal Component Analysis)来比较不同样品间的差异,同样采用Tukey检验和Agricolae包的Wilcox进行检验;并对各组样品间进行Anosim非参数检验,用来检验组间与组内差异的显著关系.
1.7 环境因子相关性分析
对物种数据矩阵作除趋势对应分析(Detrended Correspondence Analysis,DCA),得到的梯度值小于3.0,因而该研究采用冗余分析(RDA)方法来反映菌群与环境因子间的关系. 该方法使用R软件的Vegan包进行分析. 在得到的冗余分析结果中,各环境因子用箭头表示,长度越长,代表其与群落分布的相关性越大,反之越小;两个环境因子间的夹角小于90°时,说明它们之间呈正相关,反之则呈负相关.
2 结果与讨论
2.1 沉积物及水质化学指标
由表1可见,会仙岩溶湿地各采样点的化学指标均沿水流方向逐渐降低,至采样点D10处又升高. 水质指标ρ(TN)、ρ(NO2--N)、ρ(NH4+-N)、ρ(SO42-)的最大值均出现在采样点D2,ρ(TP)、ρ(NO3--N)都在采样点D1达到最大值. 同时,单因素方差分析(ANOVA)显示,各项指标的显著性水平值均为0,显著性水平很高,其中,采样点D1与D2各项水质指标(除pH外)均显著高于其他采样点. 而与其相反的是,沉积物中w(TN)、w(TP)却在采样点D10达到最大值且均显著高于其他采样点,即采样点D1、D2、D10与其他采样点相比存在显著性差异. 从整体趋势来说,各指标的变化均符合水体自净的规律[19],采样点D10水质指标升高且沉积物指标均达到最大值的原因是,该点原为禽类养殖区,无害化及资源化处理的落后导致鸭子的排泄物直排入河,营养盐随之进入沉积物,其中部分污染物向水中流失,导致环境污染;当地政府将其拆除后建设了水生植被修复区,通过种植挺水植物(芦苇、美人蕉)、浮水植物(凤眼莲)以及沉水植物(苦草、黑藻)来修复附近的环境,这些植物通过根系形成浓密的过滤层以截留和吸附水中的胶体和大颗粒污染物,长时间作用后根系表面的污染物会逐渐沉降,根系部分附着的菌团在内源呼吸时凝聚产生的菌胶团也会将部分悬浮于水体中有机物和自身代谢产物一并沉降至沉积物中[20];再加上维护不足,植物死亡沉降到水底后腐烂,造成水体中的污染物经植物转移至沉积物中. 同时,采样点D1和D2的指标明显高于其他采样点,主要是因为,这两个采样点处于居民区,生活污水由此处直接排放到湿地内. 纵观所有采样点,人为因素产生的水体氮磷污染较严重,在岩溶区地下水互通作用下会逐渐污染整个地下水环境[21],从而破坏生态结构并影响农业与民用饮用水水源质量.
2.2 细菌群落结构组成分布

表1 会仙岩溶湿地各采样点水质及沉积物化学指标
注: ND表示未检出. 采用Duncan′s multiple range test方法分析,同一列无相同字母表示显著性差异(P<0.05).
对97%相似性的OTU代表序列进行聚类分析,结果表明,沉积物样品具有非常高的细菌多样性,其中5 952个OTU包含70个门、150个纲、195个目、325个科、446个属. 图2为门水平上的物种相对丰度,笔者选取排名前10位的物种予以展示,其余物种合并成其他类别(others). 由图2可以看出,相对丰度较高的分别是变形菌门(Proteobacteria,33.63%)、绿弯菌门(Chloroflexi,24.29%)、酸杆菌门(Acidobacteria,7.59%)、放线菌门(Actinobacteria,2.34%)、硝化螺旋菌门(Nitrospirae,4.10%)、厚壁菌门(Firmicutes,2.56%)、浮霉菌门(Planctomycetes,3.46%)、拟杆菌门(Bacteroidetes,1.86%)、细菌门(Aminicenantes,2.41%)和广古菌门(Euryarchaeota,1.21%).
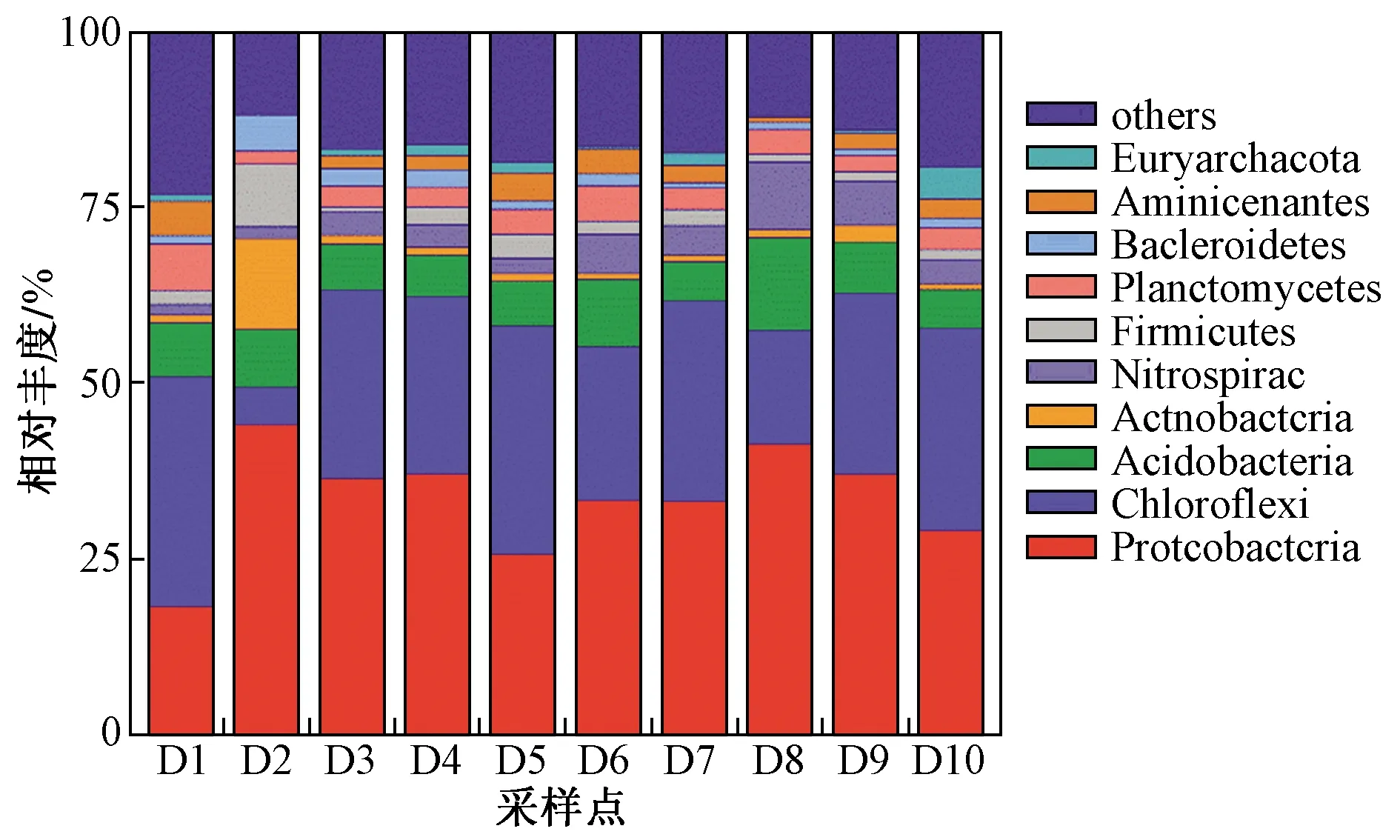
图2 会仙岩溶湿地沉积物样品细菌门水平相对丰度Fig.2 Relative abundances of bacterial phyla in sediment samples in Huixian karst wetland
其中,变形菌门是会仙岩溶湿地沉积物的优势类群,在D1~D10这10个样品中相对丰度依次为18.33%、44.16%、36.58%、37.14%、25.78%、33.46%、33.22%、41.42%、37.09%、29.14%. 这与隋心等[12,22]的研究结果一致. 研究表明,变形菌门作为细菌中的主要部分[23],普遍存在于水环境沉积物中,在众多人工湿地废水处理工艺中发挥主导作用[24]. 黄媛等[25]发现,β-变形菌纲(Betaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)及δ-变形菌纲(Deltaproteobacteria)是变形菌门中的优势类群,参与去除多种污染物,包括硫化物、有机物的降解和氮素的转化[26]. 笔者同样获得了相似结论,会仙岩溶湿地沉积物样品中变形菌门主要包括β-变形菌纲(6.3%)、γ-变形菌纲(5.7%)和δ-变形菌纲(19.6%),其中还存在α-变形菌纲(Alphaproteobacteria,2.56%). β-变形菌纲中的亚硝化单胞菌属(Nitrosomonas)主导了硝化作用的第一阶段(亚硝化阶段),促进NH4+-N氧化成NO2--N,限制了CO2的固定[27];含量最多的δ-变形菌纲中有些细菌可以其他细菌为食,促进湿地中的氮、磷、硫与有机质的循环[7].
由图2还可发现,绿弯菌门的相对丰度也较高,为第二大类群,在D1~D10样品中所占比例依次为32.56%、5.27%、26.73%、25.16%、32.35%、21.75%、28.53%、16.12%、25.70%、28.74%,这与杭州西溪湿地细菌群落结构[25]相似. 绿弯菌门细菌通常出现在水处理工艺中,它可以进行光合作用但不产生氧气[28],与拟杆菌门类群中的微生物参与一系列有机化合物的降解[29]. 浮霉菌门中部分细菌可以在缺氧环境下利用NO2--N将NH4+-N氧化成N2,被称之为厌氧氨氧化细菌,对全球氮循环有重要意义,是污水处理中一种非常重要的细菌[30]. 硝化螺旋菌门中的硝化细菌可将NO2--N氧化成NO3--N,在水环境中同样参与氮循环,对水生植物具有重要意义. 研究[31]表明,放线菌门可以产生多种抗生素和酶,对水环境有一定的消毒作用.
此外,沉积物中细菌门类的相对丰度也存在一定的变化规律. 其中,变形菌门的相对丰度在各采样点(除D1外)分布均匀,并于采样点D2处达到最大值(44.16%),而在D1处出现明显差异,为最小值(18.34%). 作为细菌中最大类群的变形菌门,其大部分成员生存于厌氧环境,含量最多的δ-变形菌纲存在严格厌氧的细菌. 比较所有采样点可以发现,采样点D1处为生活污水排放管道,水流湍急,村民还在此处填放沙袋,造成水位差从而形成跌水曝气,促使沉积物表层重构,增加了深层沉积物的含氧量,而其余各采样点虽有流速差异,但不足以对沉积物造成明显扰动,因此变形菌门在采样点D1处的相对丰度明显偏低. 与之相反,绿弯菌门相对丰度最小值(5.27%)出现在采样点D2处,与其他采样点形成明显差异,这是因为光照能够促进绿弯菌门的生长[32],而采样点D2处因覆盖了大面积浮岛导致沉积物受到的光照较少. 酸杆菌门的相对丰度整体偏低,各采样点之间差异不明显,最大值(13.18%)出现在采样点D8处,最小值(5.48%)出现在采样点D10处. 酸杆菌门最开始是在酸性地质环境中被发现并因此命名[33],但这并不表示该菌门只能在酸性环境中生存. 近年来有研究[34]发现,中性甚至碱性环境中也能检测出一些酸杆菌的基因序列,这与笔者试验结果相同. 由于会仙岩溶湿地是喀斯特地貌,水化学类型主要为HCO3-Ca型,其环境主要呈中性或弱碱性(见表1),所以酸杆菌门相对丰度低于鄱阳湖典型湿地[7]等其他类型湿地. 为了进一步了解属水平上物种的聚集程度或含量高低,依据其物种注释和丰度信息,从所有样品中选取丰度排名处于前30位的属,并根据其在每个样品中的丰度信息,对物种进行聚类,结果如图3所示.

注: 横向展示的是物种注释信息,右侧是菌属,左侧是对应的菌门. 纵向则是样品信息,左侧的聚类树是物种聚类树. 图中对应的值是通过标准化处理每一行的物种相对丰度后得到的Z值(标准分数,即样品在该分类上的相对丰度和所有样品在该分类的平均相对丰度的差除以所有样品在该分类上的标准差,代表原始数值和总体均值之间的距离. 在原始数值低于平均值时Z则为负数,反之则为正数).
结合图2、3可以看出,在属水平上,所有样品均有分布的是H16属(1.46%)、硫杆菌属(Thiobacillus,0.55%)、unidentified_Chloroplast属(0.35%)、芽孢杆菌属(Bacillus,0.33%)、葡萄球菌属(Staphylococcus,0.23%)、RB41属(0.15%)和溶杆菌属(Lysobacter,0.13%). 从整体上来看,相对丰度较高的菌属为H16属(1.46%)、螺旋体属(Spirochaeta_2,0.89%)、脱硫酸盐橡菌属(Desulfatiglans,0.76%)、厌氧粘细菌属(Anaeromyxobacter,0.75%)、地杆菌属(Geobacter,0.64%)、脱硫杆菌属(Desulfobacca,0.61%)和寡养单胞菌属(Stenotrophomonas,0.60%). 同时,部分菌属只出现在特定样品中,如采样点D2特有的菌属为Fusibacter属;还有许多菌属虽在几个样品中均有出现,但是含量极低,只在某特定样品中有少量呈现,如丙酸杆菌属、弧菌属(Vibrio)、蓝细菌属(Leptolyngbya)、拟杆菌属(Bacteroides)主要分布于采样点D2中. 此外,在这一水平上还存在未培养(Uncultured)以及未分类(Unclassified)的细菌类群,相对丰度分别为0.47%~1.46%和37.85%~84.67%,其中未分类菌属相对丰度明显高于杭州西溪湿地[25]、新疆艾比湖湿地[35],说明会仙岩溶湿地相比其他类型湿地而言存在更多潜在的新菌种.
不同采样点的菌属具有不同的相对丰度,但除采样点D2的菌属出现明显差异外,其余各采样点均较相似. 可能是因为,采样点D2距离码头生活污水排放口较近,水中各污染物含量较高,桂林市临桂区会仙湿地公园管理局为此设置了美人蕉、铜钱草等浮岛,旨在通过植物自身的截留和吸附作用来净化从码头排入湿地的生活污水. 但与采样点D10不同,采样点D2处于景区码头且浮岛的设置便于管理,因而湿地管理局会定期更换浮岛植物并进行清淤以达到原位去除污染物的目的,但是清淤不当也会使底泥扩散,不利于水生生物种群的恢复与建立[36],这样也就造成了采样点D2处沉积物不稳定,进而产生其区别于其他各采样点的现象. 采样点D1的优势菌属是螺旋体属(3.10%);采样点D2的优势菌属是寡养单胞菌属(6.00%);采样点D3和D10的优势菌属是脱硫酸盐橡菌属,相对丰度分别为1.30%和1.23%;采样点D4、D7、D8和D9的优势菌属是H16属,相对丰度分别为1.16%、1.39%、4.90%和2.43%;采样点D5的优势菌属是Kroppenstedtia属(0.91%);采样点D6的优势菌属是嗜热厌氧杆菌属(1.40%). 由此可见,人为因素对于微生物群落结构的影响很大,伴随着高浓度外来污染物的汇入以及生态环境的改变,微生物群落结构也明显发生改变,因此,研究沉积物细菌多样性对保护湿地生态系统具有重要意义[32].
2.3 细菌群落多样性分析
利用高通量测序技术筛去较差及较短的序列后,样品共得到 739 903 条序列,去除嵌合体后得到有效序列共 711 403 条,平均长度为372.34 bp. 在97%相似性下将得到的序列聚类成OTU,并统计各沉积物样品中的物种丰富度和多样性信息(见表2). Shannon-Wiener指数和Simpson指数属于多样性指数,数值越高,对应的群落多样性越高;Chao1指数和ACE指数属于丰富度指数,与OTU数一样用来说明物种总数,其数值越高,代表物种数越多. 通过单因素方差分析(ANOVA)可以看出,D2的OTU数、丰富度和多样性指数显著低于其他各采样点(P<0.05). 同时,除采样点D2外,其他采样点的各项指标数值都较大且差别不大,因而各样品间的群落结构均较相似. 其中,D3样品的多样性最高,D6样品的丰富度最高,D5样品则相对于整体而言其多样性和丰富度均较低,D2样品的多样性和丰富度最低. 采样点D3和D6是睦洞河段水域较为宽阔的两个点,阳光直射没有遮挡,水流缓慢,水质良好,相比之下,采样点D5聚集农户散养的鸭禽,因而水体浑浊. 采样点D2位于七星码头用来处理生活污水的浮岛池塘,水域范围小,各种污染物含量高(见表1). 通过分析地势环境可以发现,微生物物种的多样性和丰富度情况在很大程度上取决于环境污染情况,即微生物所处环境的稳定性,多变的环境造就了不同的物种多样性及丰富度,这与李勇等[37]的研究结果一致.
通过从样本中随机抽取一定量满足测序量的序列,统计其对应的物种数,并以此来绘制稀释曲线(见图4). 由图4可见,10个沉积物样品的稀释曲线均趋向平坦,接近饱和,增加数据量只会发现少量的新物种,表明此次测序的深度较为合理,能够反映沉积物微生物结构和多样性的真实情况,这与表2中用于揭示测序深度的Goods coverage值较高相一致.
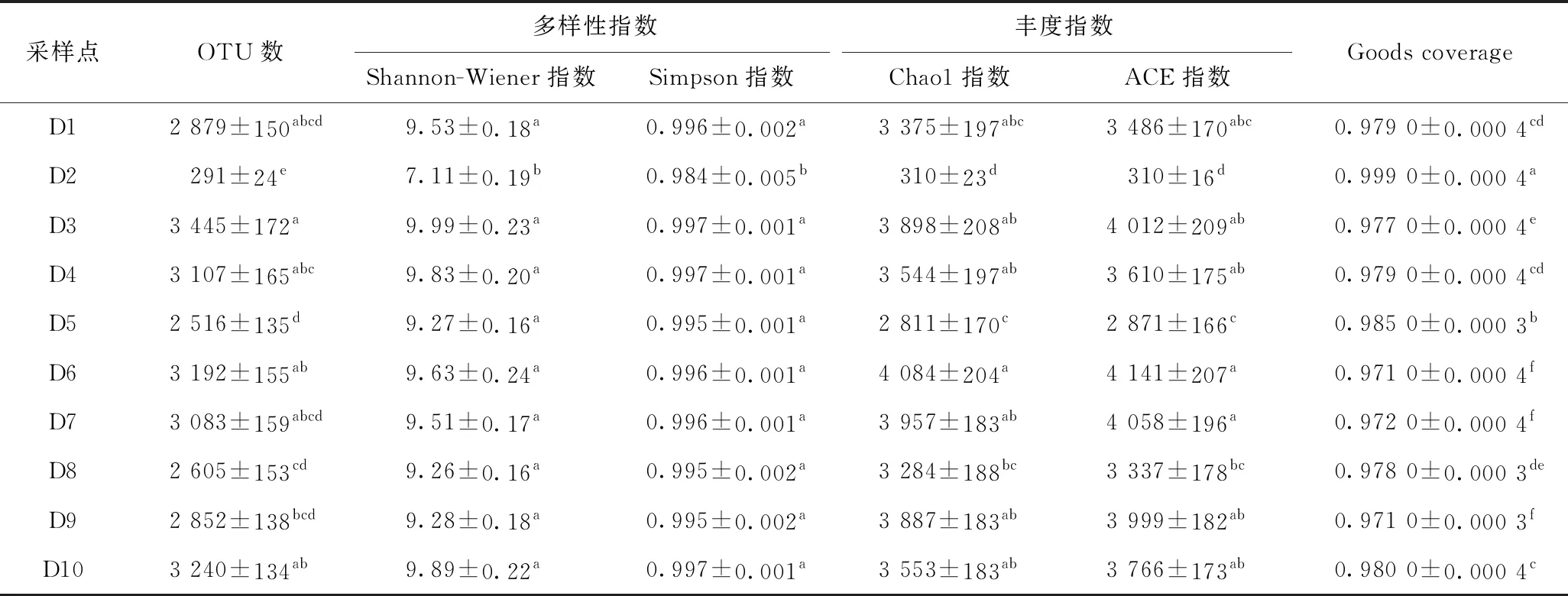
表2 沉积物样品细菌群落丰度和多样性指数
注: 采用Duncan′s multiple range test方法分析,同一列无相同字母表示显著性差异(P<0.05).
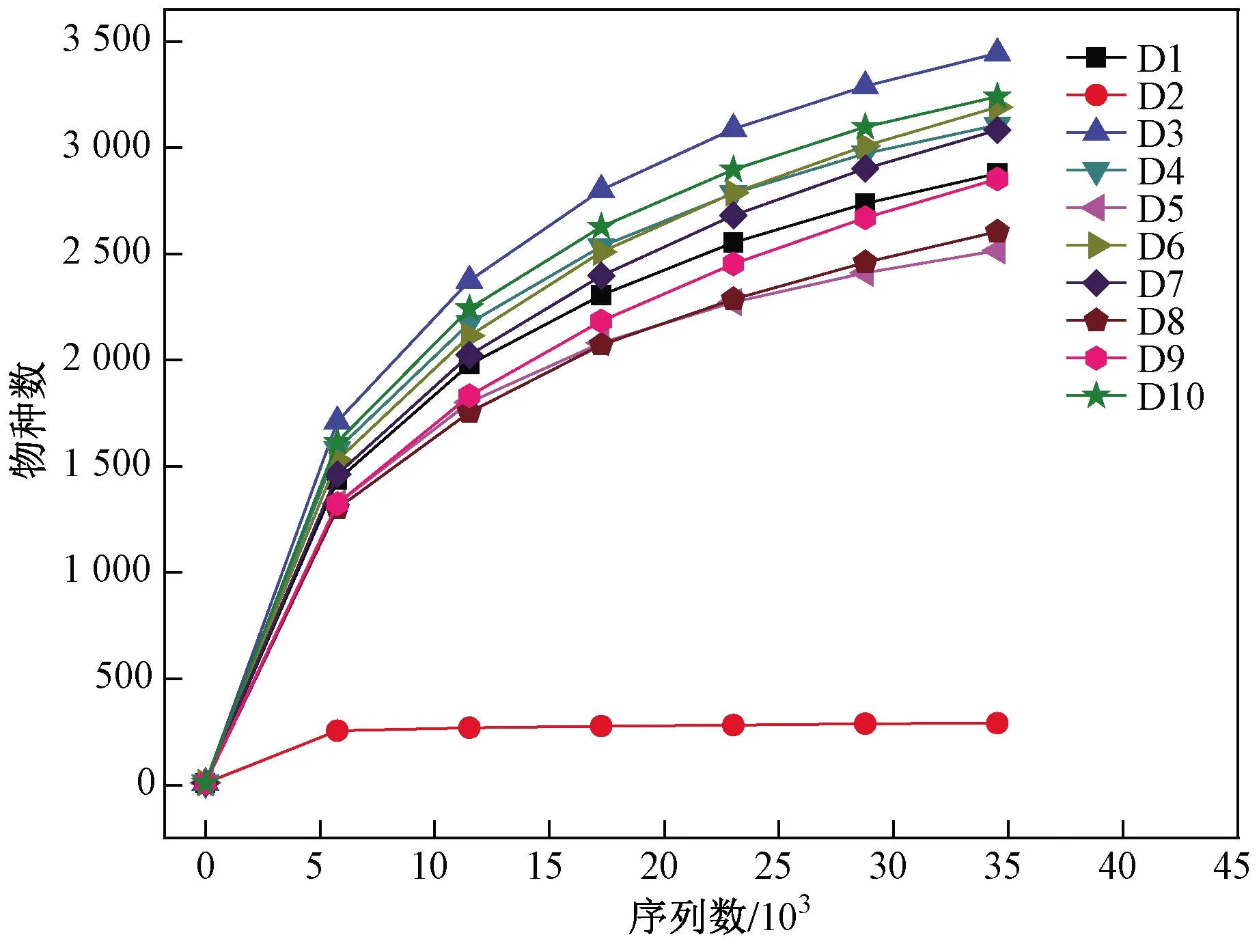
图4 沉积物样品稀释曲线Fig.4 Rarefaction curve in sediment samples

图5 沉积物样品PCA分析Fig.5 Principal component analysis of sediment samples
2.4 细菌群落差异性分析
对会仙岩溶湿地采集的沉积物样品中的OTU组成进行主成分分析,结果(见图5)显示,第一主轴(PC1)和第二主轴(PC2)的贡献率分别为19.30%和15.95%. 由图5可见,D3、D4、D5、D6、D7、D9、D10样品相互之间的距离都很近,说明这7个采样点沉积物的OTU组成较相近;另外,D1、D2、D8与这7个采样点沉积物中OTU的组成也很接近,但相较而言还是存在一定差异. 究其原因:主要是D1、D2、D8存在明显的外源性污染输入或人为干扰,其中采样点D8因建有一抽水泵站导致了水体浑浊. 这也验证了2.2节所述的采样点D1、D2的人为因素导致环境不稳定,从而影响了沉积物中细菌群落的稳定性,进而产生了相应差异. 进一步采用Anosim方法进行组间群落结构差异显著性分析,结果表明,各采样点组间差异大于组内差异(R>0),并且,将D1、D2、D8这3个采样点与其他7个采样点分别进行对比发现,其细菌群落结构均差异显著(P<0.05),其余7个采样点的细菌群落间无显著差异(P>0.05). 综上,整体而言,会仙岩溶湿地睦洞河区域各采样点的细菌群落结构相似度较高.

图6 细菌门分类群落水质和沉积物化学指标的冗余分析Fig.6 Redundancy analysis of bacterial phyla and chemical parameters of water and sediments
2.5 细菌群落与化学指标的关系
会仙岩溶湿地沉积物细菌门水平群落与化学指标的冗余分析(RDA)结果如图6所示. 第一主轴(RDA1)与第二主轴(RDA2)对细菌群落相对丰度方差的解释率分别为36.92%和18.41%,二者共可解释55.33%的方差变化. 第一主轴上的主要影响因子是水质指标ρ(NO3--N)与ρ(NO2--N),其相关系数分别为-0.38和0.72;第二主轴上水质指标ρ(NO3--N)、ρ(TP)和ρ(TN)是主要影响因子,相关系数分别为-0.88、-0.84 和-0.84. 综上,与会仙岩溶湿地细菌群落相关性较大的指标是ρ(NO3--N)、ρ(NO2--N)、ρ(TP)和ρ(TN). 其中,ρ(TP) 与ρ(NH4+-N)、ρ(NO2--N)均有着较强的正相关性.ρ(NO3--N)、ρ(NO2--N)、ρ(TP)、ρ(TN)与放线菌门、酸杆菌门、厚壁菌门、拟杆菌门相对丰度均呈正相关,与绿弯菌门相对丰度均呈负相关;土壤中w(TP)、w(TN)与水体中ρ(NO3--N)、ρ(SO42-)均呈较强负相关,与硝化螺旋菌门、变形菌门相对丰度均呈正相关,与浮霉菌门、细菌门相对丰度均呈负相关,这与王鹏等[7]的研究结果相似. 将10个采样点按照主要贡献指标的种类大致可以分成3类:采样点D1、D5主要受ρ(NO3--N)、pH和ρ(SO42-)的影响;采样点D2、D8主要受ρ(NO2--N)、ρ(NH4+-N)、ρ(TN)、ρ(TP)的影响;而其余采样点则主要受w(TN)、w(TP)的影响. 对比各采样点可以发现,正如2.2节和2.4节所提到的,采样点D1、D2、D5、D8处水体受到人为干扰较大,因而受水质指标的影响比较明显. 这说明人为干扰会仙岩溶湿地水质对于沉积物中的细菌群落结构及多样性的影响较大,所以目前湿地周围存在的大量破坏湿地水质的行为(如圈养家禽、生活污水不经处理直接排放等)都会影响湿地的生态过程,造成生态功能的衰退,水质污染一旦超过水体的自净能力,植物的生长就会受限甚至停止并消失,鱼类数量会减少,进而直接影响微生物群落的多样性和丰度,使微生物群落逐渐单一化.
3 结论
a) 对会仙岩溶湿地10份沉积物样品的高通量测序得到平均长度为372.34 bp的有效序列共 711 403 条,聚类产生 5 952 个OTU,包含2个界、70个门、150个纲、195个目、325个科、446个属,样品中同时存在大量未分类和未培养的细菌,沉积物细菌群落结构多样性和丰度都很大.
b) 会仙岩溶湿地相对丰度较高的门依次为变形菌门(Proteobacteria,33.63%)、绿弯菌门(Chloroflexi,24.29%)、酸杆菌门(Acidobacteria,7.59%)、硝化螺旋菌门(Nitrospirae,4.10%)、浮霉菌门(Planctomycetes,3.46%). 在属水平上,相对丰度最高且在所有样品中均有分布的是H16属.
c) 在水质及沉积物化学指标中,七星码头生活污水排污口(D1)、七星码头设置浮岛处(D2)、睦洞河水生植被修复区(D10)与其他各采点相比存在显著性差异,其中与会仙岩溶湿地细菌群落相关性较大的是水质指标ρ(NO3--N)、ρ(NO2--N)、ρ(TP)和ρ(TN).
d) 人为因素对会仙岩溶湿地微生物群落结构的影响较为显著,由此导致微生物多样性和丰度降低,使其趋于单一化. 今后应推行绿色生产,停止湿地内养殖,恢复植被,严禁污水乱排并加设水质监测以保护湿地.

