盐场海芽孢杆菌与大洋铁锰结核相互作用
吕 靖 , 蓝 鑫, 姜明玉 曹文瑞 萨仁高娃 于心科 常凤鸣
(1. 中国科学院海洋研究所 海洋地质与环境重点实验室, 山东 青岛 266071; 2. 中国科学院海洋大科学研究中心, 山东 青岛 266071; 3. 中国科学院大学, 北京 100049; 4. 哥伦比亚大学傅氏基金工程和应用科学学院, 美国 纽约 10027)
大洋铁锰结核富含铁、锰、铜、钴和镍等多种金属元素, 是一种水下固体矿产资源, 广泛分布在世界各大洋底部, 亦称之为多金属结核、锰团块、锰矿球和锰瘤等[1]。铁锰结核中的主要矿物是水羟锰矿和非晶态的水羟铁矿, 钴、镍、铜等金属元素主要赋存在锰氧化物中[2]。大洋铁锰结核具有较高的经济价值, 根据Mero估计铁锰结核储量约超过3万亿吨, 太平洋的克拉里昂和克里伯顿断裂带之间的区域是最具有开采价值的富矿区, 铁锰结核远景储量达150亿吨[3]。
对于铁锰结核的成因, 至今仍未取得比较一致的看法。早期的观念认为, 铁锰结核是由氧化作用和胶体化学作用使Mn和Fe等元素从底层水和沉积物间隙水中积聚形成, 在最低含氧层下方, 先形成的铁锰水合氧化物胶体从水中吸附钴、镍等微量金属元素, 然后在基岩上不断积累进而形成铁锰结核。该机制得到了胶体化学的实验证明, 同时还得到微量元素、稀土元素、结构构造以及微体化石的佐证[4]。铁锰结核的物质成分是多源的, 可因成矿物质的来源划分为上覆海水来源的水成型、沉积物间隙水来源的成岩型和海底热液喷发物质来源的热液型等成因类型[5]。有研究认为铁锰结核的形成中起主导作用的应为生物源物质, 海洋中大量的微生物能够促进许多化学变化与成岩作用, 而浮游生物是Cu、Ni、Co等微量元素的有效载体, 有利于铁锰结核的生长和富集[6]。有孔虫、放射虫、硅藻等生物吸附海水中的金属元素, 当这些有机体的残骸下沉时也将这些元素带到海底, 其体内吸附的多种金属元素释放出来, 对铁锰结核形成能起到重要的作用。随后一些学者认为微生物在铁锰结核的形成过程中可能起着重要的作用, 因此大致形成了两种观点: 其一是微生物成因观点, 即认为在微生物群的作用下形成了铁锰结核; 其二是化学成因观点, 认为是海底(局部)富多金属的热液或富多金属的流体沉淀形成。还有一些学者提出了生物与生物-化学二元形成机制[7]。
近年来的研究趋势开始重视微生物的生命活动在铁锰结核形成中的作用, 微生物与矿物具有相辅相成的作用, 矿物能够为微生物提供代谢活动所需的电子受体及能源、微营养, 微生物参与金属元素的迁移、转化、富集与成矿, 能通过生命代谢活动将岩石矿物中的重金属富集成矿[8]。微生物对几乎所有类型的岩石和矿物都有破坏分解作用, 可以通过产生有机酸、胞外多聚物、铁载体等多种方式来溶蚀矿物, 进而释放出K、Si、Fe和Mg等矿质元素[9], 例如Bacillus类细菌在生长过程中可以从长石等矿物中释放出Na、K、Ca、Si等元素[10]。微生物的细胞壁能够为矿物的沉淀提供成核位置[11], 本研究组前期的研究工作阐明了在较长时间的吸附过程中, 水溶液中溶解的金属元素可以被吸附到微生物表面并富集形成金属矿物[12-15]。微生物具备富集金属元素并形成矿物的能力, 因此研究海洋微生物对铁锰结核的作用对于了解铁锰结核的生物成因极为重要。通过分析对比前期从多个不同区域海洋沉积物样品中分离培养的微生物, 选取分离自东海大陆架沉积物的盐场海芽孢杆菌(Marinibacillus campisalis)为试验菌株。盐场海芽孢杆菌(Marinibacillus campisalis)在海洋中广泛存在且易于培养, 此种属细菌在海洋沉积物样品的微生物群落结构中所占比例较大。本文从该菌种入手, 考察普通的海洋细菌和铁锰结核的相互作用效果, 研究海洋微生物对大洋铁锰结核中Fe、Mn、Co、Ni、Cu元素的释放以及对铁锰结核矿物组成的影响, 以期为深入理解微生物与铁锰结核相互作用过程及铁锰结核生物成因等提供科学依据。
1 材料与方法
1.1 实验材料
实验用盐场海芽孢杆菌(Marinibacillus campisalis)由本研究组分离自东海大陆架沉积物的表层样品(表层1 cm, 水深81.13 m), 菌株16s RNA 基因序列(GenBank No: KP307823)与其亲缘菌株Marinibacillus campisalis strain C0010的16s RNA 基因序列(GenBank No: GU947875)相似性为99.2%。Marinibacillus campisalis是革兰氏阳性杆菌, 大小约1.5~ 3.0 μm, 生长温度在4℃~39℃[16]。将冻存于–80℃冰箱中的菌种接种到培养基中, 活化后摇床120 r/min、25℃培养1天。选用培养基组成为: 人工海水(24.32 g/L NaCl, 10.98 g/L MgCl2·6H2O, 4.06 g/L Na2SO4, 0.20 g/L NaHCO3, 0.027 g/L H3BO3, 0.10 g/L KBr, 0.69 g/L KCl, 1.14 g/L CaCl2)加入5 g/L蛋白胨, 1 g/L酵母提取物, pH调节至7.25。
实验用铁锰结核样品大小约在3厘米左右, 外表呈黑色圆球状、瘤状, 剖面特点为外层黑色壳体包裹内部沉积物(图1)。样品于2014年“科学号”考察船采自西太平洋东菲律宾海, 水深约4 092 m。剥离铁锰结核样品外层黑色部分, 用玛瑙研钵研磨, 选取65目的样品粉末, 水洗后60℃烘干, 并在121℃下灭菌30 min备用。
考虑到对后续元素测定的影响, 反应体系采用人工海水(24.32 g/L NaCl, 10.98 g/L MgCl2·6H2O, 4.06 g/L Na2SO4, 0.20 g/L NaHCO3, 0.027 g/L H3BO3, 0.10 g/L KBr, 0.69 g/L KCl, 1.14 g/L CaCl2), pH调节至8.32。

图1 铁锰结核形貌 Fig. 1 Morphological features of the ferromanganese nodules
1.2 实验方法
采用500 mL锥形瓶, 每瓶加入350 mL人工海水, 在121℃下灭菌30 min备用。离心管收集预先培养好的细菌(4 000 r/min离心10 min), 用灭菌后的0.1 mol/L NaCl溶液水洗3次后加入灭菌的人工海水中, 测定反应体系的菌密度, 加入菌液的设为有菌组, 同时未加入菌液的设为无菌组。随后在无菌操作台中向有菌组和无菌组中分别加入3 g事先处理好的铁锰结核粉末, 在摇床120 r/min、25℃条件下培养21天。反应过程中在不同的时间点间隔取样, 测定反应体系中离子浓度变化和pH值变化, 并观察不同时间微生物表面矿物形成情况, 测定铁锰结核和Marinibacillus campisalis相互作用21天后铁锰结核矿物组成的变化。
1.3 测试方法
采用UV-5500PC型分光光度计测定Marinibacillus campisalis的OD600, 绘制生长曲线。通过X射线荧光光谱(X-ray Fluorescence, XRF)分析(德国布鲁克公司SB Tiger波长型)测定铁锰结核样品的主要元素组成。
反应过程中在不同时间点间隔取样, 用移液枪吸取液体, 离心后收集上清液, 通过0.22 μm聚四氟乙烯滤膜过滤, 采用电感耦合等离子体发射光谱(Inductively Coupled Plasma Optical Emission Spectrometer, ICP-OES, PerkinElmer公司, Optima 7300DV)和电感耦合等离子体质谱(Inductively coupled plasma mass spectrometry, ICP-MS, Thermo Fisher公司, ICAP- QC)测定反应体系中的Fe、Mn、Co、Ni、Cu等总离子浓度。对每个样品进行了三次重复测定, Fe、Mn、Co、Ni、Cu离子浓度测定的相对标准偏差分别约为3%、1%、1%、2%、2%。由于Fe、Mn、Co、Ni、Cu是铁锰结核外层壳体成分中最主要的几种元素, 因此, 可以通过分析溶出离子浓度的变化, 探讨Marinibacillus campisalis在大洋铁锰结核形成或分解过程中的作用。
采用透射电镜(Transmission Electron Microscope, TEM, Hitachi公司, HT7700)观察未加入结核粉末时的菌体形态, 观察加入结核粉末反应1天后和4天后微生物表面的矿物形成情况。取培养液4 000 r/min离心10min后去除上清液, 用超纯水反复清洗菌液3遍后, 吸取少量菌液滴到铜网上, 待干燥后采用透射电镜进行观察。
采用扫描电镜(Scanning Electron Microscope, SEM, Hitachi公司, S-4800型)观察及能谱仪(Energy Dispersive Spectrometer, EDS)分析原始铁锰结核粉末, 观察并分析反应过程中微生物表面形成的矿物。取培养液4 000 r/min离心10min后去除上清液, 用超纯水反复清洗菌液3遍后, 吸取少量菌液滴到硅片上, 于45℃烘干, 固定于电镜样品台上, 喷金, 扫描电镜进行观察, 工作电压15 kV。
大洋铁锰结核和Marinibacillus campisalis相互作用21天后, 收集铁锰结核矿物粉末(4 000 r/min离心10 min), 60℃烘干干燥后运用X射线衍射(X-ray Diffraction, XRD Bruker D-8)分析铁锰结核的矿物组成。
2 结果与分析
2.1 铁锰结核元素组成
铁锰结核核心和壳层的元素含量差别较大, 核心中的Fe、Mn 、Co 、Ni、Cu含量较低, 主要成分为SiO2、Al2O3及少量的钙镁氧化物。而Fe、Mn、Co、Ni、Cu等金属元素含量大约96%~98%分布在壳层中[1]。实验用铁锰结核全岩样品与外层黑色样品的元素组成见表1。铁锰结核外层黑色部分Fe、Mn、Ti、Ni、Co、Pb、Ce等金属元素含量较高, 大约是全岩样品中含量的2倍, Na、K、Cl、S等元素含量比较低, 可以看出铁锰结核外层黑色部分富集大量Fe、Mn等金属元素, 因此选取铁锰结核外层黑色样品用于实验。
2.2 盐场海芽孢杆菌(Marinibacillus campisalis)生长曲线
由于细菌浓度与吸光度成正比, 因此可利用吸光度来测定菌液浓度, 绘制其生长曲线(图2)。由图2可知, Marinibacillus campisalis在12—24 h处于对数生长期, 此时细胞数迅速增长, 酶系活跃、代谢旺盛, 最适宜接种至反应体系。24 h后, 细菌逐步进入稳定期, 代谢产物累积, 生长速率逐渐降低。
2.3 pH值变化
pH值是培养液性质的重要指标之一。在120 r/min、25℃反应条件下, 通过不同时间点间隔取样, 测定了实验过程中有菌组和无菌组反应体系的pH值变化(图3)。由图3可以看出, 有菌组和无菌组反应体系的pH值均稳定在7.5~8.0且差别不大, 推测反应过程中没有有机酸的释放。在反应进行1天内, 两种条件的pH值均有轻微程度的降低, 推测由于铁锰结核溶出各种金属离子, 金属离子的水解作用导致反应体系pH值有一定程度降低。
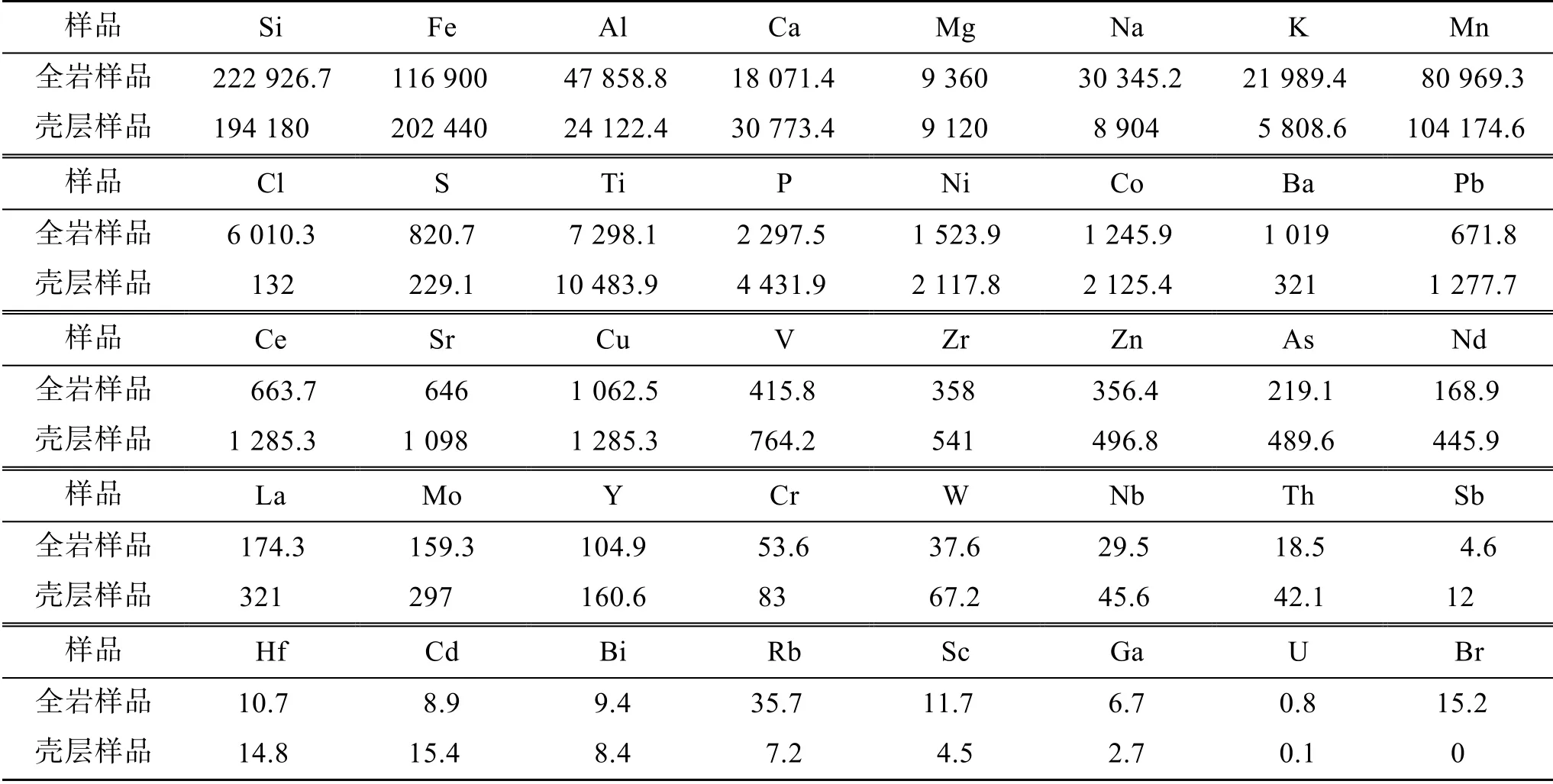
表1 大洋铁锰结核样品的元素组成 (单位: ppm) Tab. 1 The elemental composition of the ferromanganese nodules

图2 盐场海芽孢杆菌生长曲线 Fig. 2 Growth curve of Marinibacillus campisalis
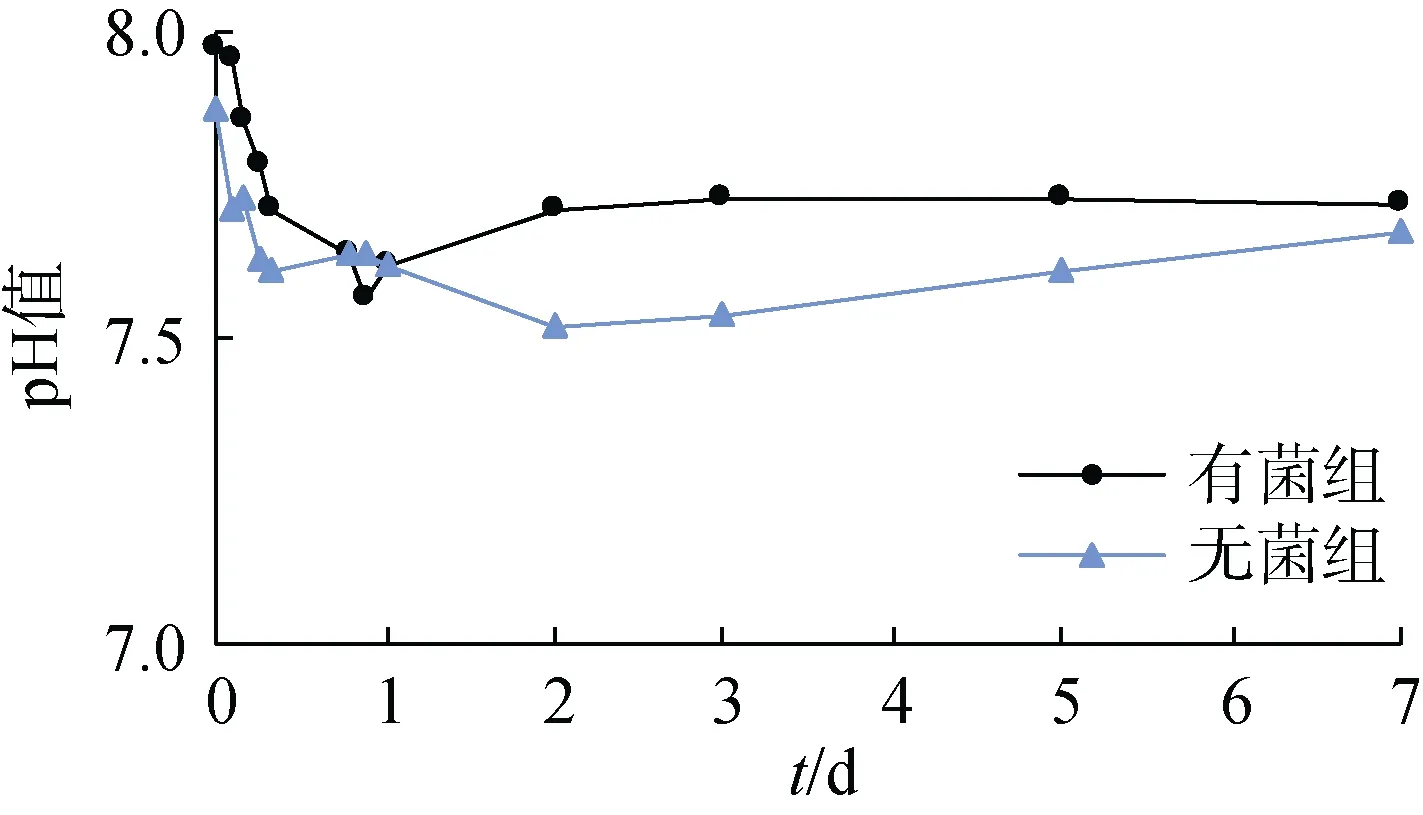
图3 反应溶液pH值变化曲线 Fig. 3 Changes in pH value in the culture solution
2.4 主要离子浓度的变化
测试了Marinibacillus campisalis和铁锰结核相互作用7天内, 有菌组以及无菌组中Fe、Mn、Co、Ni、Cu等元素总离子浓度变化。由图4可以看出, 在Marinibacillus campisalis的作用下Fe、Mn、Ni、Cu元素的总离子浓度大于无菌组的浓度, 有菌组Fe、Mn、Ni元素的总离子浓度在1天内大幅增加后又降低, 2—7天内的离子浓度相较于1天内又有一定程度降低, 但仍高于无菌组的浓度。结合图2中盐场海芽孢杆菌(Marinibacillus campisalis)的生长曲线可知, 1天内是Marinibacillus campisalis的对数生长期, 此时细菌量迅速增加, 细菌活性较强, 可能对铁锰结核中Fe、Mn、Ni等元素的释放有一定程度促进作用; 2—7天内细菌处于稳定期, 对铁锰结核元素的释放能力有所减弱, 此外细菌又对反应体系中的金属离子有富集作用, 能够使金属离子被吸附固定到细菌表面[12-15], 因而可能导致Fe、Mn、Ni总离子浓度在反应1天后有所降低, 但总体趋势仍高于无菌组。在有菌组的反应体系中, Cu元素的总离子浓度高于无菌条件且呈现不断增加的趋势, 表明盐场海芽孢杆菌(Marinibacillus campisalis)对结核中Cu元素的溶解释放作用强于吸附固定作用。Co元素的总离子浓度在两种条件下的差别不大, 表明盐场海芽孢杆菌(Marinibacillus campisalis)促进Co元素释放的作用较弱。
2.5 透射电镜观察
运用透射电镜对盐场海芽孢杆菌(Marinibacillus campisalis)的菌体形态进行观察, 盐场海芽孢杆菌(Marinibacillus campisalis)的大小约在1~2 μm, 呈椭 圆杆状, 有鞭毛(图5a, 5b)。对有菌组反应1天后和4天后进行取样, 透射电镜观察微生物表面矿物形成情况的变化。图5c、d是反应1天后不同位置观察到的菌体形态, 与图5 a、b对比可以看到, 正常培养的细菌表面没有其他物质存在, 而加入铁锰结核粉末反应1天后, 可以看到在细菌表面吸附聚集了很多非常微小的颗粒物质, 大小约0.1 μm, 并且有的颗粒物嵌入了细菌表面。图5e、f是反应4天后不同位置观察的菌体形态, 与图5 c、d对比, 可以看到细菌表面嵌入的颗粒变大, 约0.5 μm, 并且没有观察到反应1天后观察到的微小颗粒。在微生物表面观察到的这些微小颗粒, 可能是由于细菌的细胞表面含有大量带负电荷的官能团, 能够吸附反应体系中的金属阳离子, 从而在细胞表面形成含金属离子的微小颗粒[12,14]。

图4 反应溶液中Fe(a)、Mn(b)、Ni(c)、Cu(d)、Co(e)浓度变化 Fig. 4 Concentrations of Fe(a), Mn(b), Ni(c), Cu(d), and Co(e) in the culture solutions
2.6 扫描电镜观察及能谱分析
为了鉴定微生物表面颗粒物的成分, 运用扫描电镜能谱(SEM-EDS)分析了粉末状铁锰结核的矿物元素组成, 并检测了实验过程中菌体表面颗粒物的元素组成, 与原始铁锰结核矿物成分进行对比。图6A、a分别是铁锰结核矿物的SEM和EDS结果, 可以看到原始的铁锰结核粉末形状较规整, 颗粒较大, 在100 μm左右, 接近之前研磨过筛的尺寸, 元素组成较复杂, Fe、Mn含量较高, 约在20%左右, 并且含有Ti、Co、Ni、Cu等微量金属元素。图6B、b和图6C、c是菌体表面颗粒物的SEM和EDS结果, 图6B、b中颗粒物大小约在1 μm左右, 元素组成较简单, Fe含量3.83%, 未测得Mn以及其他微量金属元素。图6C、c中颗粒物大小约在2 μm左右, 元素组成较简单, Fe含量9.87%, Mn含量5.06%, 未测得其他微量金属元素。微生物在溶解矿物的同时, 能够诱导形成新的矿物[17], 微生物具有较大的比表面积和丰富的电荷[18], 能够从周围环境中吸附和富集金属离子, 又可以利用其细胞壁作为矿物成核结晶的模板[19], 形成菌体-矿物复合体, 当细胞最终死亡时, 菌体的形态保持良好, 菌体便形成了新形成的矿物的核心[10]。由于菌体表面的颗粒物和原始的铁锰结核矿物成分差别较大, 推测颗粒物是通过微生物成矿作用形成的, 反应过程中盐场海芽孢杆菌(Marinibacillus campisalis)促进铁锰结核溶解释放出金属离子, 随后金属离子又被吸附在菌体表面, 形成了简单的含Fe化合物, 如图6B、b所示; 随着反应时间的增长, 细菌继续吸附富集金属离子, 颗粒物逐渐增大, 形成了新的矿物, Fe、Mn含量增加, 如图6C、c所示。

图5 微生物表面形态 Fig. 5 Morphology of the microbial surface
2.7 反应前后铁锰结核矿物XRD分析
在Marinibacillus campisalis与铁锰结核外层矿物相互作用21天后, 运用X射线衍射手段分析反应前后铁锰结核矿物组成的变化。在中性或碱性条件下铁离子能够缓慢生成针铁矿[20]。本实验在中性偏碱性条件下进行, 由图7可以看出, 剥离的铁锰结核外层粉末经过Marinibacillus campisalis的作用, 菱铁矿、赤铁矿和针铁矿等有轻微程度的增加。菱铁矿(FeCO3)衍射特征主峰强度由34增加为57, 赤铁矿(Fe2O3)衍射特征主峰强度由31增加为52, 针铁矿(α-Fe2O3)衍射特征主峰强度由64增加为83。结合反应体系中总离子浓度变化和菌体表面形成的矿物结果, 通过Marinibacillus campisalis的成矿作用, 形成了新的含Fe化合物和含Fe、Mn的矿物颗粒, 因此在XRD结果中铁矿物有轻微程度的增加。由于实验选用的铁锰结核样品中铁锰矿物初始含量较高, 而且反应体系中微生物量相对较少, 影响了微生物的作用效果, 因此可能导致了XRD结果中没有体现出明显的矿物含量变化。Marinibacillus campisalis同样促进了Cu的释放, 但是由于Marinibacillus campisalis对结核中Cu元素的溶解释放作用强于吸附固定作用, 总离子浓度呈现不断增加的趋势, 在EDS和XRD结果中亦没有体现出含铜矿物的变化。

图6 微生物表面矿物SEM/EDS分析 Fig. 6 SEM and EDS analysis of microbial surface minerals

图7 有菌组和无菌组矿物的XRD图 Fig. 7 XRD patterns of minerals in blank and microbial action
3 讨论
微生物能够促进矿物的溶解或形成, 许多微生物通过催化或以其他方式控制矿物形成或溶解, 对矿物产生重大影响[21]。微生物能够通过产生有机酸、胞外多聚物、铁载体等方式来溶蚀矿物, 进而促进矿物中矿质元素的释放[9]。此外, 微生物可以通过将金属阳离子结合到细胞膜的带负电基团上来促进金属矿物在其细胞表面的积累, 结合的金属离子随后可以与阴离子反应以形成不溶性盐, 在足量的阳离子和阴离子的情况下, 细胞表面的金属盐形成矿物, 阴离子可能是细菌代谢的产物, 也可能具有非生物起源。当细胞最终死亡时, 菌体便形成了新形成的矿物的核心[10]。已有大量微生物诱导形成铁矿物或锰矿物的研究将海洋锰结核的起源与细菌活动联系起来, 认为锰氧化细菌能够参与海洋锰结核的形成, 而且在海洋锰元素的循环中起着举足轻重的作用[22-24]。锰氧化菌参与海洋锰结核的形成有三类方式[10]: 一类通过将氧化锰与细胞表面结合, 然后通过细胞聚集引发结核形成; 一类通过将海水中游离态的锰离子与细胞表面结合并氧化形成结核[25]; 一类通过对锰铁氧化物或某些黏土矿物中的锰进行氧化, 这类锰氧化菌能够从氧化过程中获得能量。这种作用机制直接解释了锰氧化菌影响结核生长。已有较多与微生物诱导锰矿化相关的研究成果, 如芽孢杆菌属细菌能够促进菱锰矿的形成和沉淀[26]。此外有些微生物能够将弱结晶的铁氧化物还原为离子态Fe(II)或者含Fe(II)矿物, 已报道的有磁铁矿、菱铁矿等[27-29], 微生物可直接或者间接地参与自然界含Fe矿物的迁移、富集、转化和沉淀, 并直接影响生物地球化学循环[30-31]。有研究认为微生物对大洋沉积物中铁、锰的转移及沉析起极大作用, 远大于单纯的化学沉积作用, 能够加速铁锰结核的形成[32]。通过相互作用过程中反应体系的pH值变化、总离子浓度变化、微生物表面矿物形成情况变化以及反应前后的铁锰结核矿物组成多方面的综合分析, 盐场海芽孢杆菌(Marinibacillus campisalis)能够促进铁锰结核中Fe、Mn、Cu等元素的释放, 对Cu元素的吸附固定作用较弱, 没有新形成的含铜矿物, 但是能够对Fe、Mn产生富集作用, 吸附金属离子到细菌表面, 从而在细胞表面形成简单的含Fe化合物和含Fe、Mn的矿物颗粒, 最终铁锰结核粉末中的菱铁矿、赤铁矿和针铁矿等有轻微程度的增加。因此推测在海洋微生物的作用下, 如此次实验选用的盐场海芽孢杆菌(Marinibacillus campisalis), 能够促进铁锰等元素的成矿, 在较长时间的相互作用过程中, 海水中的金属离子能够在海洋微生物的作用下被吸附固定形成金属矿物, 进而可能对大洋铁锰结核的形成有一定程度的促进作用。
4 结论
本文详细研究了盐场海芽孢杆菌(Marinibacillus campisalis)与大洋铁锰结核粉末状样品的相互作用过程, 分析了海洋微生物对大洋铁锰结核矿物组成及其主要金属元素迁移过程的影响, 初步探究了可能存在的海洋微生物诱导矿化机制。表明海洋微生物对大洋铁锰结核中铁锰元素的成矿有重要作用, 海洋微生物的诱导成矿可能能够促进大洋铁锰结核的形成。

