BINOL硫脲催化合成羟甲基吡喃酮衍生物的性能
杨志翔,陈平平,李 淼,陈治明,3*
(1.四川省疾病预防控制中心理化检验所,四川 成都 610041;2.贵州师范大学化学与材料科学学院,贵州 贵阳 550001;3.贵州省功能材料化学重点实验室,贵州 贵阳 550001)
在现代有机合成反应中,构建C-C键的方式很多,其中不对称Aldol反应是最有效的方法之一。其反应产物β-羟基羰基化合物应用广泛,尤其在医药生产中有很重要的应用[1-5]。硫脲作为有机合成中结构单元的一部分,在杂环骨架的合成中有着广泛的应用[6-7]。硫脲作为一种氢键供体型的有机小分子催化剂,其反应机理是通过与底物形成氢键来活化反应试剂,从而起到催化反应的作用[8]。1998年,Sigman M S等[9]初次报道用含有硫脲结构的化合物催化不对称Strecker反应。随后的发展,形成了脯氨酸衍生的硫脲类[10-12]、环己二胺衍生的硫脲类[13-15]、金鸡纳生物碱衍生的硫脲类[16-17]为主的硫脲类催化剂,应用非常广泛。合成的硫脲类化合物作为催化剂并且应用于各种不对称催化反应中,取得了令人满意的效果。
在之前的研究中,本课题组进行设计并且修饰了(R)-BINOL骨架的3,3′位置,通过酰化、取代和加成反应得到硫脲类衍生物,应用于Sulfa-Michael/Aldol串联反应[18-19]和Biginelli反应[20]中,取得很好的催化效果。本文通过修饰BINOL骨架,合成4种双活性中心、多氢键的对称性双硫脲催化剂(Ⅰ~Ⅳ,图1),用于催化四氢吡喃酮和苯甲醛的不对称Aldol反应,同时高效合成羟甲基吡喃酮衍生物(图3)。

图1 硫脲类衍生物催化剂Figure 1 Catalysts for thiourea derivatives
1 实验部分
1.1 仪器与试剂
Unity-400型核磁共振仪,溶剂为CDCl3(除非特别说明),内标为四甲基硅烷(TMS);德国布鲁克公司TENSOR27型傅里叶变换红外光谱仪,KBr压片;WZZ-1型旋光仪;X-6数字显示微熔点测定仪;UHR TOF LC/MS Mass Spectrometer型超高分辨飞行时间质谱仪;LC2000型高效液相色谱仪,色谱柱为Chiralpak OD-H手性柱,流动相:V(正己烷)∶V(异丙醇)=85∶15,流速1.0 mL·min-1,检测波长254 nm。所用试剂均为分析纯。
1.2 催化剂的合成
(R)-BINOL-3,3′-二甲酸按照文献[21-23]合成,然后经过酰化反应、取代反应和加成反应得到目标产物Ⅰ~Ⅳ[24],见图2。
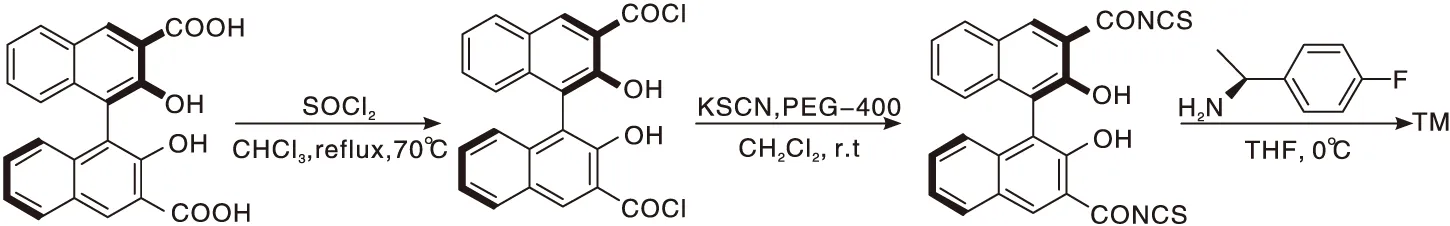
图2 硫脲类衍生物催化剂的合成Figure 2 Synthesis of catalyst for thiourea derivative
分别取(R)-BINOL-3,3′-二甲酸(0.30 g,0.8 mmol)、SOCl2(0.2 g,1.6 mmol)缓慢放入至250 mL圆底烧瓶中,加入40 mL纯化过的CHCl3,在磁力搅拌下升温至70 ℃,充分回流,6 h后,观察气体完全逸出(氢氧化钠稀溶液吸收尾气),薄层色谱法检测,旋转蒸发、浓缩,得到酰化反应产物。
把100 mL圆底烧瓶置于磁力搅拌器上,依次加入KCNS(0.2 g,2 mmol)、PEG-400和40 mL纯化的CH2Cl2,搅拌,使PEG-400均匀分散,把酰化产物(R)-BINOL-3,3′-二甲酰氯全部溶解于20 mL纯化的CH2Cl2溶液中,借助恒压滴液漏斗缓慢滴加到溶有KCNS的CH2Cl2溶液中,过程需要7 min。继续搅拌,薄层色谱法检测反应,直到沉淀生成。浓缩,得黄色固体。
加入20 mL的THF溶解上一步所得的黄色固体,置于250 mL三口烧瓶中直至全部溶解,同时容器内充满氮气,加入(R)-(-)-1-(4-氟苯基)-乙胺(0.24 g,1.6 mmol),冰浴条件下反应12 h,薄层色谱法检测反应完成,蒸发、浓缩,柱层析纯化[洗脱剂:V(石油醚)∶V(乙酸乙酯)=10∶1],得黄色固体Ⅰ,收率为70%。
以同样的方法合成Ⅱ~Ⅳ。
催化剂的表征:

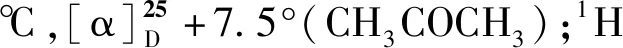


1.3 羟甲基吡喃酮衍生物的合成
羟甲基吡喃酮衍生物的合成路线如图3所示。

图3 羟甲基吡喃酮衍生物的合成路线Figure 3 Synthesis of hydroxymethylpyranone derivatives
依次称取四氢吡喃酮(0.113 g,1.250 mmol)、苯甲醛1a(0.027 g,0.250 mmol),催化剂Ⅱ(X=10%),HOAc(X=10%)和2 mL的CH2Cl2置于50 mL圆底烧瓶中,10 ℃条件下磁力搅拌。24 h后减压蒸馏,柱层析纯化[洗脱剂:V(石油醚)∶V(乙酸乙酯)=7∶1],得淡黄色固体2a。收率为柱层析分离后的收率,对映选择性使用Chiralpak OD-H柱的HPLC分析测定。
用同样的实验方法合成2b~2m。表征如下:
2a:Yield 79%,80%ee,[HPLC,tR=9.12 min(次),tR=21.04 min(主)];1H NMR(400 MHz,CDCl3),δ:0.88~1.26(d,J=15.2 Hz,2H),1.86(m,1H),2.50~2.90(d,J=10.4,Hz,2H),3.58(d,J=11.2 Hz,2H),4.00(m,2H),4.89 (m,1H),7.27~7.53(t,J=13.6 Hz,3H),8.16(d,J=4.8 Hz,1H)。13C NMR(100 MHz,CDCl3),δ:43.68,58.08,68.34,70.93,72.22,125.53,125.88,128.44,129.35,134.25,140.21,210.01。
2b:Yield 81%,86%ee,[HPLC,tR=11.02 min(次),tR=21.12 min(主)];1H NMR(400 MHz,CDCl3),δ:1.13 (s,2H),1.41(s,1H),2.15(m,3H),2.96(d,J=8.0 Hz,2H),3.49(m,1H),5.44(d,J=8.4 Hz,1H),7.48(m,1H),8.39(s,2H).13C NMR(100 MHz,CDCl3),δ:43.99,49.77,55.67,67.25,69.55,124.25,128.11,130.55,133.24,138.52,147.23,206.99。
2c:Yield 78%,82%ee,[HPLC,tR=10.23 min(次),tR=19.99 min(主)];1H NMR(400 MHz,CDCl3),δ:1.08(m,1H),1.26(s,1H),1.73(m,1H),2.52(dd,J=13.6 Hz,1H),2.83(d,J=9.6 Hz,1H),3.16(d,J=4.0 Hz,1H),3.47(m,1H),3.80(dd,J=6.0 Hz,1H),4.23(s,1H),5.24(m,1H),7.40(m,1H),7.68(s,1H),8.20(m,1H);13C NMR(100 MHz,CDCl3),δ:44.05,67.32,67.04,68.22,70.11,120.47,122.44,129.36,130.55,142.33,149.32,208.54。
2d:Yield 77%,85%ee,[HPLC,tR=10.49 min(次),tR=21.20 min(主)];1H NMR(400 MHz,CDCl3),δ:1.09(d,J=8.2 Hz,2H),2.02(s,1H),2.56(m,2H),3.05(m,3H),3.99(m,2H),5.27(m,1H),7.40(d,J=13.6 Hz,2H),8.23(m,1H);13C NMR(100 MHz,CDCl3),δ:44.83,46.50,57.05,67.31,68.21,69.78,123.84,123.88,126.75,129.55,148.77,208.45。
2e:Yield 80%,83%ee,[HPLC,tR=9.79 min(次),tR=19.86 min(主)];1HNMR(400 MHz,CDCl3),δ:1.41(t,J=10.4 Hz,1H),2.55(m,1H),2.85(s,1H),3.33(dd,J=12.3 Hz,1H),3.74(m,2H),3.93(m,1H),4.17(s,1H),5.76(m,1H),7.01(m,3H),7.42(d,J=8.4 Hz,1H);13C NMR(100 MHz,CDCl3),δ:43.89,57.48,67.70,68.23,70.32,112.79,114.44,120.97,131.39,143.56,164.19,208.71。
2f:Yield 78%,82%ee,[HPLC,tR=13.82 min(次),tR=21.68 min(主)];1HNMR(400 MHz,CDCl3),δ:1.07(m,1H),1.63(s,2H),2.60(m,1H),2.87(s,1H),3.37(d,J=4.0 Hz,1H),3.72(m,2H),4.06(d,J=10.4 Hz,1H),5.41(m,1H),7.06(s,1H),7.28(d,J=8.0 Hz,2H);13C NMR(100 MHz,CDCl3),δ:44.04,57.69,68.40,69.86,70.88,115.55,127.03,127.87,128.42,129.97,136.34,208.88。
2g:Yield 71%,72%ee,[HPLC,tR=11.84 min(次),tR=22.98 min(主)];1H NMR(400 MHz,CDCl3),δ:2.43(d,J=11.2 Hz,3H),2.87(s,2H),3.81(m,2H),4.15(s,1H),4.83(d,J=5.6 Hz,1H),5.38(s,1H),7.11~7.20(d,J=6.8 Hz,3H),7.89(s,1H).13C NMR(100 MHz,CDCl3),δ:21.46,43.32,58.38,68.35,70.97,72.22,115.87,123.52,126.68,128.49,130.36,138.55,210.19。
2h:Yield 76%,77%ee,[HPLC,tR=11.25 min(次),tR=20.51 min(主)];1H NMR(400 MHz,CDCl3),δ:1.28(m,1H),2.54(m,2H),2.85(s,1H),3.37(dd,J=6.8,10.8 Hz,2H),3.88(d,J=12.4 Hz,3H),4.14(s,1H),4.85(m,1H),5.38(d,J=4.8 Hz,2H),6.97(d,J=7.6 Hz,2H),7.27(d,J=3.2 Hz,1H)。13C NMR(100 MHz,CDCl3),δ:43.11,55.30,56.96,68.40,70.88,113.63,120.98,121.02,126.80,130.97,159.64,164.35,208.77。
2i:Yield 81%,83%ee,[HPLC,tR=15.23 min(次),tR=23.95 min(主)];1H NMR(400 MHz,CDCl3),δ:1.26(m,2H),2.51(d,J=4.8 Hz,4H),3.98(t,J=6.2 Hz,3H),4.12(s,1H),5.07(m,1H),6.61(d,J=5.6 Hz,1H),7.44(d,J=12.8 Hz,1H);13C NMR(100 MHz,CDCl3),δ:29.71,42.91,65.17,67.96,68.51,112.70,117.74,121.25,129.93,145.61,152.82,207.66。
2j:Yield 82%,82%ee,[HPLC,tR=14.32 min(次),tR=26.54 min(主)];1H NMR(400 MHz,CDCl3),δ:1.30(m,1H),2.30(m,1H),2.59(d,J=3.2 Hz,1H),2.83(s,1H),3.36(s,1H),3.78(t,J=6.4 Hz,3H),4.16(s,1H),5.61(m,1H),6.98(m,1H),7.19(s,1H),7.47(s,1H);13C NMR(100 MHz,CDCl3),δ:42.71,58.55,68.59,69.63,72.86,122.30,127.42,128.40,134.49,136.55,139.24,209.73。
2k:Yield 73%,79%ee,[HPLC,tR=10.89 min(次),tR=21.54 min(主)];1H NMR(400 MHz,CDCl3),δ:1.26(s,2H),1.68(m,2H),2.23(d,J=10.0 Hz,1H),2.51(s,2H),2.72(s,1H),3.80(s,1H),3.98(s,2H),4.74(dd,J=3.6,4.8 Hz,1H),8.05(m,1H).13C NMR(100 MHz,CDCl3),δ:29.72,41.99,42.86,67.91,69.51,126.62,130.11,132.21,133.01,133.75,134.60,208.80。
2l:Yield 72%,85%ee,[HPLC,tR=11.19 min(次),tR=22.23 min(主)];1H NMR(400 MHz,CDCl3),δ:1.17(s,2H),1.26(m,2H),2.61(d,J=7.60 Hz,1H),3.98~4.31(m,2H),4.83(s,1H),7.23~7.99(d,J=5.6 Hz,3H),7.96(d,J=5.6 Hz,2H);13C NMR(100 MHz,CDCl3),δ:29.31,41.58,49.79,66.32,70.33,129.11,130.98,133.06,132.32,135.41,136.86,208.50。
2m:Yield 69%,77%ee,[HPLC,tR=15.04 min(次),tR=23.39 min(主)];1H NMR(400 MHz,CDCl3),δ:1.24(s,1H),1.99(s,1H),2.55(dd,J=8.0 Hz,1H),2.94(d,J=4.4 Hz,2H),3.48(s,2H),3.79(m,1H),4.22(d,J=5.6 Hz,2H),5.48(m,1H),7.38(m,1H),7.67(s,1H)。13C NMR(100 MHz,CDCl3),δ:44.65,50.88,67.54,68.23,71.49,111.40,118.30,127.25,127.41,132.35,132.51,148.71,208.29。
2 结果与讨论
2.1 催化剂种类及用量
考察BINOL硫脲类催化剂种类及其用量对合成羟甲基吡喃酮衍生物的影响。在10 ℃时,CH2Cl2作溶剂,四氢吡喃酮与苯甲醛(1a)的不对称Aldol反应时间为24 h,对催化剂(Ⅰ~Ⅳ)的催化性能进行比较,结果见表1。由表1表明,在相同反应条件下,4种轴手性BINOL硫脲催化合成羟基吡喃酮衍生物,具有高效的催化效果,得到中等收率(61%~82%ee)和对映选择性(65%ee~86%ee)。虽然都能得到羟基吡喃酮衍生物,但催化效果不同,其中Ⅲ催化剂上的收率和对映选择性最低,Ⅱ催化上的收率及对映选择性相对较高,Ⅰ催化剂上的收率虽然高,但对映选择性较低;当催化剂Ⅱ的用量从5%增加到20%时,收率依次增加,但对应选择性增加不明显,所以选择催化剂用量X=10%。

表1 催化剂种类及其用量的筛选Table 1 Screening of catalysts and its dosage
4种催化剂中,Ⅰ、Ⅱ、Ⅳ都是双手性中心,Ⅲ是单手性中心-轴手性,其催化效果明显不一样。原因可能是Ⅱ是所用手性胺苯环上无取代基,相比于Ⅳ的苯环对位上的给电子基团,催化效果较好,催化剂Ⅰ所用的手性胺苯环对位上有氟原子取代基,氟原子的强吸电子作用抑制了催化剂的催化活性,因此对映选择性不高;Ⅲ只有单手性-轴手性,其收率和对位选择性更低。从原子经济性和催化性能考虑,选取催化剂Ⅱ,催化剂用量X=10%。
2.2 溶剂和反应温度
选取催化剂Ⅱ,催化剂用量X=10%,考察溶剂和反应温度对合成产物羟甲基吡喃酮衍生物的影响,结果见表2。

表2 反应温度和溶剂对反应的影响Table 2 Effect of reaction temperature and solvent on the reaction
由表2可以看出,相同条件下,以CH2Cl2作溶剂时,收率和对映选择性最高。而以乙醚、乙醇、四氢呋喃、N,N-二甲基甲酰胺为溶剂,收率和对映选择性均较低;甲苯中有不饱和键,用其作为反应溶剂时效果不佳。用CH2Cl2作溶剂,升高反应温度至20 ℃时,合成的产物羟甲基吡喃酮衍生物收率和对映选择性明显降低;降低反应温度至0 ℃,产物羟甲基吡喃酮衍生物收率和对映选择性也没有增加。综合考虑,确定反应温度为10 ℃,CH2Cl2作为溶剂。
2.3 最优工艺条件下合成羟甲基吡喃酮衍生物
在最优的实验条件即以Ⅱ(X=10%)为催化剂,CH2Cl2为溶剂,于10 ℃反应,合成羟甲基吡喃酮衍生物2a~2m,结果见表3。

表3 最优实验条件下合成羟甲基吡喃酮衍生物Table 3 Synthesis of hydroxymethylpyranone derivatives under optimal experimental conditions
由表3可以看出,在催化剂Ⅱ作用下,四氢吡喃酮和苯甲醛及衍生物的反应,都能高效地进行不对称Aldol反应,有较高的收率(69%~82%)和较高的对映选择性(72%ee~86%ee)。尽管苯甲醛及其衍生物苯环上的取代基种类不同,但反应都能高效地进行,表明催化剂的普适性很好;苯甲醛苯环上取代基的能力作用不同,产物的收率和对映选择性也不同,充分说明取代基的取代能力对不对称直接Aldol反应有着重要的影响,电负性较大的卤素种类与位置不同,合成的羟甲基吡喃酮衍生物结果也不同。
3 结 论
(1) 合成了BINOL硫脲衍生物,作为催化剂应用于四氢吡喃酮与苯甲醛的不对称Aldol反应中。在反应温度10 ℃,CH2Cl2作溶剂,Ⅱ(X=10%)为催化剂中,扩充了四氢吡喃酮和苯甲醛及其衍生物的反应底物,得到收率高达82%和对映选择性高达86%的羟甲基吡喃酮衍生物2a~2m。
(2) 该方法具有反应操作简单、原子经济等优点。

