右美托咪定对脑缺血再灌注损伤大鼠大脑皮质Wnt/β-catenin蛋白表达的影响
何海娟 杨燕青 郑波 丛海涛 戴勤学

[摘要] 目的 觀察右美托咪定对脑缺血再灌注损伤大鼠大脑皮质Wnt/β-catenin蛋白表达的影响。 方法 将48只雄性SD大鼠按随机区组的原则分为三组:对照组、模型组和右美托咪定组,每组各16只。采用大脑中动脉阻塞(Middle cerebral artery occlusion,MCAO)法制造大鼠脑缺血再灌注损伤模型。右美托咪定组于缺血1 h即刻经尾静脉注射1 μg/kg右美托咪定作为负荷剂量,持续10 min,随后以0.5 μg/(kg·h)的速率静脉输注至脑缺血2 h。对照组和模型组大鼠按相同方法给予生理盐水。再灌注24 h时进行神经功能评分后处死大鼠取出脑组织,各组取8只大鼠脑组织行TTC染色法测定脑梗死体积,另8只大鼠采用Western blot法检测大脑皮质β-catenin蛋白表达量。 结果 与对照组相比,模型组大鼠神经行为学评分明显增加[(3.00±0.82) vs (0±0),P<0.05]、脑梗死体积明显增加[(64.23±6.72)% vs (0±0)%,P<0.05],β-catenin蛋白表达量明显减少(0.46±0.14 vs 1.12±0.23,P<0.05)。与模型组相比,右美托咪定组大鼠神经行为学评分(1.69±0.71 vs 3.00±0.82,P<0.05)、脑梗死体积明显减少[(45.13±8.29)% vs (64.23±6.72)%,P<0.05],β-catenin蛋白表达量明显增加[(0.82±0.23) vs (0.46±0.14),P<0.05]。 结论 右美托咪定能减轻大鼠脑缺血再灌注损伤,其机制可能与增加大脑皮质中β-catenin蛋白表达量有关。
[关键词] 脑缺血再灌注损伤;右美托咪定;Wnt/β-catenin蛋白;大鼠
[中图分类号] R614 [文献标识码] A [文章编号] 1673-9701(2020)35-0039-04
[Abstract] Objective To observe the effect of dexmedetomidine on Wnt/β-catenin protein expression in cerebral cortex of rats with cerebral ischemia-reperfusion injury. Methods A total of 48 male SD rats were divided into 3 groups according to the principle of randomized block: control group, model group and dexmedetomidine group, with 16 rats in each group. The middle cerebral artery occlusion(MCAO) method was used to make the model of cerebral ischemia-reperfusion injury in rats. In the dexmedetomidine group, 1 μg/kg dexmedetomidine was injected into caudal vein as a loading dose for 10 min immediately after 1 h of ischemia, and then was injected intravenously to cerebral ischemia for 2 h at a rate of 0.5 μg/(kg·h). Rats in the control group and the model group were given normal saline in the same way. Neurological function scores were concluded 24 h after reperfusion, and then rats were executed for brain tissues to be taken out. Brain tissues of 8 rats in each group were taken out for TTC staining method to measure cerebral infarction volume, and the expression of β-catenin protein in cerebral cortex of the other 8 rats was detected by Western blot method. Results Compared with the control group, in the model group the neurobehavioral scores of the rats were significantly increased (3.00±0.82 vs 0±0, P<0.05), the cerebral infarction volume was significantly increased[(64.23±6.72)% vs (0±0)%, P<0.05], and the expression of β-catenin protein was significantly decreased(0.46±0.14 vs 1.12±0.23, P<0.05). Compared with the model group, in the dexmedetomidine group, the neurobehavioral scores of the rats (1.69±0.71 vs 3.00±0.82, P<0.05) and the cerebral infarction volume[(45.13±8.29)% vs (64.23±6.72)%, P<0.05] were significantly reduced, and the expression of β-catenin protein[(0.82±0.23) vs (0.46±0.14), P<0.05] was significantly increased. Conclusion Dexmedetomidine can reduce cerebral ischemia-reperfusion injury in rats, and its mechanism may be related to increasing the expression of β-catenin protein in cerebral cortex.
[Key words] Cerebral ischemia-reperfusion injury; Dexmedetomidine; Wnt/β-catenin protein; Rat
目前右美托咪定(Dexmedetomidine)在临床上应用广泛,其具有镇静、镇痛和抗交感活性[1]等作用。研究表明右美托咪定具有脏器保护作用[2]。脑缺血再灌注损伤在临床上是十分常见并且多发的疾病,其具体机制十分复杂并不明确[3]。有研究表明右美托咪定具有神经保护作用[4],其可能的机制是增强内源性抗氧化酶的活性,减少神经元细胞的凋亡,降低血清神经元特异性烯醇化酶以及S100β蛋白浓度等[5]。Wnt/β-catenin信号通路作为一条多环节、多作用位点的开放通路,在神经系统中起着非常重要的作用[6]。已有文献证实Wnt/β-catenin信号通路参与了脑缺血损伤的病理生理过程,并且β-catenin蛋白是该信号通路的关键蛋白[7]。那么,β-catenin蛋白是否与右美托咪定的脑保护有关,值得进一步探索。
1 材料与方法
1.1 动物选择与分组
健康雄性SD大鼠48只,体重(230±15)g,动物编码:2010000417632。由温州医科大学动物房提供,饲养于标准动物房中并自由觅食。手术前一日禁食但不禁饮。将48只SD大鼠按随机区组的原则分为三组:对照组、模型组以及右美托咪定组,每组16只。
1.2 给药方法
右美托咪定组大鼠在脑缺血1 h时,采用微量输液泵(MICROINFUSION PUMP WZS-50F6,浙江大学医学仪器有限公司)经尾静脉注射右美托咪定(批号:16091032,江苏恒瑞医药股份有限公司)1 μg/kg负荷剂量,持续10 min,然后再以0.5 μg/(kg·h)的速率输注至脑缺血再灌注2 h。对照组和模型组大鼠按相同方法给予等量生理盐水。
1.3 模型制备
采用大脑中动脉阻塞(Middle cerebral artery occlusion,MCAO)法制造大鼠脑缺血再灌注损伤模型[8]。大鼠采用水合氯醛(10%,400mg/kg)麻醉后,颈部皮肤备皮、消毒后切皮,暴露出大鼠右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(CA)。将ECA结扎离断,再将CCA用动脉夹夹住并在ECA残端处剪一个小口,将线栓圆头端[直径为(0.32±0.02) mm,购自北京沙东生物技术有限公司]置入。用眼科镊轻推线栓的尾端经CCA沿CA进入颅腔,直至大脑中动脉(MCA),遇阻力即止。线栓插入深度18~20 mm。对照组大鼠不阻塞大脑中动脉,其余操作同模型组大鼠。脑缺血再灌注2 h时按照Longa等[8]的评分标准对大鼠进行神经功能评分。评分在1分以上的动物作为观察对象,0分则剔除。整个操作过程中要连续监测大鼠肛温,保持在(37.0±0.2)℃。
1.4 行为学评分标准
脑缺血再灌注24 h时,由另一个不知分组情况的研究者按照Longa等[8]的方法进行神经功能评分法:0分,正常、无神经功能障碍表现;1分,轻度神经功能障碍,不能完全伸展对侧前肢;2分,中度神经功能障碍,爬行时向左侧转圈;3分,重度神经功能障碍,行走时向左侧倾倒;4分,极重度神经功能障礙,不能自发行走伴有意识减退。
1.5 TTC染色法
各组取8只大鼠,采用水合氯醛(10%,400 mg/kg)麻醉后断头取脑,用脑模具连续冠状切5片,间距为2 mm,放入2%TTC溶液(购于美国Sigma公司)中(37℃,孵育30 min),不定期翻动脑片使其均匀染色,24 h后数码相机拍照保存在计算机内,采用Image pro plus 6.0图像分析处理软件计算脑梗死体积(正常脑组织被染成红色,梗死区域被染成白色),梗死体积百分比等于梗死侧的梗死体积/对侧正常体积之比。
1.6 Western-blot技术
各组剩余8只大鼠处死后取出大脑皮质,采用Western blot法检测β-catenin表达。大脑皮质细胞总蛋白的提取采用细胞蛋白提取试剂盒(Thermo公司,美国),按照说明书的步骤操作。等量样品经聚偏二氟乙烯膜分离蛋白转移至NC膜上,转移后的NC膜经BSA孵育1 h,再封闭后,分别加入兔抗大鼠β-catenin单克隆抗体(Santa Cruz公司,美国),4℃孵育并过夜。室温下摇床冲洗,再孵育二抗,并化学发光,显影、成像。β-actin作为内参对照。应用Alphaimager 2200凝胶图像处理系统分析目的蛋白,读出每个条带的光密度值。蛋白表达水平用β-catenin蛋白条带光密度值与β-actin条带光密度值的比值来表示,β-catenin蛋白表达水平=光密度值(β-catenin蛋白条带)/光密度值(β-actin条带)。
1.7 统计学方法
采用SPSS13.0统计学软件进行分析,计量资料以均数±标准差(x±s)表示,组间比较均采用单因素方差分析,若方差不齐采用Tamhane检验进行两两比较;若方差齐采用LSD方法检验。P<0.05为差异有统计学意义。
2 结果
2.1 右美托咪定对脑缺血再灌注损伤大鼠行为学的影响
与对照组比较,模型组大鼠行为学评分明显增加[(3.00±0.82) vs (0±0),P<0.05],说明脑缺血再灌注损伤能够造成大鼠的神经运动功能缺陷。与模型组比较,右美托咪定组大鼠行为学评分明显低于模型组[(1.69±0.71) vs (3.00±0.82),P<0.05],说明右美托咪定这种药物可以减少脑缺血再灌注损伤大鼠的神经运动功能缺陷。见表1、图1。
2.2 右美托咪定对脑缺血再灌注损伤大鼠梗死体积以及大脑皮质β-catenin蛋白表达量的影响
与对照组比较,模型组大鼠大脑梗死体积明显增加[(64.23±6.72)% vs (0±0)%,P<0.05],说明大鼠脑缺血再灌注损伤模型的构建成功。与模型组相比,右美托咪定组大鼠大脑梗死体积明显减少[(45.13±8.29)% vs (64.23±6.72)%,P<0.05],说明右美托咪定对脑缺血再灌注损伤大鼠具有脑保护作用。见表1、图2。
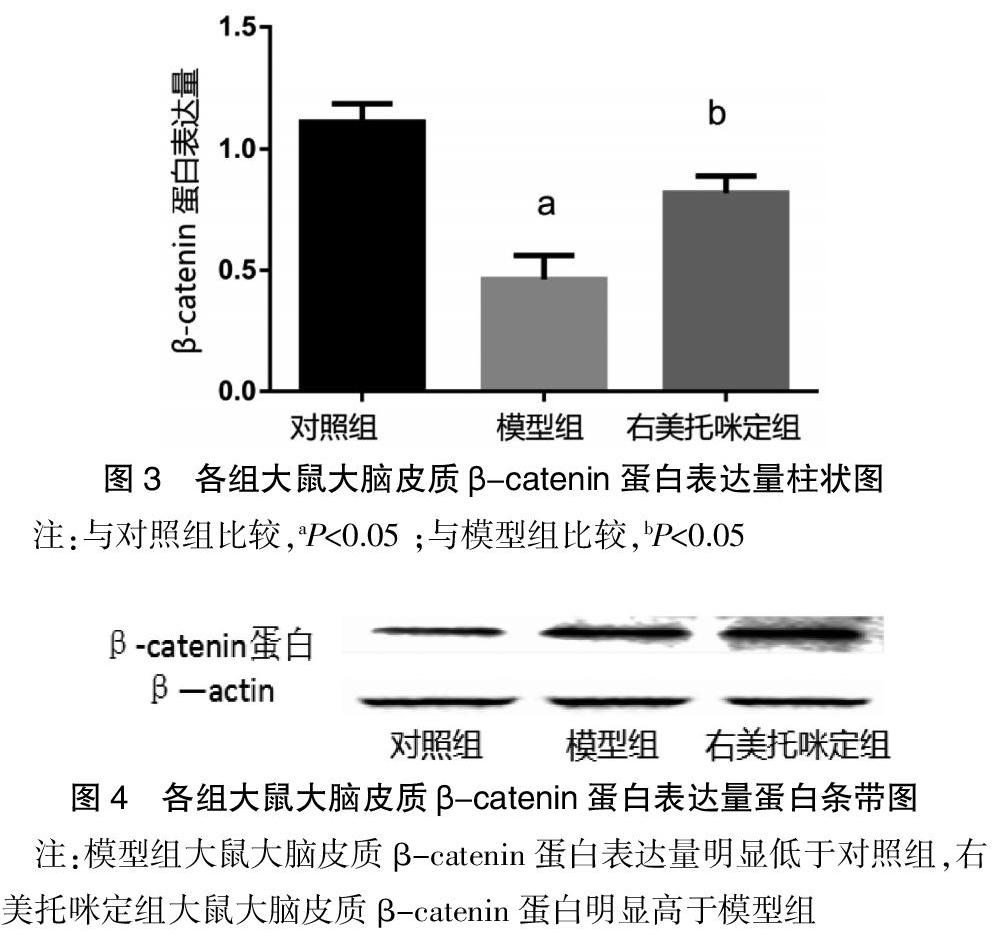
与对照组比较,模型组大鼠大脑皮质β-catenin蛋白表达量明显减少(0.46±0.14 vs 1.12±0.23,P<0.05),说明大鼠脑缺血状态下,大脑皮质的β-catenin蛋白表达量是下降的。与模型组相比,右美托咪定组大鼠大脑皮质β-catenin蛋白表达量明显增加(0.82±0.23 vs 0.46±0.14,P<0.05),说明右美托咪定这种药物可以增加脑缺血再灌注损伤大鼠大脑皮质β-catenin蛋白的表达量。见表1、图3、4。
3 讨论
脏器缺血性损伤是围术期患者死亡的主要原因之一,也是近年来的研究热点。其中脑缺血是围术期比较常见的并发症,也是导致患者远期学习、记忆以及认知功能障碍的重要原因之一[9]。同时脑缺血性损伤也是引起患者致死率和致残率最高的疾病之一,具有发病率高、死亡率高、致残率高的特点[10],其机制相当复杂,钙超载、氧自由基的反应、炎症反应等多种因素参与其中[11]。右美托咪定具有镇静、镇痛、抗焦虑、抑制交感活性、维持血流动力学平稳及无呼吸抑制等特性,广泛运用于围术期患者[12]。目前关于右美托咪定的脑保护作用非常明确,具体机制有较多的研究,比如抑制TLR4/NF-κB途径[13],激活PI3K/Akt/mTOR信号传导途径[14],激活ERK1/2信号通路[15]。但是并未检索到右美托咪定激活对Wnt/β-catenin信号通路的调控作用。本实验采用脑缺血再灌注损伤大鼠为模型,以β-catenin为研究切入点,以神经行为学评分和脑梗死体积为观察指标,目的在于观察Wnt/β-catenin是否与右美托咪定对脑缺血再灌注损伤大鼠的脑保护作用有关。
Wnt/β-catenin蛋白广泛分布于中枢神经系统,在神经系统的发育成熟过程中起着非常重要的作用[16]。Wnt信号通路参与了多种细胞进程,包括细胞增殖、细胞极化以及细胞死亡。Wnt信号通路激活后,胞质内的β-catenin积聚增多并且进入核内,与转录因子TCF和LEF相结合,调节转录[17]。局灶脑缺血后Wnt信号的激活能够恢复神经系统功能,诱导神经元细胞生发产生保护效应[18]。因此Wnt信号通路在脑缺血再灌注损伤中发挥着重要的作用。在本研究中,发现右美托咪定组大鼠行为学评分明显较模型组大鼠改善(P<0.05),大鼠脑梗死体积也较模型组大鼠明显减少(P<0.05),说明右美托咪定对脑缺血再灌注损伤大鼠有脑保护作用,这与他人研究结论相一致[19-21]。同时本实验还发现了右美托咪定组大鼠大脑皮质中β-catenin蛋白较模型组大鼠有明显增加,说明右美托咪定能够使脑缺血再灌注损伤大鼠大脑皮质中β-catenin蛋白表达增加。结合已经发表的文献,推测右美托咪定可以通过提高大鼠大脑皮质中β-catenin蛋白表达,激活Wnt信号通路,从而调节细胞内的转录过程,导致脑内保护性物质合成增多,达到脑保护的作用。
本文发现右美托咪定能够提高脑缺血再灌注损伤大鼠的β-catenin的表达量,而β-catenin是Wnt信号通路中一个关键作用位点,因此本实验结果提示右美托咪定对脑缺血再灌注损伤大鼠的脑保护作用,可能与激活Wnt信号通路有关。当然本实验也有不足之处,未能采用Wnt/β-catenin的拮抗剂Dkk-1观察右美托咪定的脑保护效应能否被Dkk-1所拮抗,进一步明确Wnt/β-catenin信号通路参与右美托咪定对脑缺血再灌注损伤大鼠的脑保护作用。
综上所述,右美托咪定能减轻大鼠脑缺血再灌注损伤,其机制可能与增加大脑皮质中β-catenin蛋白表达量有关。
[参考文献]
[1] 鲁华荣,姜景卫,周召文,等. 右美托咪定对肢体缺血再灌注后患者肺换气的影响[J]. 中国临床药理学与治疗学,2016,21(4):445-449.
[2] 张立功,赵津津,王公明,等. 右美托咪定对大鼠局灶性脑缺血再灌注时iNOS和COX-2表达的影响[J]. 中华麻醉学杂志,2016,(1):109-112.
[3] 刘俊伟,任冶龙,刘旭玲,等. 人参皂苷Rb1对大鼠局灶性脑缺血再灌注损伤后脑梗死体积及脑组织和血清IL-1β的影响[J]. 中国中西医结合杂志,2013,(12):1696-1700.
[4] Engelhard K,Werner C,Eberspcher E,et al. The effect of the alpha 2-agonist dexmedetomidine and the N-methyl-D-aspartate antagonist S(+)-ketamine on the expression of apoptosis-regulating proteins after incomplete cerebral ischemia and reperfusion in rats[J]. Anesth Analg,2003, 96(2):524-531.
[5] 陈丽娇,薛庆生,于布为. 右美托咪定的神經保护作用及其相关机制[J]. 中国药理学通报,2015,31(11):1493-1496.
[6] Nusse R,Varmus H. Three decades of Wnts:A personal perspective on how a scientific field developed[J]. EMBO J,2012,31(12):2670-2684.
[7] Collino M,Thiemermann C,Mastrocola R,et al. Treatment with the glycogen synthase kinase-3beta inhibitor,TDZD-8,affects transient cerebral ischemia/reperfusion injury in the rat hippocampus[J]. Shock,2008,30(3):299-307.
[8] Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[9] Gandhi KA,Panda NB,Vellaichamy A,et al. Intraoperative and Postoperative Administration of Dexmedetomidine Reduces Anesthetic and Postoperative Analgesic Requirements in Patients Undergoing Cervical Spine Surgeries[J]. J Neurosurg Anesthesiol,2017,29(3):258-263.
[10] 李国福,贾佳,符加红,等. 异氟烷预处理或后处理对大鼠局灶性脑缺血/再灌注损伤的影响[J]. 中华危重病急救医学,2014,(6):431-435.
[11] 戴勤学,张荣,张民远,等. 腺苷A2a受体介导人参皂苷Rb1增加脑缺血/再灌注损伤大鼠的脑血流量[J]. 中国中西医结合急救杂志,2016,(4):337-340.
[12] Pasero D,Sangalli F,Baiocchi M,et al. Experienced Use of Dexmedetomidine in the Intensive Care Unit:A Report of a Structured Consensus[J]. Turk J Anaesthesiol Reanim,2018,46(3):176-183.
[13] Zhao H,Chen Z,Xie LJ,et al. Suppression of TLR4/NF-κB Signaling Pathway Improves Cerebral Ischemia-Reperfusion Injury in Rats[J]. Mol Neurobiol,2018,55(5):4311-4319.
[14] Shen M,Wang S,Wen X,et al. Dexmedetomidine exerts neuroprotective effect via the activation of the PI3K/Akt/mTOR signaling pathway in rats with traumatic brain injury[J]. Biomed Pharmacother,2017,95:885-893.
[15] Teng L,Chen W,Yin C,et al. Dexmedetomidine Improves Cerebral Ischemia-Reperfusion Injury in Rats via Extracellular Signal-Regulated Kinase/Cyclic Adenosine Monophosphate Response Element Binding Protein Signaling Pathway[J]. World Neurosurg,2019,127:e624-e630.
[16] National Institute of Neurological Disorders and Stroke.11th International Symposium on Neural Regeneration[J]. Neurorehabil Neural Repair, 2006,(2):306-348.
[17] Huang C,Fu XH,Zhou D,et al. The Role of Wnt/β-Catenin Signaling Pathway in Disrupted Hippocampal Neurogenesis of Temporal Lobe Epilepsy:A Potential Therapeutic Target[J]. Neurochem Res,2015,40(7):1319-1332.
[18] Sun FL,Wang W,Zuo W,et al. Promoting neurogenesis via Wnt/β-catenin signaling pathway accounts for the neurorestorative effects of morroniside against cerebral ischemia injury[J]. Eur J Pharmacol,2014,738:214-221.
[19] 郭培培,吴会生,严虹,等. 右美托咪定对大鼠全脑缺血再灌注时氧化应激反应的影响[J]. 中华麻醉学杂志,2015,(3):377-379.
[20] 郭培培,嚴虹,陈璟莉,等. 右美托咪定对全脑缺血再灌注大鼠血脑屏障通透性的影响[J]. 中华麻醉学杂志,2013,(6):758-760.
[21] 陈图锋,黄婵燕,方佳峰,等. 右旋美托咪啶对大鼠脑缺血再灌注损伤的保护作用及机制[J]. 中山大学学报(医学科学版),2013,(6):851-855.
(收稿日期:2019-12-18)

