具有抗氧化和抑菌能力的益生性乳酸菌筛选及鉴定
王惋,侯俊财,于彤,姜瞻梅,田波,王玉堂,焦月华,刘飞*
1(东北农业大学乳品科学教育部重点实验室,黑龙江 哈尔滨,150030) 2(东北农业大学 食品学院,黑龙江 哈尔滨,150030) 3(黑龙江中医药大学药物安全性评价中心,黑龙江 哈尔滨,150040)
乳酸菌(lactic acid bacteria,LAB)广泛存在于人类肠道中,构成一个平衡的微生态系统。乳酸菌产生的有机酸能将食物中的蛋白质部分降解为小分子肽和游离氨基酸,易于胃肠消化吸收,也可使钙、磷、铁等元素处于离子状态,提高利用率。同时,乳酸菌及其代谢产物可诱导产生干扰素和促细胞分裂剂,对巨噬细胞的β-半乳糖苷酶活性和巨噬细胞的吞噬活性等具有显著的激活和促进作用,能够增强人体免疫力,并在一定程度上预防肿瘤等疾病[1]。乳酸菌对机体的免疫反应、肿瘤发生、衰老过程和应激反应等发生均有重要作用[2]。乳酸菌作为一种优质天然抗氧化剂,其抗氧化功能备受关注。结合乳酸菌具有的保健特性和天然无毒、能贯穿食品加工过程等特点,势必成为人们首先考虑的新型抗氧化剂[3]。细菌素是一类由乳酸菌在发酵代谢过程中产生的具有抑菌活性的肽类或蛋白类物质。具有绿色无公害、无残留和较高安全性等优点,能够替代食品运输和保鲜过程中的传统化学防腐剂,被公认为食品运输和保藏技术中最具有开发和应用前景的物质[4]。筛选出抗氧化活性强且具有抑菌性的乳酸菌并开发成普通食品或功能食品,具有推动作用,势必会带来良好的经济效益和社会效益。
耐受胃肠道消化是外源益生菌要想在肠道中定植的必要前提,只有具备这些特性,才能在肠道中存活并发挥其益生特性[5]。本研究是将分离的乳酸菌进行耐酸性、耐胆盐筛选,随后对筛选出的耐胁迫能力强的菌株进行疏水性和抗氧化性能力测定,最后对供试乳酸菌进行抑菌性实验并对筛选菌株进行鉴定。随着微生物分类学技术的不断进步,新的乳酸菌菌种不断被发现,16S rDNA技术能体现不同菌属之间的差异,又能利用测序技术较容易地得到其序列,可以作为细菌群落结构分析最常用的系统进化标记分子。近年来管家基因pheS和rpoA被用来在种的水平上鉴别乳酸菌菌株,是鉴定争议菌株的有力工具,具有快速简便、重复性好、高区分力的特点,是检测物种最有效的方法。本实验旨在筛选出品质优良的乳酸菌菌株,为合理开发利用乳酸菌奠定基础。
1 材料与方法
1.1 材料与试剂
自主保藏的由传统发酵蔬菜中分离到的18株乳酸菌(A1-A18)。MRS肉汤培养基、邻二氮菲、FeSO4、H2O2、DPPH自由基、K3[Fe(CN)6]、FeCl3等,所有试剂均为分析纯。
1.2 仪器与设备
紫外可见分光光度计(UV1902PC),上海奥析科学仪器有限公司;PCR扩增仪(A600),杭州朗基科学仪器有限公司。
1.3 实验方法
1.3.1 乳酸菌的耐受性及疏水性测试
1.3.1.1 耐酸性菌株筛选
参照ABOLFAZL等[6]的方法,将活化的二代菌株离心(4 ℃,4 000 r/min,10 min),收集沉淀的菌体细胞,用pH 3.0的PBS溶液(10×0.01 mol/L)重悬,37 ℃下孵育2 h。采用平板涂布法计算乳酸菌在pH 3.0条件下0和2 h的活菌数量。
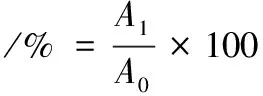
(1)
式中:A0,0 h时的单位体积活菌个数;A1,2 h时的单位体积的活菌个数。
1.3.1.2 耐胆盐测试
参照SUCCI等[7]的方法,将完整菌体细胞用含0.30%牛胆酸钠的PBS溶液(10×0.01 mol/L,pH 7.4)重悬,37 ℃下孵育2 h。采用平板涂布法计算乳酸菌在0.30%牛胆酸钠中孵育0和2 h的活菌数量[7]。
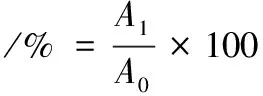
(2)
式中:A0,0 h时的单位体积活菌个数;A1,2 h时的单位体积的活菌个数。
1.3.1.3 产酸能力试验
将保藏菌株按体积分数2%的接种量接种于MRS肉汤培养基中,37 ℃静置培养24 h,每隔2 h取样测pH。得到各菌株产酸的pH值动态变化曲线。
1.3.1.4 疏水性试验
参照李华等[8]的方法,用PBS溶液(10×0.01 mol/L,pH 7.4)调节菌体细胞的OD600至0.8(B0)。将4 mLB0与400 μL二甲苯充分混合,旋涡振荡3 min后,静置30 min,分层后取水相,测定OD600 nm值。
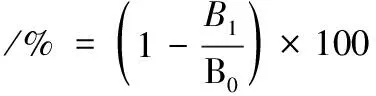
(3)
式中:B1,最终水相的吸光度。
1.3.2 乳酸菌的抗氧化性分析
将菌体细胞用PBS溶液(10×0.01 mol/L,pH 7.4)重悬至浓度为108CFU/mL,为完整细胞悬液(intact cell,IC)。将IC用冰水浴超声波处理10 min(超声、间隔各5 s),离心保留上清液,得到无细胞提取物(cell-free extract,CFE)。
1.3.2.1 羟自由基清除能力分析
参照LIU等[9]的方法测定乳酸菌羟自由基的清除能力,羟自由基清除率按公式(4)计算:
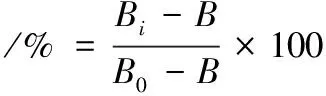
(4)
式中:Bi,样品组吸光度;B0,无样品无H2O2组溶液吸光度;B,无样品组溶液吸光度。
1.3.2.2 DPPH自由基清除能力分析
参照刘洋等[10]的方法测定乳酸菌DPPH自由基清除能力,DPPH自由基清除率按公式(5)计算:
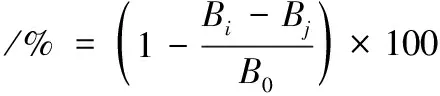
(5)
式中:Bi,样品组吸光度;B0,蒸馏水代替样品溶液吸光度;Bj,无水乙醇代替DPPH无水乙醇溶液吸光度。
1.3.2.3 还原性测定
参照LIN等[11]的方法测定乳酸菌的还原能力,测定OD700 nm值。
1.3.3 乳酸菌抑菌能力分析
采用牛津杯双层琼脂法[12]测定乳酸菌的抑菌能力,抑菌能力以抑菌圈直径表示。
1.3.4 筛选乳酸菌菌株的鉴定
1.3.4.1 16S rRNA基因同源性分析并构建系统发育树
参照张兴吉等[13]的方法扩增筛选菌株的16S rRNA基因,将PCR扩增产物进行电泳并观察条带。将PCR扩增产物送至上海生工进行测序。用Nucleotide BLAST和MEGA 6.0软件构建系统发育树。
1.3.4.2 管家基因同源性分析及系统发育树构建
将菌株的管家基因苯丙氨酰基tRNA基因(pheS)和RNA聚合酶α亚基基因(rpoA)进行扩增,扩增体系及引物序列参照SABRI等[14]的方法,退火温度为55 ℃。将PCR产物送交上海生工进行测序,同源性分析后用MEGA 6.0软件构建系统发育树。
1.4 统计分析
使用IBM SPSS Statistx 20.0(SPSS Institute Inc, U.S.A)的单因素方差分析处理数据,图像由Origin 8.5(OriginLab Institute Inc, U.S.A.)处理。
2 结果与分析
2.1 抗胁迫能力及疏水性
2.1.1 乳酸菌酸耐受性
耐酸性结果见表1,所测试的18株乳酸菌存活率从23.7%~99.1%不等。经耐酸耐胆盐处理后活菌数在106CFU/mL以上就可以发挥其功能特性,可以说明存活率在75%以上的菌株具备很好的酸耐受性。其中有9株菌的存活率在75%以上,其中A15的存活率达到了97%以上。益生菌在人体胃液的条件下是否存活对其是否能够到达肠道起着决定性作用[15]。

表1 pH 3.0条件下18株乳酸菌的存活率单位:%
注:不同小写字母表示差异显著(P<0.05)(下同)
2.1.2 乳酸菌胆盐耐受性
菌株对小肠内胆盐耐受性是筛选乳酸菌的基本标准之一,人体小肠中胆汁盐含量在0.03%~0.3%范围内波动,其耐受力的高低意味着该菌株在肠道中存活能力的高低[16]。耐胆盐结果如表2所示,18株乳酸菌对胆盐都具有耐受性,但是不同菌株对胆盐的耐受性有所不同。A15在0.3%牛胆盐环境下存活率达67.3%,胆盐耐受性最好;而菌株A10在0.3%的胆盐环境时的耐受性最差,存活率仅为19.1%。18株乳酸菌对胆盐的耐受能力有所差异,这可能因为菌株对胆盐的耐受能力与乳酸菌的胆盐水解酶含量和自身的特性有关[7]。
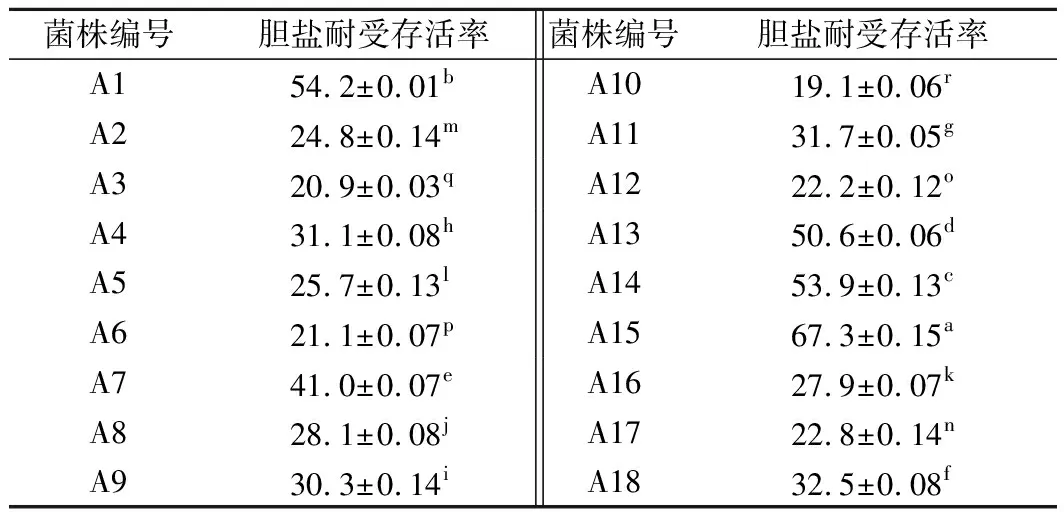
表2 0.3%牛胆盐条件下18株乳酸菌的存活率 单位:%
2.1.3 乳酸菌的产酸能力
结合耐酸性和耐胆盐实验结果,筛选出菌株A1、A7、A13、A14、A15进行产酸能力实验。如图1显示,5株乳酸菌从接种到4 h之间,pH变化很小,说明菌株的增殖缓慢,生理状态延滞;4~14 h时期,pH值的变化加快,说明此期间细胞代谢活跃,生长速度加快,细胞繁殖力强;从第14小时开始pH值变化趋缓,菌株进入稳定期。其中菌株A15在24 h时pH值到达最低,3.68。

图1 乳酸菌在不同时间的产酸能力曲线Fig.1 Acid yield curve of lactic acid bacteria atdifferent time
2.1.4 疏水性试验
如图2所示,根据MATH标准[8],除菌株A13之外,均为高疏水性。其中菌株A14疏水率高达82.0%。疏水性是影响乳酸菌黏附性的主要因素,龚虹等[17]通过研究发现,益生菌生物膜疏水能力与黏附能力呈正相关,可作为考察菌株黏附能力的指标。DEL等[18]也研究了双歧杆菌的黏附与疏水性关系,结果表明具备高菌体表面疏水性的乳酸菌具有更高的黏附力。黏附性强的乳酸菌更容易在人体肠道中定植,在人体中发挥益生作用[19]。
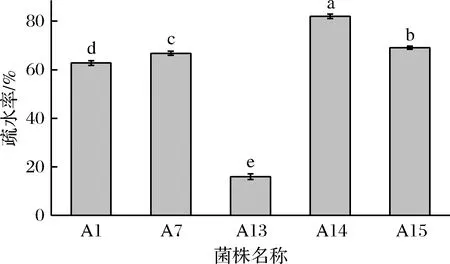
图2 5株乳酸菌的表面疏水性Fig.2 Surface hydrophobicity of five strains of lacticacid bacteria
2.2 筛选菌株的抗氧化性能力
2.2.1 对羟自由基的清除能力
如图3所示,菌株A15完整细胞的羟自由基清除能力最强,达39.29%,且与其余3株菌的完整细胞差异显著(P<0.05)。同一菌株中完整菌体细胞的羟自由基清除能力比无细胞提取物强的多。这与王曦等[20]的结论相同,因为完整菌体细胞中含有大量的谷胱甘肽还原酶、过氧化物酶等,能直接清除机体自由基[21]。同时,氧化氢酶和谷胱甘肽过氧化物酶会将H2O2分解成H2O和O2,从而防止羟自由基的形成[22]。正是由于这些抗氧化物质在乳酸菌中的种类差异或同种抗氧化物质的多少不同,导致不同乳酸菌的羟自由基清除能力差异显著[23]。
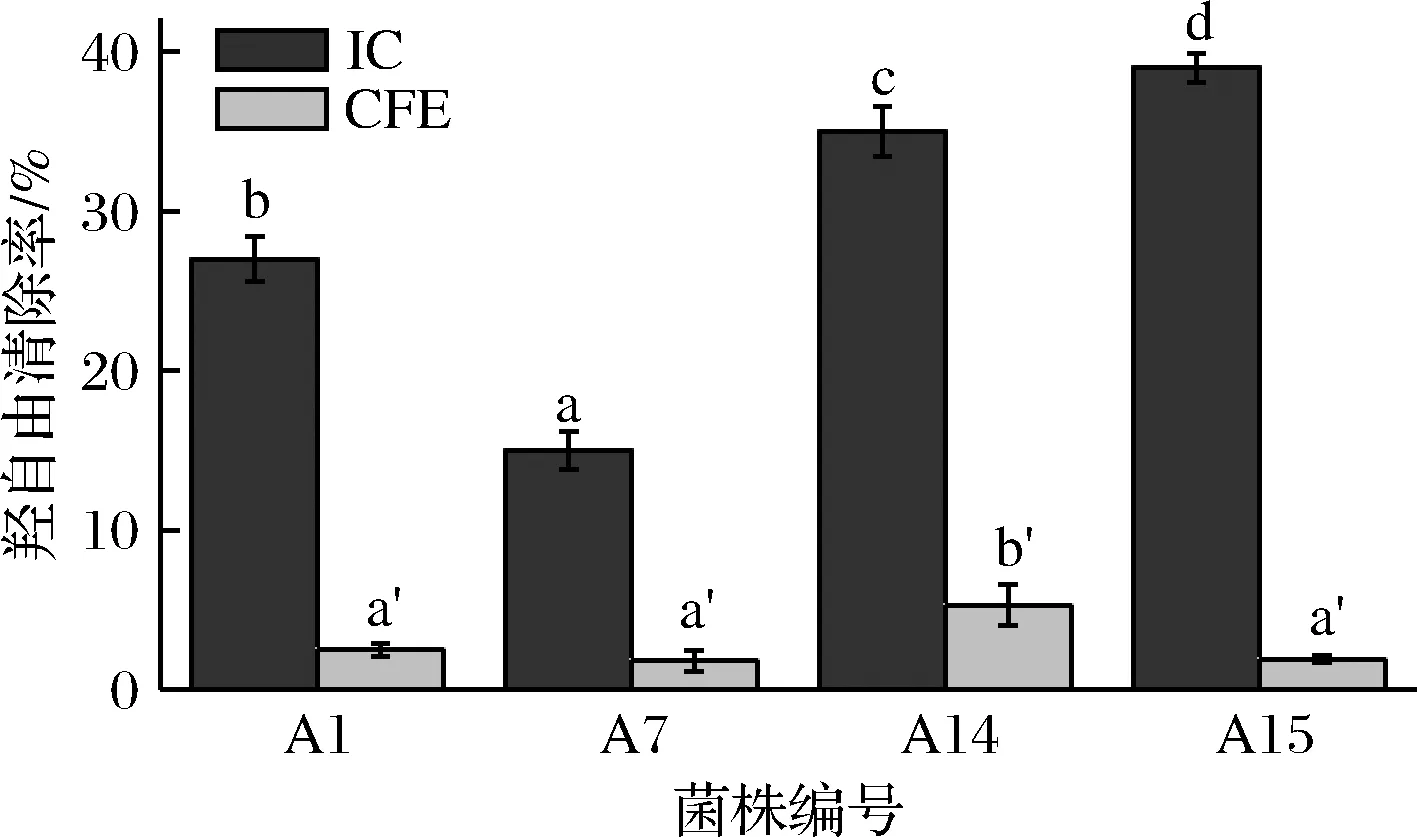
图3 乳酸菌完整细胞和无细胞提取物的羟自由基清除率Fig.3 The removal rate of hydroxyfree radical of IC andCFE of lactic acid bacteria
2.2.2 对DPPH自由基的清除能力
由图4可知,菌株A15的IC和CFE的DPPH自由基清除能力均是最强的,并且IC组的DPPH自由基清除能力均比CFE组强,这是因为完整菌体细胞可以产出胞外多糖,多糖具有一定的供氢能力,通过氢原子转移或电子转移,对DPPH自由基发生中和作用[24]。CHEN等[25]报道了多糖中作为电子供体的侧链糖苷键中的羟基能够结合自由基离子,自由基链反应才得以终止。
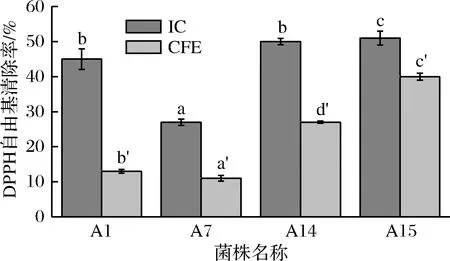
图4 乳酸菌完整细胞和无细胞提取物的DPPH·自由基清除率Fig.4 The removal rate of DPPH· free radicals of IC andCFE of lactic acid bacteria
2.2.3 乳酸菌的还原活性
由表3可知,菌株A15的还原能力最强,A7还原能力最弱。4种乳酸菌CFE的还原能力明显弱于IC。完整菌体细胞中存在氧化还原调控系统,此外,半胱氨酸残基中的巯基具有接收电子的作用,其大量存在于谷胱甘肽中,巯基能够以氧化还原酶的辅基形式存在,从而避免氧化应激反应对机体造成的危害,避免蛋白等生物大分子的损伤[26]。

表3 乳酸菌完整细胞和无细胞提取物的还原能力 单位:μmol/L L-半胱氨酸
注:同一列中不同小写字母表示差异显著(P<0.05)(下同)
2.3 乳酸菌的抑菌能力
菌株的抑菌圈直径结果见表4,只有A15对2种指示菌均有抑制作用,而表1的结果表明菌株A15的酸耐受性最强,并且由图1可知菌株A15具有较强的产酸能力,使得其对酸性环境具有最强的适应能力。因此,菌株A15发挥抑菌作用的主要原因可能是其代谢产物中的各种有机酸[27]。一般来说,酸性条件会增强其抑菌物质活跃度,提高抑菌效力。KOGA等[28]将培养上清液用过氧化氢酶处理,发现抑制区保持不变。当乳酸菌培养上清液的pH 6.5时,没有观察到抑制区。这表明乳酸菌产生的抗菌作用是由于有机酸的产生。乳酸和乙酸能够使细胞质酸化,阻碍细胞内质子的运动,从而迅速降低细胞的新陈代谢,导致菌体细胞的生长缓慢,最终死亡[29]。

表4 乳酸菌对2种指示菌的抑菌圈直径 单位:mm
注:“-”表示未检测出
2.4 乳酸菌的16S rRNA基因相似性分析结果
根据图5中16S rRNA基因序列的系统发育树可以确定4株菌中,1株为肠球菌,其余3株菌为乳杆菌。其中菌株A1与EnterococcusfaeciumLMG 11423和EnterococcuslactisBT159的16S rRNA基因序列相似性都为99.8%,通过16S rDNA序列分析的分类学地位,仅能确定菌株A1属于肠球菌属;菌株A7确定其为副干酪乳杆菌;由于LactobacillusplantarumJCM 1149和LactobacilluspentosusATCC8041的16S rDNA序列相似性大于99%,无法确定菌株A14和A15的分类学地位,仅能确定它们都属于乳杆菌,需进一步的鉴定实验才能确定其具体的分类学地位。
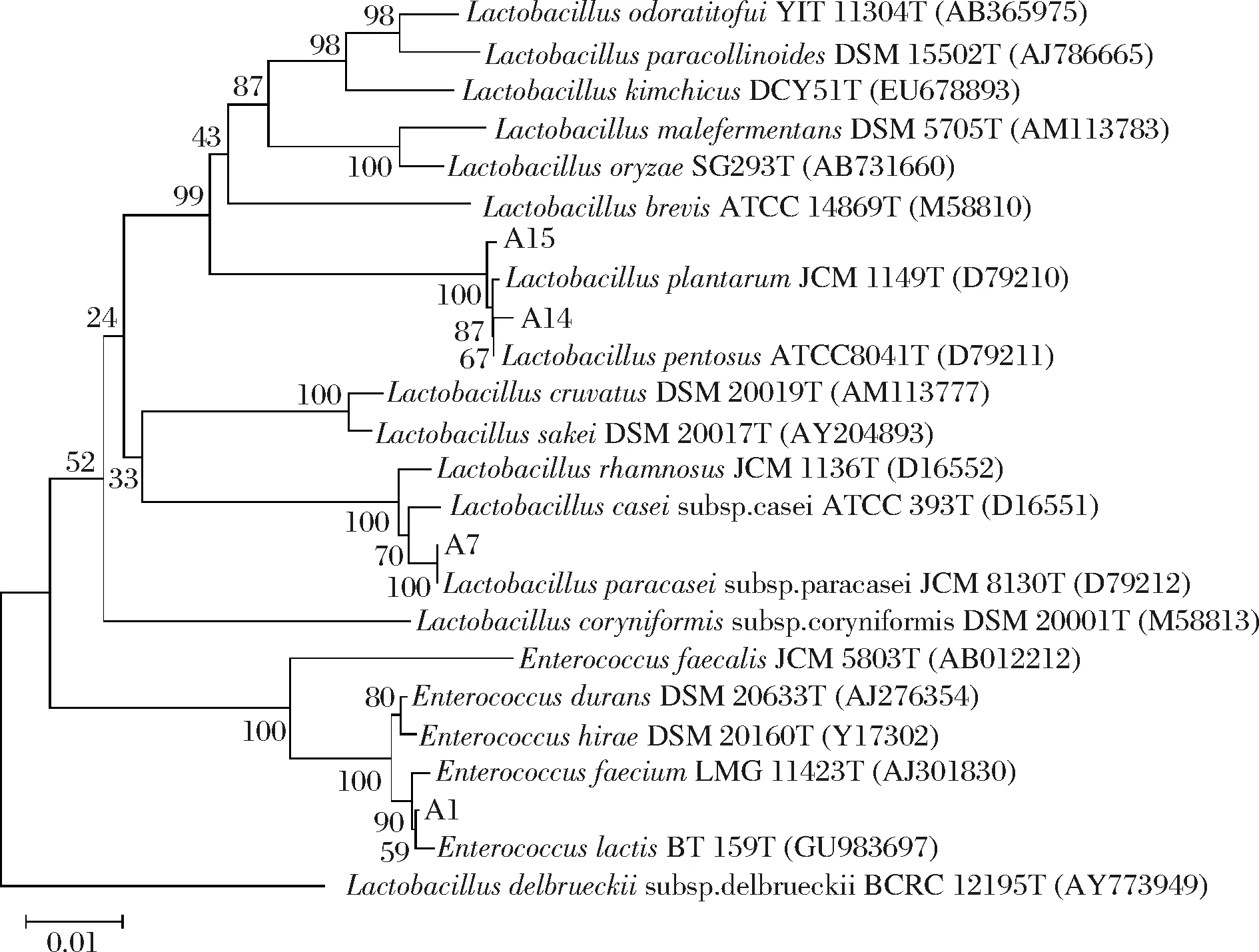
图5 乳酸菌16S rRNA基因序列的系统发育树Fig.5 The phylogenetic tree of lactic acid bacteria basedon 16S rRNA gene sequences
2.5 筛选菌株的pheS基因和rpoA基因同源性分析结果
管家基因pheS系统发育树分析结果见图6-a。可以确定菌株A14为植物乳杆菌,菌株A1为乳肠球菌。菌株A15与菌株Lactobacillusplantarumsubsp.plantarumLMG 6907和LactobacillusarizonensisLMG 19807的pheS基因序列相似性都为100%,因此无法确定A15的分类地位。进一步采用管家基因rpoA同源性比较对其进行分析,系统发育树见图6-b,可以确定菌株A15是植物乳杆菌植物亚种。
植物乳杆菌和戊糖乳杆菌的16S rDNA序列相似性高达99%,通常利用传统的16S rDNA分子生物学鉴定方法无法将两者准确鉴定。OGUNTOYINBO等[30]通过利用pheS和rpoA的基因测序方法,在16S rDNA分子生物学鉴定方法的基础上阐明了所分离出的植物乳杆菌与戊糖乳杆菌以及副植物乳杆菌间的密切关系。因此,本研究的鉴定结果与孟令帅等[31]的研究结果相比,更加准确完善。
3 结论
18株乳酸菌筛选得到4株耐酸、耐胆盐效果良好、产酸能力强、疏水性高的乳酸菌。4株菌的完整细胞悬液抗氧化能力远高于无细胞提取物,其中菌株A15的抗氧化能力最强。菌株A15完整细胞悬液的羟自由基和DPPH自由基清除率分别为39%和51%,菌株A14完整细胞悬液的羟自由基和DPPH自由基清除率分别为35%和50%。菌株A15和A7均可抑制大肠杆菌,此外菌株A15还对金黄色葡萄球菌有抑制作用。经16S rRNA基因、管家基因pheS和rpoA的序列同源性分析,确定菌株A7为副干酪乳杆菌、菌株A1为乳肠球菌、菌株A14为副植物乳杆菌、菌株A15为植物乳杆菌植物亚种。本研究所筛选的益生性乳酸菌菌株为其进一步应用于开发新型营养健康食品奠定了基础。

a-pheS序列;b-rpoA序列图6 乳酸菌pheS序列和rpoA序列的系统发育树Fig.6 The phylogenetic tree of lactic acid bacteria based onpheS and rpoA sequences

