刺梨GL2同源基因的克隆、系谱树和表达分析
黄小龙 陈婷婷 张琴琴 莫佳佳 龚盼琴 闫慧清

摘 要:為了观察刺梨果实的果刺细胞学发育过程,该研究以刺梨‘贵农5号的cDNA为模板,通过RACE克隆获得刺梨中与拟南芥表皮毛形成GL2的同源基因RrGL2,并对该基因进行生物信息学分析和表达分析。结果表明:(1)刺结构在花芽形成早期基部内的细胞首先不断分裂,向外继续发育,中部的细胞变细、变长形成“针”状结构,顶部的细胞逐渐木质化使刺变硬,形成果刺。(2)通过RACE扩增得到RrGL2的cDNA全长2 292 bp,编码763 aa氨基酸。(3)RrGL2具有Homeodomain同源结构域和StAR磷脂酰胆碱转移蛋白的结构域,RrGL2与其他物种编码的GL2氨基酸同源性高度相似,并且系谱树分析揭示刺梨RrGL2和野草莓的GL2密切相关。(4)qRT-PCR分析表明,RrGL2在茎和果实中的表达水平高于其他组织,在花后7周果刺中的表达最高,是3周和5周果刺中的7.87倍和2.10倍。综上结果发现RrGL2的功能与果刺的形成发育密切相关,该研究为刺梨中刺形成的分子机制和育种提供了理论基础。
关键词:刺梨,表皮毛,果刺,RrGL2,基因表达
中图分类号:Q949.45文献标识码:A
Abstract:In order to observe cytological development of prickles in fruits of Rosa roxburghii, R. roxburghii GLABROUS 2 (RrGL2),a prickle-development related AtGL2 homology gene,was isolated from ‘Guinong 5 and relative biological information and expression were analyzed in this paper. The cytological development of fruit thorn of Rosa roxburghii was observed by paraffin section. Leaves of Rosa roxburghii was used to synthesize cDNA based on the manufacturers instructions of RACE. Subsequently RrGL2 was made relative informatics analysis and the gene expression level was eva-luated. The results were as follows:(1) The base cells continuously divided at the early stage of flower bud,then outward developed. The middle cells continued to become thinner and longer to form a “needle” structure. In the early stage of flower bud formation,the cells in the base of the thorn structure first divided continuously and continued to develop outwards. The cells in the middle became thinner and longer,forming a “needle” structure. The lignification gradually was observed at the top cells to make the prickles hard. (2) The full lengths of RrGL2 was 2 292 bp by RACE,encoding 763 amino acids. (3) The RrGL2 had a structure of Homeodomain and StAR phosphatidylcholine transfer protein,which is likely to regulate the development of Rosa roxburghii prickles. Then,a search for homologous species in the NCBI databases revealed a high similarity of amino acid homology encoded by the RrGL2 with other Rosa species,and phylogenic analysis revealed a close relationship of structure domains between Rosa roxburghii and Fragaria vesca. (4) Finally,real-time PCR analysis showed that the relative expression value of RrGL2 in fruit prickles after seven weeks after flowering was the highest,almost respectively 7.87 times and 2.10 times than that during three weeks and during five weeks after flowering. RrGL2,a prickles-forming gene acted to regulate the morphology and development of prickles. Therefore,the function of RrGL2 is closely related to thorn formation. These results could provide theoretical basis for thorn formation and development.
Key words:Rosa roxburghii,trichomes,prickles,RrGL2,gene expression
刺梨(Rosa roxburghii)为蔷薇科多年生落叶灌木缫丝花的果实,因具有良好的风味和较高的营养价值深受消费者喜爱,在中国西南地区尤其是贵州省大规模种植。果实中因含有一些酚类化合物、抗氧化物等(Van et al.,2008),可作为放射性保护剂和肿瘤抑制剂(Liu et al.,2012;Xu et al.,2014);同时也是果汁和干果的重要原料。然而,刺梨果实密披果刺,果刺对水果采摘、食品加工、田间和果园管理造成不便。近年来随着园艺业的发展,植物果刺已经引起越来越多的关注。
刺是广泛存在于许多植物中由表皮组织生长所形成的渐尖突起(Kellogg et al.,2011),可存在于叶、茎、果实和其他器官(Feng et al.,2015)。刺的存在增加植物表皮厚度,减少热量和水分的散失,防止昆虫和病原体的侵袭或机械损伤(Gomes et al.,2012)。覆盆子和玫瑰的刺来源于修饰的腺毛,它们继续生长并最终硬化成最终的刺状形态,作为表皮组织的外生物。因此,刺是表皮毛与少数皮层细胞的变形所形成的;表皮毛是植物器官表面一种特殊的单细胞结构;表皮毛发育所需基因的时空表达受一种三元激活复合物协调(An et al.,2011)。植物表皮毛发育的调节特别是在拟南芥中的研究取得了很大的进展。通过转录因子MYB[GLABRA 1(GL1)、WEREWOLF、CAPRICE、TRIPTYCHON];WD-40型[(TRANSPARENT TESTA GLABRA 1(TTG1];bHLH[GLABRA 3(GL3)];ENHANCER of GLABRA 3(EGL3);HD-zip[GLABRA2(GL2)]和WRKYl类转录因子[TRANSPARENT TESTA GLABRA2(TTG2)](Zhao et al.,2008; Gan et al.,2011)。酵母双杂交实验得到GL1和TTG1可以结合到GL3和EGL3的不同区域,表明MYB-bHLH-WD40复合物可形成三聚体转录激活成分,并调控表皮毛发育的下游基因和形态发生(Pesch et al.,2015; Ramsay & Glover,2015)。GL2可通过反馈机制激活参与表皮毛成熟的TTG1复合体来切换MYB-bHLH-WD40复合体的功能。在表皮毛和根毛的形成过程中,两个相邻的细胞能够相互竞争GL2/TTG1等表达调控因子(Pu et al.,2003)。
GL2在表皮毛形态发生中发挥着重要作用,包括细胞分枝、扩张和细胞壁成熟(Szymanski et al.,1998)。GL2是一种同源框基因,编码含有StAR(steroidogenic acute regulatory protein)结构域的HD-Zip转录因子。这种同源框蛋白可在植物不同的发育过程中协调靶基因的表达(Rerie et al.,1994; Di & Al,1996)。GL2在成熟表皮毛中持续表达,并且是在早期形态发生中非根毛细胞和表皮毛分化所必需(Fyvie et al.,2015)。前人研究表明,GL2是调节根毛发育所必需的,并且优先在根的分生组织和伸长区域内的非毛发表皮细胞中表达(Masucci et al.,1996)。GL2突变体和GL2/GL3双突变体均影响表皮毛的形态发生,使叶片上的表皮毛降解和减少,同时GL2突变体还具有种皮粘液缺乏、形成异位根毛等表型(Gao et al.,2008; Shi et al.,2012)。此外GL2突变体不能形成围绕表皮毛的毛状辅助细胞。遗传实验表明,GL2是GL1和TTG1的下游调控基因 (Pesch & Hülskamp,2011)。
本研究利用贵州省广泛种植的‘贵农5号分离克隆与果刺发育有关的RrGL2,对RrGL2基因进行了生物信息分析和时空表达检测,可为进一步研究刺梨果刺形成和发育的分子机制以及通过基因工程培育刺梨无刺果实提供了遗传资源和理论基础。
1 材料与方法
1.1 植物材料和细胞学分析
采集刺梨‘贵农5号的叶片和果实后,一部分立即在液氮中冷冻并储存在-80 ℃。选择叶、幼果和成熟果实并收集花后3周、5周和7周的果刺以检测RrGL2的表达水平。另一部分通过体视显微镜(SZX7,OLYMPUS,Japan)观察并拍照。
采摘不同时期的幼芽用FAA固定液固定,先在离心管中装入3 mL固定液,将样品放入固定液中,封口膜封口,用解剖针在封口膜上扎几个小孔,然后抽真空,抽过真空后再加入2 mL固定液(样品与固定液之比约为1∶20)。若长期保存应将固定液换成70%酒精,4 ℃冰箱保存。第1天用70%酒精过夜,第2天用85%酒精、95%酒精、无水酒精、无水酒精、1/5二甲苯、2/5二甲苯、3/5二甲苯、4/5二甲苯、純二甲苯进行梯度洗脱,纯二甲苯处理后加碎蜡(放入36 ℃烘箱,放置3 d以上)洗涤。将已固着和修好的蜡块装在样品固定器上,并固定好。将切片刀装在切片机上。调节刀片的厚度为8~15 μm。
将切出的蜡带,平展于盒内以供展片。之后经显微镜(BX53,Olympus,Japan)观察,SPOT FLEXTM CCD拍摄(Diagnostic Instrument,USA)。
1.2 RNA提取和纯化
使用Trizol试剂(TaKaRa,Japan)提取茎、叶片、花芽、种子和花后3周、5周和7周的皮刺部位的总RNA,具体步骤参考试剂盒说明。先用DNA酶(TaKaRa,Japan)处理RNA样品。然后根据试剂盒说明使用oligo dT-接头引物的RT-PCR Kit(TaKaRa,Japan)将提取的RNA进行逆转录。
1.3 分离GL2 cDNA
1.3.1 3′RACE的合成 利用3′ RACE(TaKaRa,Japan)试剂盒以刺梨叶片提取的RNA进行第一链cDNA合成。根据NCBI(https://www.ncbi.nlm.nih.gov/)下载的其他生物所报道的与果刺发育有关的GL2同源序列设计引物。用引物进行两轮PCR扩增基因的3′ 末端(表1)。第一轮PCR:首先94 ℃变性3 min,然后进行20个循环的扩增(94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min)和最后72 ℃延伸10 min。然后以第一轮PCR产物作为第二次PCR扩增的模板,并且在与第一轮PCR相同的条件下运行35个循环。
1.3.2 5′RACE的合成 根据SMARTerTM RACE cDNA扩增试剂盒(No.634923,Clontech),以叶片总RNA为模板合成cDNA第一链。按照上述3′末端的序列合成基因特异性引物(表1)进行Touch-down PCR:首先(94 ℃,30 s;72 ℃,90 s)5个循环,然后(94 ℃,30 s;70 ℃,30 s;72 ℃,1 min)5个循环,最后(94 ℃,30 s;55 ℃,2 min;72 ℃,2 min)30个循环。
1.4 克隆和测序
PCR产物用1%琼脂糖凝胶检测,挖胶回收后以琼脂糖凝胶DNA纯化试剂盒(DV805A,TaKaRa,Janpan)纯化,克隆到pMD18-T载体(TaKaRa,Janpan)中,最后热激法转化大肠杆菌DH5α菌株(Trans,China)。阳性克隆由上海生工生物工程技术服务有限公司(中国上海)测序。
1.5 序列分析
使用NCBI ORF finder对PCR扩增获得的GL2开放阅读框片段进行分析。通过NCBI BLASTp获得RrGL2同源蛋白。使用ProtParam分析蛋白质的分子量、等电点和氨基酸组成。用ProtScale的Kyte & Doolittle方法预测这些蛋白质的亲水性或疏水性。TMHMM 2.0服务器(http://www.cbs.dtu.dk/services/ TMHMM/)用于预测蛋白质的跨膜结构域。SMART在线预测蛋白质结构域。ESPript 3.0(http://espript.ibcp.fr/ESPript/ESPript/)预测蛋白质二级结构。Mega6.0软件Neighbor-Joining法用于构建系谱树。
1.6 基因表达检测
使用FastStart DNA Master SYBR Green I试剂盒在LightCycler 480仪器(Roche,Switzerland)中进行RrGL2的qRT-PCR检测。β-actin作为内参基因。引物为RrGL2,Forward (5′-3′):CGAGGCAGTGACAGTGAAGG; Reverse (5′-3′):GGCAGACTCAACAGACTCCATAG。β-actin Forward (5′-3′):CCGCCATGTA TGTTGCCATCC; Reverse (5′-3′):AGCCAGGTCAAGACGCAGAAT。
qRT-PCR程序根据SYBR说明书进行,扩增进行40个循环:在95 ℃变性30 s,在55 ℃退火30 s,并在72 ℃延伸1 min。相对于对照的表达水平通过计算△△Ct[(△△Ct=sample △Ct-control △Ct),△Ct= RrGL2 Ct -(β-actin)Ct],然后用2-△△Ct方法分析。
1.7 统计分析
本研究中的所有数据均为三次生物学重复的平均值和相应的标准偏差表示。使用SPSS单因素方差分析方法分析获得的数据,Duncan多重检验以比较统计显著性差异(P<0.05)。
2 结果与分析
2.1 刺梨不同组织的观察和早期细胞学研究
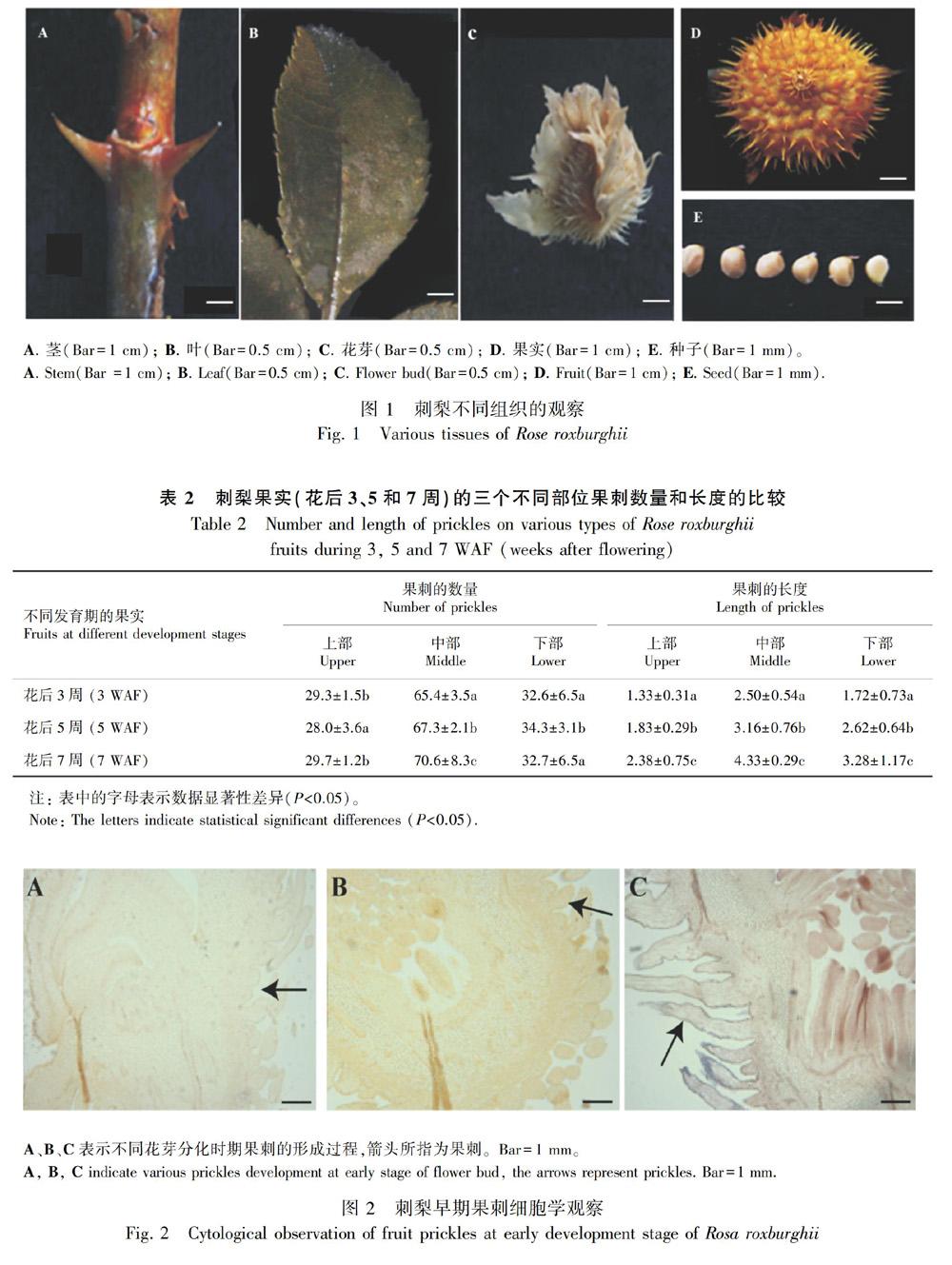
分别选取刺梨的不同部位观察,如图1所示,包括的组织有茎(图1:A)、叶(图1:B)、花芽(图1:C)、果实(图1:D)和种子(图1:E)。在茎和果实的组织表面上观察到有一些坚硬的刺,分别为枝刺和果刺。在花芽最外的部位也存在少量刺的形态,叶片和种子外表面没有出现坚硬的刺。
进一步选取不同发育阶段的果实进行果刺数量和长度的统计,如表2所示。选取花后3、5和7周形成的果实,此时刺梨果实的直径分别是1.5、2.3和3.4 cm。将果实分为三个部位进行统计,分别为上部、中部和下部。从表2可以得到,在不同的发育时期,果刺的数量均主要集中在中部,上部和下部数量较少。随着果实的发育,三个部位果刺的长度均发生显著性的增加。
刺梨经过一定时间的营养生长后,在外界各因素达到一定要求时进入生殖生长阶段,这是刺梨果实形成的必经阶段。当刺梨进入生殖生长时期,刺梨茎端分生组织细胞开始分裂分化,在花的发育过程中刺梨萼片上的刺细胞也开始不断发生。花的发育是一个动态的过程,最初观察到花萼上有少量已经形成的刺结构,随着花的发育,萼片上刺结构会成批次的产生,逐渐增多(图2:A)。当花的结构慢慢向外展开时,在花瓣原基基部处,雄蕊原基开始慢慢发育形成一些粗而短的近似椭圆形的结构,刺原基突起內的基本分生组织细胞进行切向分裂,细胞数目开始增加,表皮上的细胞也进行分裂以适应刺的向外延伸(图2:B)。基部内的细胞迅速分裂使基部扩展变大,中部细胞增多,形态也发生变化,椭圆形的细胞开始变细、变长,尖端呈“针”状型结构,刺结构的整体外形初步形成(图2:C)。
2.2 刺梨RrGL2的序列分析
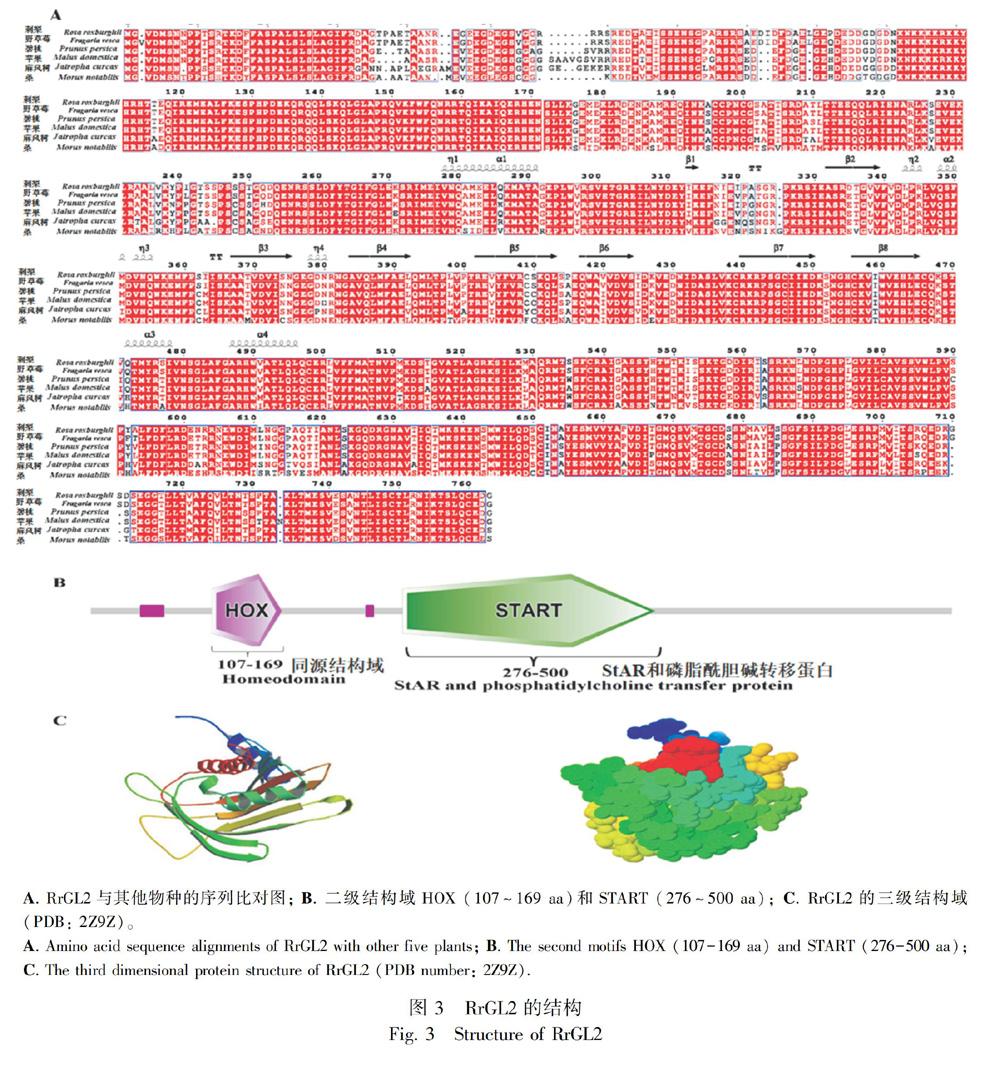
以‘贵农5号的RNA为模板,通过RACE方法得到RrGL2的全长cDNA。RrGL2(Genebank登录号:MG386498)的全长为2 292 bp,编码763个氨基酸。BLAST分析表明,刺梨的RrGL2序列和野草莓(Fragaria vesca)、碧桃(Prunus persica)、苹果(Malus domestica)、麻风树(Jatropha curcas)和桑(Morus notabilis)GL2具有较高的同源性,分别是96%、88%、86%、78%和80%的相似性。
ProtParam分析RrGL2得到其分子量为8.49 kDa。RrGL2的等电点是5.73。 RrGL2含有13.76%的酸性氨基酸、13.63%的碱性氨基酸、38.79%的疏水性氨基酸、27.39%的带电荷氨基酸和61.07%的极性氨基酸。ProtScale分析RrGL2得到其亲水性氨基酸的数量明显大于疏水性氨基酸的数量,且亲水性的平均值为-0.525,表明RrGL2编码的蛋白质为可溶性蛋白质。TMHMM2.0预测表明RrGL2不含有跨膜结构域。
2.3 RrGL2的同源蛋白和系谱树分析
将不同物种的GL2进行比对分析(图3:A)。BLAST分析表明,RrGL2和野草莓(Fragaria vesca)、碧桃(Prunus persica)、苹果(Malus domestica)、麻风树(Jatropha curcas)和桑(Morus notabilis)的蛋白质序列相似性较高,分别是98%、92%、90%、83%和82%相似性。
基于RrGL2的三维结构(PDB编号:2Z9Z),利用ESPript 3.0得到蛋白质的二级结构和三级结构。如图3:A所示,β-转角是序列的主要二级结构。多序列比对的结果表明,RrGL2与其他物种的二级结构域也较为保守。SMART分析显示RrGL2的结构域包括两个主要结构域,分别是位于107~169氨基酸的同源结构域HOX(homeobox)和位于276~500氨基酸的START(StAR和磷酰胆碱转移蛋白)(图3:B)。图3:C以两种不同的方式显示了RrGL2三维结构,在不同的折叠处,包括转角和不规则的卷曲均可发生与DNA/RNA的结合。使用Mega 6.0软件构建RrGL2的系统进化树图,得到刺梨与其他植物的亲缘关系,如图4所示。图中显示RrGL2与野草莓中的GL2序列最相似。除此之外,RrGL2与其他蔷薇科植物的亲缘关系也较近,如桃、樱桃、梅和苹果。
2.4 RrGL2在不同组织和果实发育的表达模式
利用Real-time PCR获得RrGL2在不同组织中的表达水平,结果如图5所示。RrGL2在种子中的表达量最低,茎和果实的RrGL2表达量分别是种子的59.95倍和33.52倍。叶和花中RrGL2的表达量分别是种子中的7.99倍和15.62倍。
从图5:B中可以看出,花后3、5和7周的果刺中RrGL2表达量。结果表明随着果实的发育和果刺的增加,RrGL2表达量逐渐增加,在花后7周果刺中RrGL2表达量最高,分别是花后3周和5周果刺中的7.87倍和2.10倍,可以推断RrGL2在果刺的形成中发挥一定的作用。
3 讨论
形态观察结果发现刺梨茎上有一些坚硬的刺,果实外表面上密披果刺。通过细胞学观察得到,果刺在花芽阶段已经形成。同时,RrGL2在茎和果中的表达水平高于其他组织,说明RrGL2可能在果刺和表皮毛形态发生中发挥重要作用。研究表明RrGL2作用在果实发育早期的果刺中检测到RrGL2的表达,证明它可能在果实发芽阶段起作用(Ohashi et al.,2002; Vernoud et al.,2009)。随着果实的成熟,果刺的数量和长度都增加。与形态学改变相对应,RrGL2的表达水平也随之提高。这些结果暗示RrGL2可能与刺梨果刺发育起始密切相关(Rerie et al.,1994)。而在花后7周的果实果刺中RrGL2表达量达到最高,暗示与刺发育相关的RrGL2基因能够增加果刺的形成。转录因子EGL3和TTG1参与GL2的表达调控,最终导致表皮毛形成(Song et al.,2015)。MYB类蛋白如GL1和WER,可通过与bHLH蛋白相互作用来调节GL2同源框基因在特定部位的表达。同时GL2的表达还受到CAPRICE MYB的抑制(Lee & Schiefelbein,1999)。RrGL2作为一个关键基因和其他参与调节刺梨果刺发育的基因功能还需要进一步的功能分析确定。
本研究通过RACE技术从刺梨中克隆得到RrGL2。在NCBI blast数据库中搜索获得RrGL2与其他物种的氨基酸结构域的高度相似性的GL2类蛋白成员,表明RrGL2可能与这些物种中的GL2具有类似功能,参与调节果刺的起始,形态发生和发育(Wang et al.,1999)。结构域分析显示RrGL2是一个Homeodomain蛋白。Homeodomain蛋白可结合DNA并调节转录DNA模板,参与形成多蛋白复合物从而调控发育基因的表达(Foronda et al.,2009)。RrGL2的三级结构是DNA/RNA结合螺旋结构和orthogonal结构,这也暗示RrGL2可以与DNA相互作用并控制。同时,GL1和GL3转录因子的相互作用激活GL2的表达(Wang & Chen,2008)。据报道GL2以细胞位置依赖性方式在根毛分化形成过程中调节根毛发育,并影响种子含油量(Masucci et al.,1996; Shen et al.,2006)。
本研究通过生物信息学的分析方法得到RrGL2调节蛋白与其他物种中的直系同源物,展现GL2中正向进化选择的潜力。利用时空表达的检测获得RrGL2在不同组织和果刺不同发育阶段的相對表达水平。因此,本文为揭示和理解参与刺梨果刺发育的基因以及果刺发育分子机制提供了分子基础,为通过基因工程培育更少或甚至无刺刺梨提高理论基础。
参考文献:
AN L,ZHOU Z,YAN A,et al.,2011. Progress on trichome deve-lopment regulated by phytohormone signaling[J]. Plant Signal Behav,6(12):1959-1962.
DI CM,AL E,1996. The Arabidopsis Athb-10 (GLABRA2) is an HD-Zip protein required for regulation of root hair deve-lopment[J]. Plant J Cell Mol Biol,10(3):393-402.
FENG LG,LUAN XF,WANG J,et al.,2015. Cloning and expression analysis of transcription factor Rrttg1 related to prickle development in rose (Rosa Rugosa)[J]. Arch Biol Sci,67(4):1219-225.
FORONDA D,NAVAS LF,GARAULET DL,et al.,2009. Function and specificity of Hox genes[J]. Int J Dev Biol,53(8-10):1404-1419.
FYVIE MJ,MURRAY JA,KILBY NJ,2015. Mosaic analysis of GL2 gene expression and cell layer autonomy during the specification of Arabidopsis leaf trichomes[J]. Genesis,28(2): 68-74.
GAN L,XIA K,CHEN JG,et al.,2011. Functional characte-rization of trichomeless 2,a new single-repeat R3 MYB transcription factor in the regulation of trichome patterning in Arabidopsis[J]. Bmc Plant Biol,11(1):176-187.
GAO Y,GONG X,CAO W,et al.,2008. SAD2 in Arabidopsis functions in trichome initiation through mediating GL3 function and regulating GL1,TTG1 and GL2 expression[J]. J Integr Plant Biol,50(7):906-917.
GOMES S,BACELAR E,MARTINSLOPES P,et al.,2012. Infection process of olive fruits by Colletotrichum acutatum and the protective role of the cuticle and epidermis[J]. J Agric Sci,4(2):101-110.
KELLOGG AA,BRANAMAN TJ,JONES NM,et al.,2011. Morphological studies of developing rubus prickles suggest that they are modified glandular trichomes[J]. Botany,89(4):217-226.
LEE MM,SCHIEFELBEIN J,1999. Werewolf,a MYB-related protein in Arabidopsis,is a position-dependent regulator of epidermal cell patterning[J]. Cell,99(5):473-477.
LIU W,LI S Y,HUANG XE,et al.,2012. Inhibition of tumor growth in vitro by a combination of extracts from Rosa roxburghii Tratt and Fagopyrum cymosum[J]. Asian Pac J Cancer Prev,13(5):2409-2414.
MASUCCI JD,RERIE WG,FOREMAN DR,et al.,1996. The homeobox gene glabra 2 is required for position-dependent cell differentiation in the root epidermis of Arabidopsis tha-liana[J]. Development,122(4):1253-1260.
OHASHI Y,OKA A,RUBERTI I,et al.,2002. Entopically additive expression of glabra2 alters the frequency and spa-cing of trichome initiation[J]. Plant J,29(3):359-369.
PESCH M,HLSKAMP M,2011. Role of triptychon in trichome patterning in Arabidopsis[J]. Bmc Plant Biol,11(1): 130-138.
PESCH M,SCHULTHEI I,KLOPFFLEISCH K,et al.,2015. Transparent testa glabra1 and glabra1 compete for binding to glabra3 in Arabidopsis[J]. Plant Physiol,168(2): 584-597.
PU L,SUO J,XUE Y,2003. Molecular control of plant trichome development[J]. Acta Genet Sin,30 (11):1078-1084.
RAMSAY NA,GLOVER BJ,2005. MYB-bHLH-WD40 protein complex and the evolution of cellular diversity[J]. Trends Plant Sci,10(2):63-70.
RERIE WG,FELDMANN KA,MARKS MD,1994. The glabra2 gene encodes a homeo domain protein required for normal trichome development in Arabidopsis[J]. Gene Dev,8 (12):1388-1399.
SHEN B,SINKEVICIUS KW,SELINGER DA,et al.,2006. The homeobox gene glabra2 affects seed oil content in Arabidopsis[J]. Plant Mol Biol,60(3):377-387.
SHI L,KATAVIC V,YU Y,et al.,2012. Arabidopsis glabra2 mutant seeds deficient in mucilage biosynthesis produce more oil[J]. Plant J Cell Mol Biol,69(1):37-46.
SONG SK,KWAK SH,CHANG SC,et al.,2015. Werewolf and enhancer of glabra3 are interdependent regulators of the spatial expression pattern of glabra2 in Arabidopsis[J]. Biochem Biophys Res Comm,467(1):94-100.
SZYMANSKI DB,JILK RA,POLLOCK SM,et al.,1998. Control of GL2 expression in Arabidopsis leaves and trichomes[J]. Development,125(7):1161-1171.
VAN FH,VAN CS,RAUTENBACH GS,et al.,2008. In vitro antioxidant,antimutagenic and genoprotective activity of Rosa roxburghii fruit extract[J]. Phyto Res,22(3):376-383.
VERNOUD V,LAIGLE G,ROZIER F,et al.,2009. The HD-ZIP IV transcription factor OCL4 is necessary for trichome patterning and anther development in maize[J]. Plant J,59(6): 883-894.
WANG S,CHEN JG,2008. Arabidopsis transient expression analysis reveals that activation of glabra2 may require concurrent binding of glabra1 and glabra3 to the promoter of glabra2[J]. Plant Cell Physiol,49(12):1792-1804.
WANG YL,NIE JT,CHEN HM,et al.,2016. Identification and mapping of Tril,a homeodomain-leucine zipper gene involved in multicellular trichome initiation in Cucumis sativus[J]. Theor Appl Genetics,129(2):305-316.
XU P,ZHANG WB,CAI XH,et al.,2014. Flavonoids of Rosa roxburghii Tratt act as radioprotectors[J]. Asian Pac J Cancer Prev,15(23):8171-175.
ZHAO M,MOROHASHI K,HATLESTAD G,et al.,2008. The TTG1-bHLH-MYB complex controls trichome cell fate and patterning through direct targeting of regulatory loci[J]. Development,135(11):1991-1999.
(責任编辑 周翠鸣)

