酪氨酸激酶抑制剂治疗老年Ph阳性慢性粒细胞白血病的临床观察
杨岚,任慧娟,韩艳秋
内蒙古医科大学附属医院血液科,内蒙古呼和浩特市010050
慢性髓性白血病(chronic myelogenous leukemia,CML)属于一种临床恶性肿瘤,形成于骨髓造血干细胞克隆性增值,PH 染色体(费城染色体) 是CML 细胞遗传学特征性标记,与BCR-ABL 融合基因作为临床诊断该症的必备条件,具有特殊性影响意义[1]。酪氨酸激酶抑制剂(chronic myelogenous leukemia,TKI)属于低分子多靶点药物,治疗CML 可使患者8年OS率提升至87%,且TKI 治疗时可将细胞遗传学和分子学监测作为预测疗效及指导临床用药方案的观察性指标[2]。但TKI 治疗时仍有30%左右患者因不良反应等而未获得最佳治疗效果需更换方案。伴随病情进展,80%CML 患者会伴有克隆演变(CE),为临床分析慢粒染色体异常的重点问题[3]。虽诊疗中细胞遗传学CE对CML 而言属于一类已知风险性因素,且与预后较差相关,但预后重要性在TKI 治疗中尚未进一步明确。美国血液学年会(ASH)于2018年研究中报道无CE 患者6 个月CCyR 显著高于伴CE 患者,但2组深层分子学反应相近,且CE 似乎并不对5年临床结局产生影响[4-5]。本研究观察TKI 治疗Ph 阳性老年慢性粒细胞白血病后检出克隆演变对预后的影响,为治疗老年慢性粒细胞白血病提供方法。
1 资料与方法
1.1 一般资料 选取2009年7月-2019年10月期间于内蒙古医科大学附属医院初诊为Ph 阳性的慢性髓性白血病(CML)的老年患者780 例,将一线TKI 治疗后检出CCA/Ph-的32 例老年CML患者作为研究对象,所有患者均符合CML 相关诊断标准[4],确诊前均行血常规、骨髓细胞形态学、生化、骨髓活检、细胞遗传学和分子生物学等项目检查。32 例患者中男性22 例,女性10 例,年龄为62~85 岁,平均年龄为(73.5±5.6)岁。相关观察指标和研究过程均经伦理委员会审批通过,患者均签署知情同意书。
1.2 纳入和排除标准 纳入标准:(1)均具有完整细胞遗传学资料;(2)患者Ph 染色体及BCR-ABL 融合基因均为阳性;(3)均行规律性随访;(4)临床依从性均良好;(5)均将TKI 作为一线治疗药,且TKI 治疗时检出CCA/Ph-。符合上述所有选项者纳入本研究[5]。排除标准:(1)合并其他恶性肿瘤;(2)确诊前6 个月内未行伊马替尼(IM)治疗;(3)第1年时监测频率<2 次;(4)除TKI 外接受干扰素、骨髓移植或其他抗肿瘤药物等治疗;(5)年龄<16 岁。符合上述任意1 项者不纳入本研究。
1.3 方法
1.3.1 治疗方法 患者确诊后均行甲磺酸伊马替尼片(商品名:格列卫,瑞士诺华制药有限公司,注册证号H20100263,规格:0.1 g)治疗,400 mg/次,1 次/d,治疗初期行1~2 次/周血常规检查,根据血象变化酌情增减剂量,直至血象回复平稳或达到血液学完全反应(CHR),随后每1~3 个月进行1 次。第1年治疗时,治疗后第3、6 和12 个月行骨髓细胞遗传学分析,直至到达CCyR,随后每12 个月1 次。采用RQ-PCR进行BCR-ABL 融合基因检测,每3 个月1 次,直至达到MMR,随后每3~6 个月1 次,若发现BCR-ABL转录本升高应该每1~3 个月监测1 次。治疗反应评价为失败,警告或疾病进展时需行激酶测序分析突变,评价患者服用依从性。伊马替尼(IM)耐药或不能耐受时,综合考虑患者合并症与用药史及病史、BCRABL 激酶区突变类型及经济情况转换为二代TKI:尼洛替尼胶囊(NL)(商品名:达希纳,瑞士诺华制药有限公司,注册证号H20140334,规格:200 mg 或150 mg)或达沙替尼片(DAS)(商品名:施达赛,百时美施贵宝制药有限公司,注册证号H20160433,规格:20 mg 或50 mg)治疗。
1.3.2 检验方法 进行细胞遗传学检测。骨髓细胞常规染色体核型分析:抽取肝素抗凝的骨髓5 mL,计数后按1.5×106/mL进行直接法制备然后采用G显带技术,方法为使用胰蛋白酶、其他盐溶液或碱等处理染色体标本,后将其于Giemsa 染液中染色,完毕后染色体上会出现类似于与Q 带但宽度及亮度均不同的横纹,使用显微镜观察,则深浅相间的带形横纹出现在视野中,因Q 带和G 带彼此对应,因此染色体表现为Q带亮带对应部分被Giemsa 染液染成深色带纹,而Q带暗带部分呈现为浅色带纹。分析20 个细胞,按《人类细胞遗传学国际命名体制[ISCN (1995)]》[6] 进行核型描述,核型分析鉴定至少需2 人共同参与操作。荧光原位杂交技术(FISH):抽取肝素抗凝的骨髓5 mL,制备染色体玻片,目标探针变性,将变性的DNA探针10L 加至标本上,盖上盖玻片并封片,制备玻片标本,后将其玻片放置于荧光显微镜之下,采用20×物镜扫描样品杂交区域,从中选取分散最佳的区域,后采用40×或100×物镜,并在三色或多色荧光激发观察,视野中出现不同颜色的荧光图像,后选择一定方向进行计数,计数至少300 个间期细胞[7]。分子生物学监测:采用实时定量聚合酶链反应(RQ-PCR)法检测监测BCR-ABL 转录本水平,检测标本可为外周血(不少于8 mL),后采用红细胞裂解液获取红细胞后,收集白细胞,其后使用TRIzol 试剂(美国Invitrogen 公司)处理,经氯仿萃取,后使用异丙醇沉淀获取RNA。采用基因扩增仪(美国Biorad 公司,型号:伯乐T100)及实时RQ-PCR 检测仪(美国罗氏公司,型号:LC480)检测,设置内参基因为ABL。采用BCR-ABL(P210)定量检测试剂盒(上海源奇生物科技有限公司)获取标准曲线,后进行标本检测及计算。BCR-ABL 水平检测值(BCR-ABL/ABL)=BCR-ABL 拷贝数/ABL 拷贝数×100%。BCR-ABL 国际标准值(IS)=BCR-ABL 水平检测值×转换系数(CF)[8]。
1.3.3 疗效判定方法 (1)完全血液学反应:患者的WBC 在10×109/L 以下,PLT 在450×109/L 以下,外周血中无髓性不成熟细胞,嗜碱粒细胞<0.05,脾大消失为完全血液学反应(CHR);(2)完全和部分细胞遗传学反应:患者骨髓中Ph (+) 细胞数为0%即为完全细胞遗传学反应(CCyR);患者的Ph(+)细胞数≤35%即为部分细胞遗传学反应(PCyR);(3)主要分子学反应:患者的BCR-ABLIS≤0.01%(ABL 拷贝数>10 000)称为主要分子学反应(MMR);(4)MR4.5:MR4.5 定义为骨髓或外周血标本连续2 次检测BCRABLIS≤0.0032%(ABL 拷贝数>32 000)或ABL 拷贝数>32 000 时无法检测的疾病微小残留;(5)稳定的 MR4.5:稳定的MR4.5定义为 BCR-ABLIS≤0.0032%,持续至少2年[9-10]。(6)事件定义:总生存(OS) 时间指的是从TKI 开始治疗,到任何诱因致使患者死亡或者最后一次随访结束;(7)无事件生存(EFS) 时间:从TKI 开始治疗,到治疗期间发生下述任何1 项事件结束:丧失CHR、CCyR 及MMR;病情已进展到CML 加速期(AP)或者急变期(BP);发展成为Ph 染色体阴性急性髓系白血病(AML);任何诱使患者死亡因素以及随访活动结束[11]。
1.3.4 随访采用门诊、微信、电话或访视等方式从TKI开始治疗时定期随访,并与患者预约复查时间[10]。
1.4 观察指标(1)分析检出CCA/Ph-老年CML 患者基线资料及CCA/Ph-特征;(2)分析32 例老年患者总体疗效;(3)分析32 例老年患者生存情况;(4)影响老年CML 患者生存的单因素分析;(5)影响老年CML 患者生存的多因素分析。
1.5 统计学分析 应用SPSS22.0 统计软件进行数据处理。计量资料以均数±标准差(±s)表示,采用独立样本t 检验;计数资料以例数和百分率表示,采用2检验。n<40 或T<1 时采用Fisher 检验。分析生存情况,将单因素中P<0.05 的影响性因素纳入多因素分析,采用Logistic 多元回归分析影响生存率的因素。P<0.05 为差异有统计学意义。
2 结果
2.1 分析检出CCA/Ph-老年CML 患者基线资料及CCA/Ph-特征 伴CCA/Ph-老年CML 患者32 例中男性22 例(68.7%)、女性10 例(31.3%)。于TKI 开始治疗时,28 例CP、3 例AP、1 例BP;TKI 治疗时于14 (3~92) 个月首次出现CCA/Ph-,且有11 例(34.4%)调整药物为二线NL 或DAS。首次伴CCA/Ph-的克隆比例≥50%有19 例(59.4%),且12 例(37.5%)反复性出现CCA/Ph-,20 例(62.5%)CCA/Ph-出现为一过性(随访仅1 次)。CCA/Ph-异常类型:以+8 为主有19 例(59.4%),以-7/7q-为主有5 例(15.6%)。见表1。
2.2 分析32 例老年患者总体疗效 32 例伴CCA/Ph-老年CML 患者TKI 治疗后均获取CCyR,获取中位时间13 (3~59) 个月,且15 例(46.9%) 于初次给药3个月后检验BCR-ABLIS,其水平≤10%。当随访中位时间50 (11 ~132) 个月时,患者中75.0% (24/32)疗效维持在CCyR;62.5%(20/32)分子学反应为MMR,且获取中位时间为31 (4-73) 个月。-7/7q-为主的5 例老年患者中l 例应用TKI 治疗失败且首次染色体核型检出-7、9q-,被确诊克隆演变Ph 阴性AML(急性骨髓性白血病),其余3 例患者疗效为MMR(2例)及CCyR(1 例)。
2.3 分析生存情况 随访中位时间50 个月时32 例患者平均EFS 时间:45 个月,且平均2年、5年的EFS 率分别为(83.5±7.1)%、(52.5±9.3)%。32 例患者中总生存中位时间为50 个月时,平均2年、5年的OS率分别为(92.3±5.1)%、(77.3±9.6)%。32 例患者中3 例(9.4%)死亡:2 例死于Ph 阴性AML,l 例BP 患者死于复发。
2.4 影响老年CML 患者生存的单因素分析32 例老年患者EFS 率(2年)与性别、TKI 给药3 个月BCRABLIS 水平、CCA/Ph-出现频率相关(<0.05),OS率(2年)与CCA/Ph-出现频率相关(<0.05)。CCA/Ph-异常类型组间EFS 率(2年)及OS 率(2年)差异无统计学意义(>0.05),但以-7/7q-为主异常患者的EFS 率(2年)及OS 率(2年)相比以+8 为主异常患者的EFS 率(2年)及OS 率(2年)较低。见表2。
2.5 影响老年CML 患者生存的多因素分析 采用TKI治疗时影响老年CML 患者EFS 率的独立性危险因素是反复出现 CCA/Ph- [OR=4.758,95%CI(1.22-18.591),<0.05]。患者OS 率单因素分析中仅存在1个因素即CCA/Ph-出现频率(<0.05),因此未进行OS 率的多因素分析。见表3。
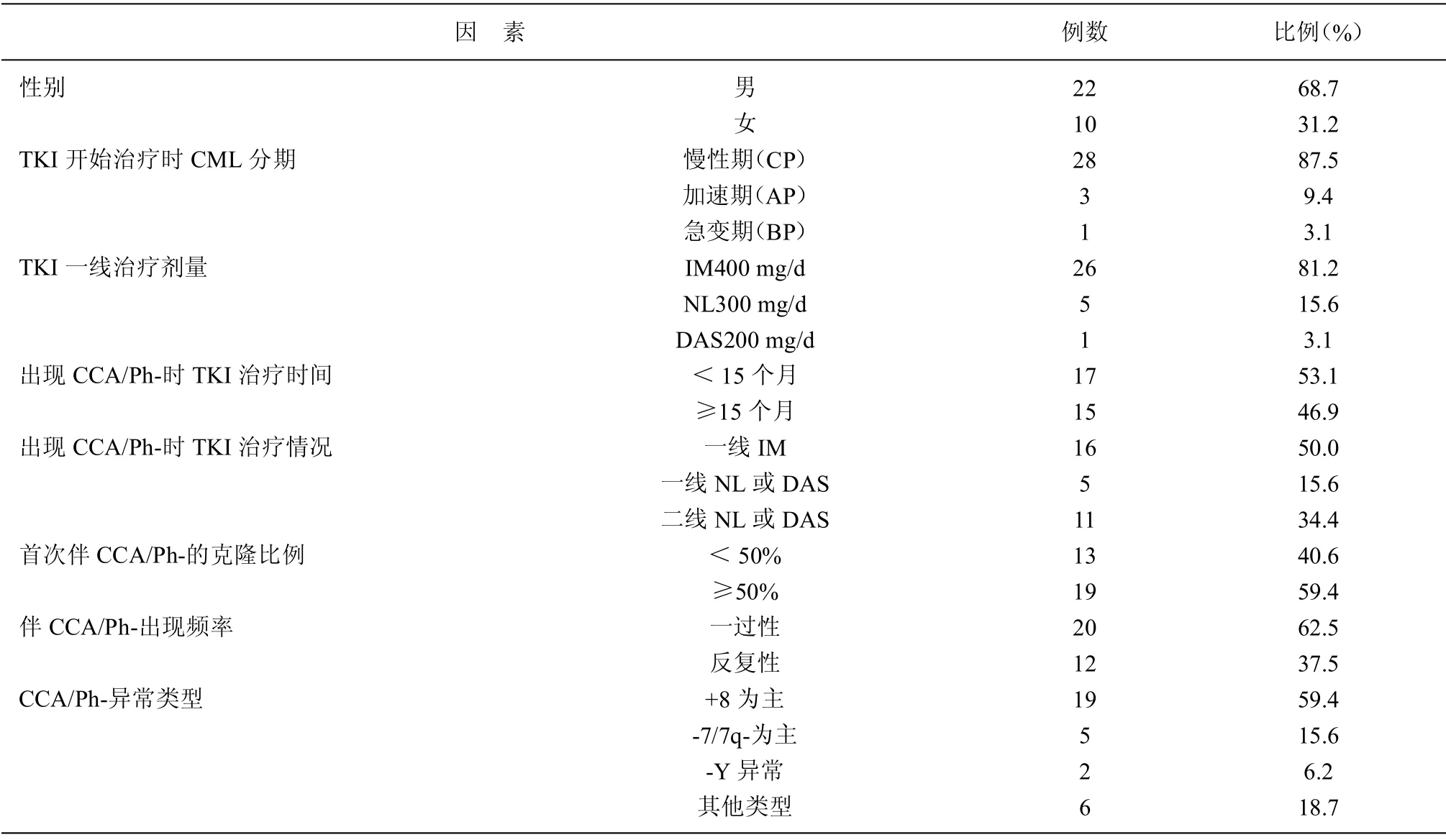
表1 分析检出CCA/Ph-老年CML 患者基线资料及CCA/Ph-特征

表2 影响老年CML 患者生存的单因素分析

表3 影响老年CML 患者EFS 率的多因素分析
3 讨论
CML) 是一种血液恶性肿瘤,其典型特征为Ph阳性染色体出现克隆性增殖演变,其治疗主要采用TKI 作为一线药物,但治疗期间伴有Ph 阳性核型反应或Ph 阴性克隆演变,出现上述变化则表明治疗失败或病情进展,提示预后较差[11]。临床大数据研究[12] 发现TKI 治疗CML 时发生CCA/Ph-的几率为3.5%~10.0%,而本研究发现TKI 治疗CML 时CCA/Ph-发生率为4.1%(32/780),二者研究结果相符。
临床研究[13] 发现在采用TKI 治疗CML 时出现CCA/Ph-的时间范围是7~18 个月,且基本会获取不同细胞遗传学反应(CyR)。本研究发现TKI 治疗32 例老年CML 患者时于14 个月首次出现CCA/Ph-,而获取CCyR 的中位时间为13 个月,二者研究结果一致。本研究采用TKI 治疗CML 时检出CCA/Ph-的例数为32 例,CCA/Ph-的染色体异常类型中以+8 为主有19 例(59.4%),以-7/7q-为主有5 例(15.6%),提示本研究780 例CML 患者中检出CCA/Ph-的克隆演变中以+8 为主,其次为-7/7q-。
大部分临床研究并未对检出CCA/Ph-克隆演变对CML 患者预后的影响价值进行仔细的探索,研究相对欠缺,且检出CCA/Ph-对预后的意义仍处于争论阶段[13-14]。国外临床研究[15] 报道采用甲磺酸伊马替尼治疗后,疗效为PCyR 的CML 患者中检出克隆演变患者与未检出患者的5年OS 率及EFS 率比较差异无统计学意义。本研究随访50 个月时32 例患者平均EFS 时间45 个月,5年EFS 率为(52.5±9.3)%;OS 平均时间为50 个月,5年OS 率为(77.3±9.6)%。在影响因素分析中将CCA/Ph-的异常类型、CCA/Ph-的出现频率、出现CCA/Ph-时TKI 治疗、伴CCA/Ph-的克隆比例、患者性别及TKI给药3 个月BCR-ABLIS水平6 项影响因素纳入分析,研究上述因素对老年CML 患者2年OS 率及EFS 率的相关性,结果发现,32 例老年患者EFS 率(2年)与性别、TKI 给药3 个月 BCR-ABLIS 水平及 CCA/Ph-出现频率相关(P<0.05),OS 率(2年)与CCA/Ph-出现频率相关(P<0.05)。CCA/Ph-异常类型组间以+8 为主异常与以-7/7q-为主异常的患者生存率存在差异,其原因可能与不同CCA/Ph-异常类型的增殖、CE 特点存在较大差异及CCA/Ph-异常类型存在一定的不稳定性相关[16-18]。
本研究将影响老年CML 患者EFS 率(2年)的单因素纳入多因素分析,并采用多元回归方程分析后发现,采用TKI 治疗CML 时影响老年CML 患者EFS率的独立性危险因素是反复出现CCA/Ph- [OR=4.758,95%CI(1.22-18.591),<0.05]。TKI 作为一线药物治疗CML 时老年CML 患者反复出现CCA/Ph-是影响患者生存的独立性风险因素。上述研究中发现CCA/Ph-具有较强的遗传学异质性,因此老年CML 患者在采用TKI 作为一线药物治疗时,若出现CCA/Ph-则需要严格筛查患者染色体异常变化,并与该克隆演变的遗传学特征、获得的细胞细胞遗传学反应及分子生物学反应进行综合性评价患者病情治疗及进展情况[19-21]。若治疗期间CCA/Ph-反复性出现即≥2 次,则需警惕病情是否存在进展的风险,而在染色体核型检查中出现以-7/7q-为主的CCA/Ph-则要警惕是否存在病情转化的风险,并及时为患者调整治疗方案[22-24]。
本研究对TKI 作为一线药物治疗CML 且检出Ph染色体克隆演变的老年CML患者预后情况进行观察,并综合细胞遗传学、分子生物学及临床检验多项技术,分析影响其生存的单因素及多因素,发现TKI 作为一线药物治疗CML时老年CML患者反复出现CCA/Ph-是影响患者生存的独立性风险因素。但本研究纳入样本数量较少,并未将确诊后未采用TKI 作为一线药物治疗的老年CML 患者纳入研究,且本研究也并未对TKI二线药物转换治疗后能否逆转异常克隆情况进行分析,因此在后续进一步的临床研究中将上述问题纳入其中,进行深入探讨。

