夏黑葡萄花青素抗氧化活性及对D-半乳糖衰老模型小鼠的保护作用
王兵亚,连秀仪2,杨琛擘3,郭旭冉4,申培红5,*,刘文涛4,刘 乐
(1.郑州大学公共卫生学院,河南郑州 450001; 2.河南富景生态旅游开发有限公司,河南郑州 450001; 3.郑州大学基础医学院,河南郑州 450001; 4.郑州大学材料科学与工程学院,河南郑州 450001; 5.郑州大学附属肿瘤医院,河南郑州 450008)

现阶段国内外对花青素的研究多集中于蓝莓、紫薯、桑葚、黑枸杞等[16-19],对葡萄花青素的研究却很少。同时,葡萄花青素的研究多集中于其常见生理活性成分的提取、纯化、结构分析及含量测定,尚未见对夏黑葡萄花青素抗衰老作用的研究。
因此本实验以夏黑葡萄花青素提取物为研究材料,测定夏黑葡萄花青素清除DPPH自由基、超氧阴离子自由基、羟基自由基的能力和总还原能力来研究其抗氧化活性,同时采用D-半乳糖衰老动物模型[18],以此来研究夏黑葡萄花青素对小鼠血中抗氧化指标及脏器的变化影响,综合评价其体内抗衰老活性,为开发以夏黑葡萄为原料的新型保健食品打下试验基础。
1 材料与方法
1.1 材料与仪器
夏黑葡萄 采于河南富景生态旅游开发有限公司;夏黑葡萄花青素样品 纯度62.1%,郑州大学材料学院;40只健康2月龄的ICR小鼠,雌鼠20只、雄鼠20只 购自北京维通利华实验动物技术有限公司,动物合格证号为SCXK(京)2016-0006。小鼠饲养环境:温度为20~22 ℃,相对湿度为50%~60%,自由饮水、进食;SOD和MDA测定试剂盒 南京建成生物工程研究所;苏木素-伊红染料 沈阳万类生物有限公司;甲醇、三羟甲基氨基甲烷Tris溶液 北京博奥拓达科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 上海如吉生物公司;邻苯三酚溶液、浓盐酸溶液、磷酸盐缓冲液、无水乙醇溶液、1%铁氰化钾溶液、FeSO4溶液、10%三氯乙酸溶液、邻羟基苯甲酸溶液、0.1%三氯化铁溶液、H2O2溶液(由实验室提供配制) 天津科密欧化学试剂有限公司;D-半乳糖粉剂 上海国药集团化学试剂有限公司;VC标品 上海麦克林生化科技有限公司,批号:201425,纯度>99.0%;水 为超纯水(屈臣氏蒸馏水)。
TG-16-WS型台式高速离心机 上海卢湘仪离心机仪器有限公司;UV-1100紫外可见分光光度计 上海光学仪器五厂有限公司;恒温水浴槽 天津市泰斯特仪器有限公司;AZ2015型热台 安卓源科技有限公司;JJ124BC型电子天平 上海上平仪器有限公司;旋转蒸发仪 上海亚荣生化仪器厂;AB-8树脂柱 南开合成科技有限公司;组织包埋机 美国Thermo公司;CUT4062石蜡切片机 德国SLEE公司;光学显微镜 日本Olympus公司。
1.2 实验方法
1.2.1 清除DPPH自由基能力的测定 用夏黑葡萄花青素提取物样品分别配制成0.10、0.25、0.50、1.00、1.50、2.00 mg/mL的溶液,取2 mL样品溶液然后分别与2 mL 0.2 mmol/L的DPPH无水乙醇溶液混合,充分混合后静置1 h,测定517 nm波长下的吸光度,记为Ax。同样取上一个步骤配制的六个浓度梯度的样品溶液各2 mL,分别与2 mL无水乙醇混合。混合均匀以后,测定517 nm波长下的吸光度值,记为Ad。准确吸取2 mL蒸馏水与2 mLDPPH无水乙醇溶液混合均匀,测定517 nm波长下的吸光度值,记为A0。参比溶液均为1∶1混合的无水乙醇和蒸馏水。以VC为阳性对照[13],并根据式(1)计算DPPH自由基清除率。
DPPH自由基清除率(%)=[1-(Ax-Ad)/Ao]×100
式(1)
1.2.2 清除羟基自由基能力的测定 将样品溶液配成0.10、0.25、0.50、1.00、1.50、2.00 mg/mL六个浓度梯度的溶液,分别取1 mL样品溶液然后先后加入1.0 mL 9 mmol/L硫酸亚铁溶液、1.0 mL 9 mmol/L邻羟基苯甲酸溶液和1.0 mL 9 mmol/L的H2O2溶液,充分摇匀。在37 ℃的水浴槽中加热30 min,静置25 min后,在波长510 nm处测定其吸光度Ax。用蒸馏水代替样品溶液作为待测溶液,测定波长为510 nm下的吸光度Ao。以蒸馏水代替上述硫酸亚铁、邻羟基苯甲酸和H2O2溶液,测定波长为510 nm下的吸光度值(以上所有参比溶液均为蒸馏水),记为Ad。按上述反应条件处理,以同样浓度的Vc为空白对照。根据式(2)计算清除率。
清除率(%)=(Ao-Ax+Ad)/Ao×100
式(2)
1.2.3 清除超氧阴离子自由基能力的测定 将样品溶液配成0.10、0.25、0.50、1.00、1.50、2.00 mg/mL六个浓度梯度的溶液。取2.25 mL,pH为8.2的25 ℃下预热过的浓度为50 mmol/L三羟甲基氨基甲烷(Tris)-HCI缓冲溶液,放置在10 ml的试管中,再将2 mL的样品溶液加入试管中,接着加入温度为25 ℃的60 mmol/L联苯三酚溶液0.05 mL,快速摇匀混合反应4 min后加入0.02 mL浓度为10 mol/L的浓盐酸溶液终止反应。参比溶液为蒸馏水,测定波长325 nm下的吸光度值,记为Ax。按上述方法,以2 mL蒸馏水代替样品溶液,测定波长325 nm下的吸光度值,记为Ad。最后用蒸馏水替换联苯三酚溶液,测定波长325 nm下的吸光度值,记为Ao。对同样浓度VC作同样处理并作为阳性对照。根据式(3)计算清除率,根据公式计算清除率。
清除率(%)=[Ad-(Ax-Ao)]/Ad×100
式(3)
1.2.4 测定总还原能力的测定 总还原能力的测定参考石甜甜等[20]采用的铁离子还原抗氧化剂能力法进行。将样品溶液配成0.05、0.10、0.15、0.20、0.25、0.30 mg/mL六个浓度梯度的溶液。分别取1 mL样品溶液加入试管中,然后依次加入2.5 mL磷酸盐缓冲液(0.2 mol/L,pH=6.6)和2.5 mL的1%铁氰化钾溶液,充分摇匀混合后,在50 ℃的条件下反应20 min。反应完毕后迅速冷却,然后加入2.5 mL 10%三氯乙酸溶液,充分混匀后,以4000 r/min的速度离心15 min。离心完毕后取2.5 mL上清液,加入2.5 mL蒸馏水和0.5 mL 0.1%三氯化铁溶液,充分摇匀,反应10 min后,然后以蒸馏水为参比,测定在波长700 nm下的吸光度值A,吸光度值越大,表示总还原能力越强,对同样浓度的VC做同样处理并作为阳性对照。
1.2.5 实验分组及衰老模型处理 40只小鼠按照300 mg/(kg·d)的剂量皮下注射灭菌D-半乳糖,连续注射55 d,构建小鼠衰老模型,通过行为学检测显示造模成功[21]。随后将建模成功的40只衰老模型小鼠根据体质量按随机数字表法随机分成4组,每组10只,用夏黑葡萄花青素提取物进行灌胃,剂量分别为低剂量组50 mg/(kg·d)、中剂量组75 mg/(kg·d)、高剂量组100 mg/(kg·d),剩余10只用同体积生理盐水灌胃作为衰老模型对照组,连续灌胃30 d。各组小鼠同室分笼饲养,自由进食(基础饲料)和水。
1.2.6 标本采集及指标测定 各组小鼠末次灌胃后,禁食不禁水,24 h后眼眶取血,小鼠脱颈处死。血浆于4 ℃低温3500 r/min离心10 min,分离血清,根据试剂盒说明测定SOD水平和MDA水平。取各组小鼠大脑组织和肾脏组织置于10%甲醛溶液中固定,酒精梯度脱水,石蜡包埋,进行4 μm切片,HE染色后,中性树脂封片,在显微镜下观察变化情况,并拍照获取所需图片。
1.3 数据处理
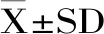
2 结果与分析
2.1 夏黑葡萄花青素抗氧化活性分析
2.1.1 夏黑葡萄花青素清除DPPH自由基的能力 如图1所示,夏黑葡萄花青素和VC对于DPPH自由基的清除能力随着浓度的增大而增强。在两者浓度都较低时,它们对于DPPH自由基的清除能力相差不大,但是在浓度到0.25 mg/mL时,夏黑葡萄花青素的清除能力达到了接近90%的水平,而此时VC的清除能力还处于较低状态;当浓度到达0.5 mg/mL,两组数据变化趋于平缓,最终两者对DPPH自由基的清除率相差不大。由此看出在浓度区间上夏黑葡萄花青素对DPPH自由基的清除作用显著强于VC(P<0.05)。

图1 夏黑葡萄花青素与VC对DPPH自由基的清除作用Fig.1 DPPH radical scavenging ability of summer black grape anthocyanin and VC
2.1.2 夏黑葡萄花青素清除羟基自由基的能力 根据图2显示,二者对羟基自由基的清除能力随着浓度的增大而增大,且VC溶液对羟基自由基的清除能力一直显著高于夏黑葡萄花青素(P<0.05)。在浓度较低时,夏黑葡萄花青素和VC的清除能力相差不大,但是在浓度较高时,VC的清除能力明显强于夏黑葡萄花青素,且在浓度较高时花青素的清除能力随浓度提高速度变慢,并且最终未能够达到60%,而VC的清除能力高达80%。

图2 夏黑葡萄花青素与VC对羟基自由基清除作用Fig.2 Hydroxyl radical scavenging ability of summer black grape anthocyanin and VC
2.1.3 夏黑葡萄花青素清除超氧阴离子自由基的能力 由图3可知,在实验浓度范围内夏黑葡萄花青素量增加,超氧阴离子自由基的清除率升高。当夏黑葡萄花青素浓度较低时,其清除超氧阴离子自由基的能力较低,在0.5~1.0 mg/mL的浓度区间清除自由基的能力随浓度增大提高的最快,在之后提高速度变慢,在浓度区间范围内,其对超氧阴离子自由基的清除率小于对照组VC,而且差异显著(P<0.05),然而当夏黑葡萄花青素浓度较高时其清除能力也能达到80%。因此,夏黑葡萄花青素具有较好的清除超氧阴离子自由基的能力,但是其能力弱于VC。

图3 夏黑葡萄花青素与VC对超氧阴离子自由基清除作用Fig.3 Superoxide anion radical scavenging ability of summer black grape anthocyanin and VC
2.1.4 夏黑葡萄花青素总还原能力 从图4可知,两者的总还原力随着浓度的增大而一直处于上升趋势,且在0.05~0.30 mg/mL浓度范围内VC的总还原能力远大于夏黑葡萄花青素,差异显著(P<0.05),同时夏黑葡萄花青素的总还原能力增强的速度明显小于对照组VC。
对于以上抗氧化实验的结果,究其原因可能是对于不同的自由基,夏黑葡萄花青素对其清除机理不同,并且随着浓度的变化其清除效果也有明显变化,所以清除能力也有很大差别。总的来说,夏黑葡萄花青素有较好的体外抗氧化活性。

图4 夏黑葡萄花青素与VC的总还原能力Fig.4 Total reducing power of summer black grape anthocyanin and VC
2.2 夏黑葡萄花青素对衰老模型小鼠血清中MDA和SOD含量的影响
由表1可知,与模型对照组相比,其小鼠血清中的SOD水平显著低于中、高剂量组(P<0.05);中、高剂量组小鼠血清中的SOD水平显著高于低剂量组(P<0.05),MDA含量各剂量模型组都显著低于模型对照组(P<0.05),同时,低、中、高剂量模型组小鼠血清SOD活性依次升高和血清MDA水平依次降低。夏黑葡萄花青素能够提高衰老小鼠血清中SOD活性和减轻衰老小鼠体内有害氧化物的积累,减少了细胞损伤,且剂量越大时可能作用更加明显,说明高剂量的夏黑葡萄花青素对衰老小鼠保护作用良好。在以往研究中发现:将“紫甘薯花青素、蓝莓花青素[5,8]作用于衰老小鼠,结果都显示小鼠血清及器官中 SOD活性显著提高,MDA 含量下降,与本实验有着类似的结果。

表1 各组小鼠血清中SOD活性和MDA含量Table 1 Activity of SOD and MDA content in serum of
注:*表示与模型对照组相比差异显著(P<0.05),不同剂量组间不同字母表示差异显著(P<0.05)。
2.3 夏黑葡萄花青素对衰老模型小鼠大脑组织的影响
衰老模型对照组小鼠大脑组织可见神经元细胞数量减少,大脑皮层区部分神经元数量少,排列紊乱,形态不规则,边界不清(图5A);低剂量组小鼠大脑组织可见水肿(图5B),细胞间隙增大,细胞核固缩,细胞形态开始变规则;中剂量组可见参与机体高级神经活动和空间定位的海马区变薄(图5C),结构异常;高剂量组小鼠大脑组织镜下结构形态正常,神经元细胞形态规则,数量丰富,细胞间隙小,细胞数目较多,排列整齐,海马区正常(图5D)。

图5 各组小鼠大脑组织切片(HE,400×)Fig.5 Histopathology of brain tissues in mice of each group(HE,400×) 注:A:对照组;B:低剂量组;C:中剂量组; D:高剂量组;E:正常小鼠。

图6 各组小鼠肾脏组织切片(HE,400×)Fig.6 Histopathology of kidney tissues in mice of each group(HE,400×) 注:A:对照组;B:低剂量组;C:中剂量组; D:高剂量组;E:正常小鼠。
2.4 夏黑葡萄花青素对衰老模型小鼠肾脏组织的影响
如图6所示,衰老模型对照组小鼠肾脏组织镜下可见皮质层肾小球数量减少,少量肾小球萎缩(图6A),肾小血管硬化(图6B),肾小球系膜和外基质出现增生现象,肾集合管淀粉样变(图6C);高剂量组小鼠肾脏组织镜下可见结构形态正常,肾小球数量丰富,形态饱满(图6D),肾小球结构完整并无损害情况。
3 结论
随着经济发展和生活水平的提高,人们的健康意识也日益增强,人们对预期寿命提出了更高的要求,高效抗衰老已成为全民关注的热门问题。同时随着对花青素越来越深入的研究,其抗氧化活性和延缓衰老作用开始被医学界所重视,花青素具有强大的抗氧化和清除自由基的功能,而目前对于夏黑葡萄花青素的抗氧化活性和抗衰老作用方面尚无系统研究。
本研究通过 D-半乳糖建立小鼠衰老模型来检测夏黑葡萄花青素的衰老预防作用。研究发现,夏黑葡萄花青素具有较强抗氧化活性,特别在浓度较大时其对于DPPH自由基的清除率能达到98%,这与文献报道的夏黑葡萄花青素具有一定的抗氧化作用相一致[2,22-24]。体内实验显示,夏黑葡萄花青素对D-半乳糖致衰老小鼠SOD活力具有提升作用,并且同时还降低MDA水平,可能与其清除氧自由基及其损伤细胞成分产生的有害产物、预防了老龄动物神经、内分泌等调节系统功能减退和微量元素的缺失,从而遏制了机体衰老导致的SOD合成减少等因素密切相关[5],从病理切片看,夏黑葡萄花青素具有抗氧化能力,这与之前文献报道花青素具有抗衰老的作用结果一致[18-19,24-25]。
综上所述,夏黑葡萄花青素能抑制并减缓衰老小鼠的机体衰老,具有增强小鼠体内抗氧化,延缓衰老的作用。这为其进一步开发利用夏黑葡萄中的花青素提供了可靠的科学依据。然而,本研究仅对夏黑葡萄花青素的延缓衰老作用做了初步的探讨,对夏黑葡萄花青素中起抗衰老作用的单体化合物的研究与其抗衰老的机理尚待研究。

