运用关联式计算火焰温度初探
(淄博职业学院制药与生物工程系,山东淄博,255314)
1 概述
在工程设计中,有时需要利用数学关联式计算一些物性数据。由于很多关联式是经验公式,都有一定的适用范围,超出适用范围应用它们,会造成较大的误差,从而影响设计的准确度。例如,当计算气体火焰温度时,往往要用到焓,而焓的计算又要使用热容数据。气体的热容随温度变化,一般可用多项式表达。对恒压热容,最常用的是如下四因数关联式[1]:
Cp=A+BT+CT2+DT3
(1)
多数与式(1)有关的公开出版的数据所采用的温度T的单位是K,恒压热容Cp的单位是cal/(mol·K)或J/(mol·K),系数A、B、C、D是经验常数。尽管一些文献[2,3]给出了与许多化合物对应的经验常数数据,但却对采用这些数据时公式(1)的适用范围没有明确说明。
火焰温度,也叫燃烧温度,是指燃烧过程中可燃物产生的热量在火焰燃烧区内释放,被燃烧后混合气(即烟气)吸收后该烟气所体现的温度。火焰温度的计算原理,是燃料燃烧产生的焓变与烟气被加热所发生的焓变相等。可用式(2)[3]计算一种气体温度从T1变为T2时的焓变:
(2)
式(2)有四次方项,比式(1)的最高三次方还高一个方次,所以误差对式(2)的影响会更大。
2 计算火焰温度
下面以计算某种气体燃料燃烧所产生火焰的温度来加以说明。已知以基础流量100kmol/h计算,该燃料混合气的总输入焓值是1011.6万kJ/h,该焓值是通过把一次空气的焓、二次空气的焓和燃料释放出的热量等相加得到的。该燃料燃烧后产生的烟气组成如表1所列。
由于空气的过剩量很小,所以预计燃烧的火焰温度很高,高于2000℃。
将从文献[3]得到的用公式(1)和(2)计算需要的系数A、B、C和D的数值列于表2。
利用Newton-Raphson试差法[4]进行计算。其步骤是,假设一个火焰温度,然后计算该温度下的燃烧后气体的总焓值。每当计算所得总焓值与输入焓值不同,就再用Newton-Raphson法假设一个新的温度。如此继续下去,直到由假设温度得到的总焓值在规定的误差范围之内接近于总输入焓值。
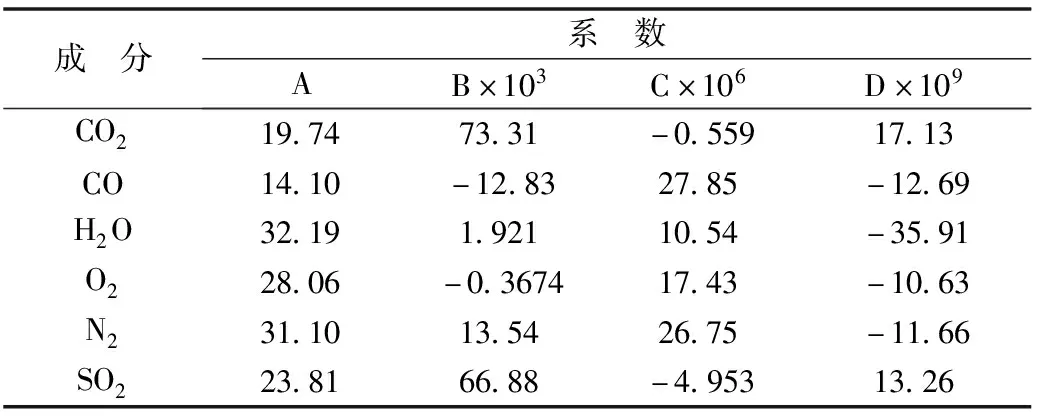
表2 公式(1)和(2)相关系数的文献值
该方法对所考察范围内无奇点的连续函数来说,是稳定可靠的。公式(1)和(2)皆符合要求,不应该有大的偏差。具体采用计算机算法语言如Fortran[4]进行运算(限于篇幅,在此不做具体运算),将焓的基础温度设在0℃(T1=273.15K),用公式(2)计算焓值。
但是,计算时出现了程序不收敛的问题。而Newton-Raphson法要达到一个收敛值所需要的迭代次数,在很大程度上决定于最初的设定值。在这里,设定的初值是火焰温度。
对此,可以在计算所使用的Fortran程序中加上“pause”语句进行诊断。这是观察程序是否出现不收敛或其他异常现象的一个有效方法。
按初始试算温度2000℃(2273.15K),燃烧后气体(烟气)的焓值收敛于675.9万kJ/h,小于输入焓值即1011.6万kJ/h。由程序再选择一个新的试算温度(按Newton-Raphson法以焓曲线的斜率为基础试算)3735℃,算出流出气体的总焓为-324.37万kJ/h,显然需进一步考察。
采用通常的方法交叉核对焓出现负值的原因。就本文涉及的气体来说,可以100℃为起始温度,以100℃为增量,计算出流量为100kmol/h时的焓。气体中每个成分的焓变用式(2)计算,设定T1=273.15K。用式(2)所得计算结果的单位是kJ/kmol。把该结果乘以该组分对应的流量,就得到其流量焓变,这相当于单位时间的焓变。所有组分的流量焓变之和就是该混合气体的总焓变。部分计算结果列于表3。
从表3可以看出,焓值开始随温度逐渐升高,直到于2367℃达到峰值7165251kJ/h。随后,焓值开始随温度逐渐下降,到大约超过3538℃就开始变为负值。该变化趋势恰好和混合气体中组分N2的焓变趋势相一致。由于该气体混合物中N2含量是72.7%,出现这种趋势就不难理解了。
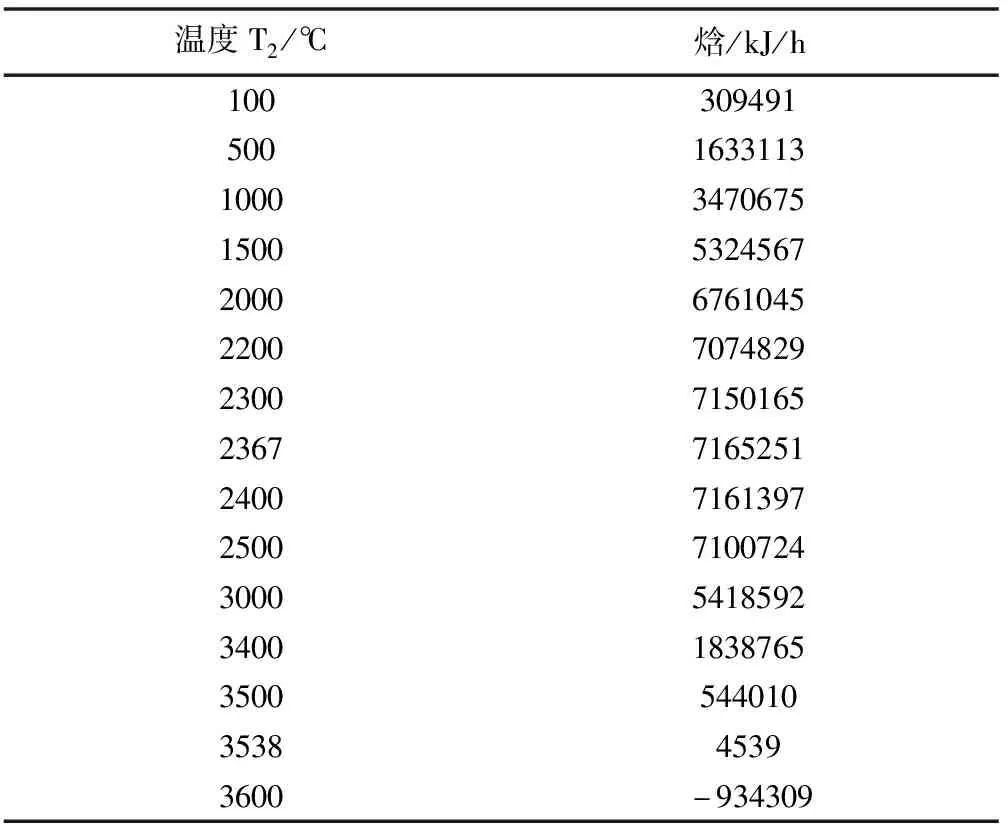
表3 从表2和式(2)计算出的焓值
产生这种现象的原因可追溯到表2中系数D的数值上。表中大多数组分对应的D是负值,D为正值的两个组分在混合物中的比例仅占14.94%。公式(2)中,随温度增加,第四项的影响也增大,因为该项中有温度的四次方。在2000℃以上,负值项优势迅速增大。
公式(2)中温度的四次方源于对公式(1)的积分。现从0℃开始,以100℃为增量,计算混合气中各组分的热容。将计算出的各组分热容乘以其含量,再相加就得到混合气的平均热容,单位是kJ/(kmol·K),部分结果列于表4。

表4 根据式(1)和文献[1]得出的平均热容
从表4可看出,热容Cp随温度逐渐增加,在1058℃达到峰值37.993 kJ/(kmol·K),此后开始下降。超过2000℃后,Cp下降很迅速,并于2367℃左右开始变为负值。
按常理,由四次方造成的变化应该大于三次方产生的变化。但在本例中,焓(其公式中温度的最高方次为4)于2367℃达到峰值后开始下降,而热容(其公式中温度的最高方次仅为3)却更早地达到峰值,且下降速度也快得多。热容在2367℃就开始变为负值,而焓只是在3538℃后才变为负值。这种情况显示了多项式表现出的一些不可预见性。在本例中,不同成分对平均值有相反贡献作用:CO2和H2O对平均值有拉升作用,而N2和O2则对平均值有下拉作用。
进一步分析可以发现,所采用的关联式对不同组分的适用性是不同的。例如,发现CO2的热容值在1000℃以上迅速增加,这说明表2的系数对CO2来说仅在1000℃以下是适用的。类似地,N2和O2的热容值则是在1000℃以上开始下降,而H2O的热容开始下降的温度要高得多,大约是在1700到1800℃之间。CO和SO2关联式的适用范围也基本在1000℃以下。简言之,在1000℃以上,整个关联式的可信度就不强了。
3 采用新关联式计算
多项关联式的值表现出一定的不可预见性,因此为便捷起见,尝试采用一个三次多项式进行关联,以求得火焰温度。表5所列是有关气体热容的实验数据[5],原单位是kJ/(kg·K),在表5被换算为以kJ(kmol·K)为单位。
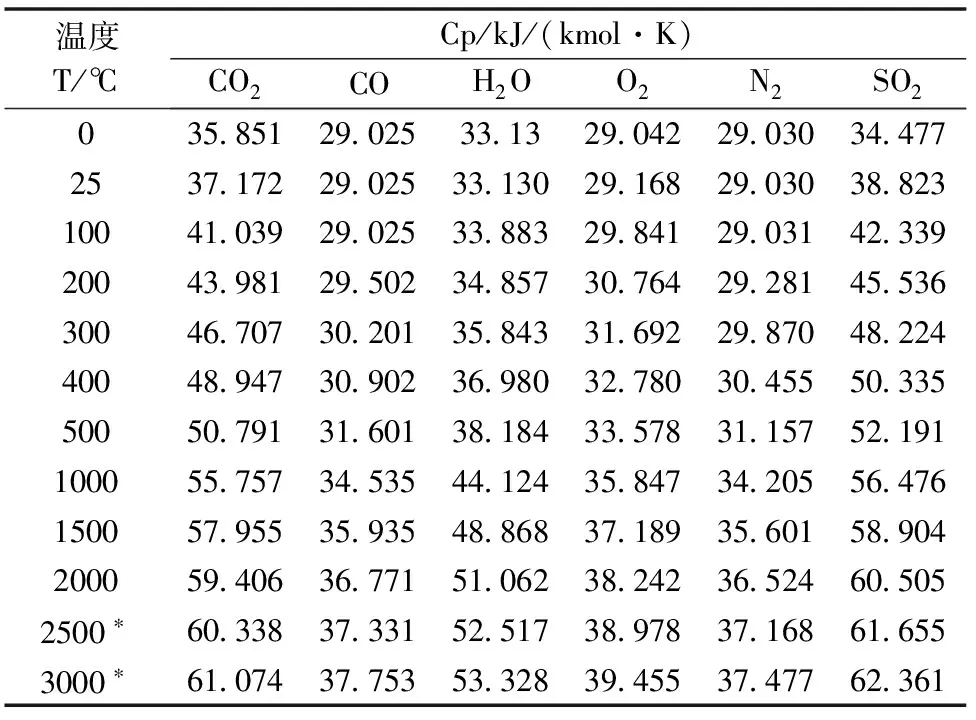
表5 热容实验数据[5]
*注:2500℃和3000℃的数据是根据用0℃和2000℃间的数据作出的平滑曲线外推得到的。
在整个温度范围即0~3000℃将表5数据代入一个三次方程式,并用最小二乘误差回归分析法进行处理,求得系数A、B、C和D的数值。发现所得某些值的误差(特别是与CO、N2、CO2和SO2所对应的系数)相当高,因此不能采用。所以对这些气体,将温度范围缩小:变为100~3000℃。对H2O和O2,温度范围仍然是0~3000℃。然后,将由此推算出的与这些数据相匹配的系数值列于表6中。
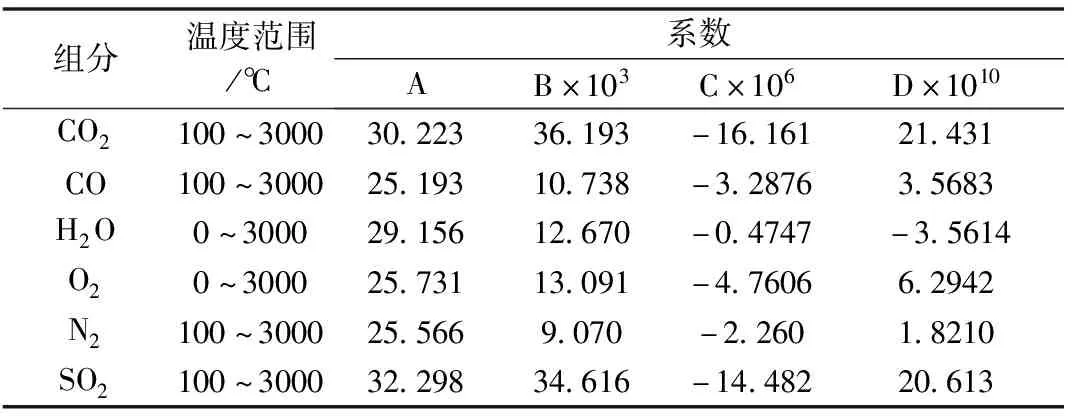
表6 修正的热容系数
用外推法检查数据是否存在显著差异:将这些系数以100℃为增量,在100~4000℃之间进行验证的。发现在整个温度范围内,无论热容值还是焓值均无异常,但3000℃以上的准确性尚不明确。
同时还对组分在0~100℃范围的情况进行了考察。CO和N2在-50~100℃内的热容值是常数,也就是说,在此范围内其热容系数B、C和D为零。对CO2和SO2,求出了适用于0~100℃的各自的热容系数。表7所列就是这些组分在该低温范围的热容系数。
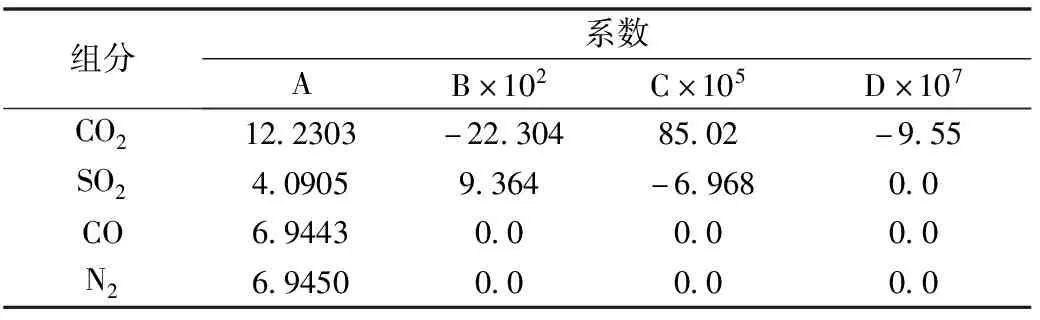
表7 部分组分在0~100℃范围内的热容系数
结果表明,所有八个关联式(100~3000℃的六个,0~100℃的两个)的最大数值误差是2.28%,平均绝对误差是0.62%。而最大误差出现在SO2上,但SO2只不过是占比很低的一个组分。
这样,重新求解上述火焰温度,经第三次迭代,得到火焰温度是2629℃(初值是2000℃)。这说明只要应用得法,Newton-Raphson法还是稳定可靠的。

