转基因金叶银中杨叶色及生长变异分析
李艺迪 顾宸瑞 冮慧欣 刘桂丰 陈 肃 姜 静
(林木遗传育种国家重点实验室,东北林业大学,哈尔滨 150040)
GLK 转录因子又称为Golden2-Like 和G2-Like,是Myb 类转录因子中的GARP 家族成员[1],其功能主要调控植物叶绿体发育、果实品质,同时也参与植物生物胁迫、植物衰老和激素信号转导等[2~6]。研究证明,拟南芥(Arabidopsis thaliana)中的2 条GLK 功能冗余,双突变体Atglk1、Atglk2叶色表现出淡绿色表型[7]。在番茄(Solanum lycopersicum)中,SlGLK1 和SlGLK2 的过量表达使番茄未成熟果实更加深绿色,同时促进果实均匀成熟、进而改善成熟果实的品质[3~4]。在C4 植物玉米(Zea mays L.)和高粱(Sorghum bicolor(L.)Moench)中,GLK1 和GLK2 分别在叶鞘(BS)和叶肉(M)细胞中表达[8]。然而,C4 植物白菜花(Cleome gynandra)中,CgGLK1 和CgGLK2 均在叶鞘和叶肉细胞中表达,并且在叶肉细胞中表达量更高[9]。水稻(Oryza sativa)的OsGLK1 参与调控叶绿体发育,并且Os-GLK1 在Chl 的生物合成中发挥重要作用[10]。对拟南芥的研究发现,AtGLK也参与病原微生物的防御作用,例如,该基因的过量表达AtGLK1OX株系对禾谷镰刀菌(Fusarium graminearum)、葡萄孢菌(Botrytis cinerea)抗性显著高于野生型拟南芥[11~13]。在林木中有关GLK 基因的研究鲜有报道,对白桦(Betula platyphylla Suk.)研究发现,其基因组中仅有1 个BpGLK1 成员,该基因的缺失突变及干扰表达转基因白桦均表现叶片叶绿素含量降低,叶片呈现黄色[14~15]。
随着城市的发展,人们对叶色艳丽的高大乔木需求越来越大,采用基因工程技术改变植物叶色是快速创制植物新品种的有效途径,例如,过表达PdMYB118 的转基因山新杨(P.davidiana×P.bolleana)在叶片中产生非常多的花色苷,并且在温室和田间生长时将其颜色变成红色[16]。过表达PtrMYB119 毛果杨(Populus trichocarpa)花青素水平显著提高,叶色呈现红色[17]。上述MYB 基因在彩色树种选育中具有潜在的应用价值。除此之外,MdMYB10 过表达苹果(Malus domestica)中,花青素水平升高,色素沉着,形成红色果实[18]。转基因烟草中SoCHS1 的过表达将花色由浅粉红色变为粉红色[19]。
银中杨(Populus alba×P.berolinensis)树皮灰绿色,树冠呈圆锥形,树姿优美,叶片较大,叶面深绿色,叶背面银白色,密生绒毛,在城市园林绿化中广泛应用[20]。笔者所在团队根据白桦BpGLK1 研究思路,采用农杆菌介导的叶盘法获得了PaGLK基因过表达及抑制表达银中杨,其中获得的3 个PaGLK 抑制表达银中杨叶色也为金黄色,但是亮度及黄色程度不尽相同。为了解转PaGLK 基因银中杨叶色的变异规律,以及叶色黄化对转基因银中杨生长是否产生影响,试验以PaGLK 过表达、PaGLK 抑制表达转基因株系为材料,分析叶绿素相对含量与叶色的时序变异规律,探讨叶绿素含量的降低对株高生长的影响。研究结果为后续转基因银中杨在城市园林绿化中推广应用提供参考。
1 材料与方法
1.1 材料
转PaGLK 基因银中杨:PaGLK 过表达株系(G1、G2、G3);PaGLK 抑制表达株系(Y1、Y2、Y3)均由研究团队保存。
1.2 方法
1.2.1 转基因银中杨分子检测
分别提取PaGLK 过表达转基因银中杨(G1-G3)叶片DNA 为模板,以pCAMBIA1300-PaGLKGFP 质粒为阳性对照,以非转基因银中杨(WT)的总DNA 为阴性对照,同时设水为阴性对照,引物PaGLK-F,PaGLK-R(见表1),PCR 反应体系按相关文献[21],反应结束后,吸取2µL 进行电泳检测,观察目的条带的位置。
分别提取PaGLK 抑制表达转基因银中杨(Y1-Y3)叶片DNA 为模板,以pFGC5941-CIS-F 和pFGC5941-Cis-R,pFGC5941_Anti_F 和pFGC5941-Anti-R 作为引物(见表1)进行PCR 检测。以pFGC5941-PaGLK 质粒为阳性对照,以非转基因银中杨(WT)的总DNA为阴性对照,同时设水为阴性对照,PCR 反应体系按相关文献[21],反应结束后,吸取2 µL 进行电泳检测,观察目的条带的位置。
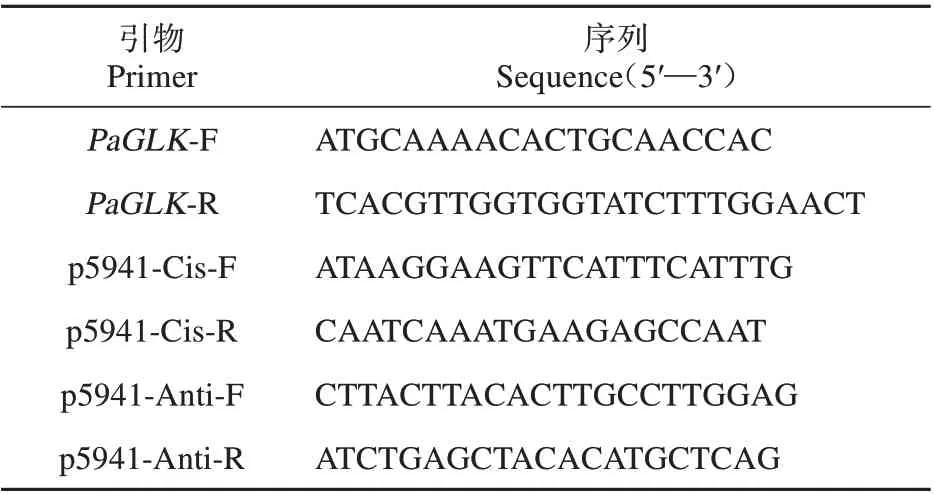
表1 引物序列Table 1 Primer sequences
qRT-PCR 检测:分别提取参试株系总RNA,反转录为cDNA,将其稀释10 倍后用于定量qRTPCR 的模板,以18S rRNA 为内参基因(见表2),进行对PaGLK 基因的qRT-PCR 分析,qRT-PCR 反应体系及扩增程序[15]。
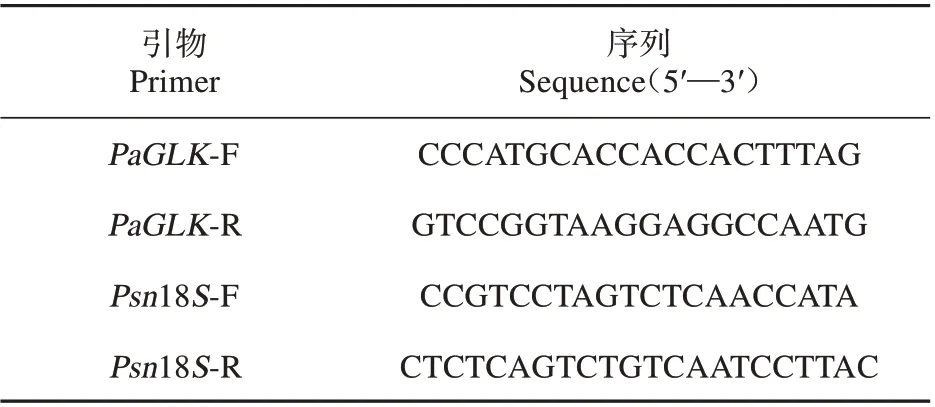
表2 qRT-PCR 引物序列Table 2 qRT-PCR primer sequence
1.2.2 转基因银中杨苗木扩繁及叶色调查
采用组培微繁技术分别扩繁野生型银中杨(WT)及各转基因株系,4月中旬移栽至育苗盘中,置于温室中常规管理,5月中旬初选取高度一致的苗木,移栽至18 cm×13 cm 花盆中,每个株系共30株,分3次重复,7个株系,共计210盆苗木,放置在塑料大棚中进行常规水肥管理。
RHS 比色:将叶片近轴面与RHS 标准比色卡(英国皇家园艺学会,2015)进行对比,记录叶片的颜色。
色差仪比色:于2019 年5 月15 日开始至9 月15 日结束,每隔15 d 分别对参试株系测定1 次,共计9次。采用分光色差仪(CR-400,Japan)测定第4叶的叶色参数,测量结果用CIELab 表色系统进行色度分析[22]。
1.2.3 叶片叶绿素相对含量测定
采用便携式叶绿素测定仪(SPAD-502 PLUS,KONICA MINOLTA)测定转基因及WT 株系功能叶的叶绿素相对含量,读取SPAD 值,测定于5 月15 日开始,9 月15 日结束,每15 天测定1 次,每次每个株系测定10株树叶片,3次重复。
1.2.4 生长性状调查
于2019 年5 月中旬开始调查其生长等性状,每15天测量1次,直至该年9月份整个植物生长周期测量结束。
数据利用MATLAB Compiler Runtime 8.3对苗高的生长规律进行Logistic方程拟合,Logistic曲线方程:

式中:y 为苗木苗高(cm);t 为苗木生长的时间,1 月1 日为1(d);a 为苗木开始生长时的苗高初始值(cm);b 为苗木停止生长时苗高值(cm);t0为苗木苗高日生长速度最快的日期(d);c 为曲线在苗木苗高日生长速度最快处的斜率(cm·d-1)。
在符合“S”型曲线的林木个体生长过程中,速生期是林木生长的关键阶段,通过拟合方程得出速生期参数:
速生期的起始点t1;
速生期的结束点t2;
速生点t0;
速生期的持续时间RR=t2-t1;
速生期苗高的平均生长量GR=t2点的苗高-t1点的苗高;
速生期内苗高日生长量的平均值GD=GR/RR;
速生期内生长量占总生长量的比值RRA=GR/b-a。
2 结果与分析
2.1 转基因株系的分子检测
分别以银中杨PaGLK 过表达株系的叶片总DNA 为模板,结果显示:阳性质粒及3 个转基因株系在1 200 bp 处扩增出单一谱带,与PaGLK 序列碱基长度吻合(1 269 bp),而WT 株系无扩增谱带(图1)。
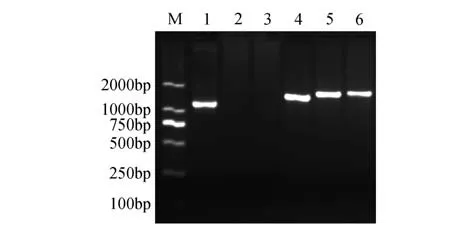
图1 PaGLK过表达转基因株系PCR扩增电泳图谱M.DNA Maker DL2000;1. 阳性质粒;2. 阴性对照(水);3.WT株系;4~6.G1-G3株系Fig. 1 PaGLK overexpression transgenic lines PCR electrophoresis patternM.Marker DL2000;1.Positive plasmid;2.Negative control(ddH2O);3.WT line;4-6.G1-G3 line
分别以银中杨PaGLK 抑制表达株系的叶片总DNA 为模板,结果显示:3 个转基因株系正向和反向均有扩增谱带,且与预期的200 bp 长度吻合(图2),实验结果证明目标基因已经整合到银中杨基因组中。
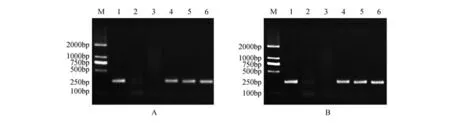
图2 PaGLK抑制表达转基因株系PCR扩增电泳图谱A.PaGLK抑制表达转基因株系正向PCR;B.PaGLK抑制表达转基因株系反向PCR M.DNA Maker DL2000;1. 阳性质粒;2. 阴性对照(水);3.WT株系;4~10. 转PaGLK基因抑制表达株系Y1~Y3Fig.2 PaGLK repression transgenic lines PCR electrophoresis patternA.PCR of forward fragment in PaGLK repression transgenic lines;B.PCR of reverse fragment in PaGLK repression transgenic lines M.DNA Maker DL2000;1.Positive plasmid;2.Negative contro(lddH2O);3.WT line;4-6.Y1-Y3 line
进而对获得的转基因银中杨进行qRT-PCR 检测(见图3),结果显示G1、G2、G3 过表达株系中PaGLK 基因表达量显著高于WT 株系,分别是WT株系的6.7、3.7、3.8倍,而Y1、Y2、Y3抑制表达株系中PaGLK 基因则显著下调表达,较WT 株系低65.3%、68.7%、73.70%。进一步证明PaGLK 基因已经整合到银中杨基因组中。
将银中杨PaGLK 与白桦BpGLK1 序列利用BioEdit软件进行多序列比较,比较结果(见图4)。
2.2 转基因银中杨的叶色变异
CIELab 表色系统中L*值是衡量叶色明暗程度的指标,该值越大则叶片亮度越高,b*值表示叶片的蓝黄属性,b*值由大变小,则表示蓝色减退黄色增加[22]。

图3 转基因株系相对定量分析注:不同小写字母表示P<0.05显著水平Fig.3 RelativequantitativeanalysisofthetransgeniclinestNote:Different lowercase letter represents the significance difference P<0.05
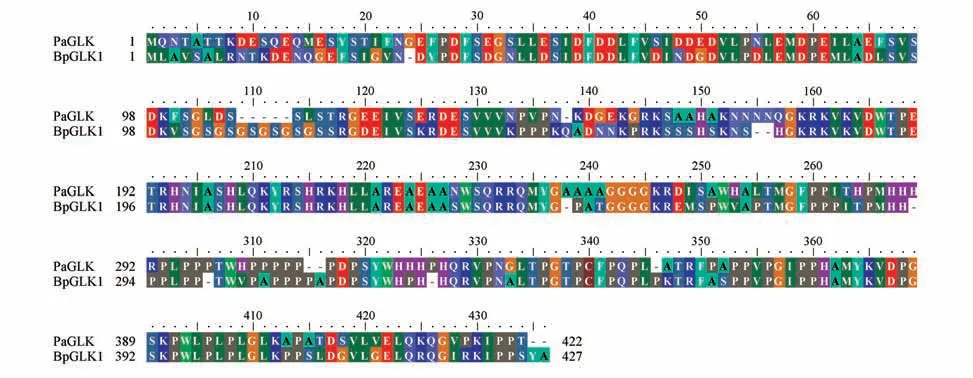
图4 银中杨PaGLK与白桦BpGLK1序列的多序列比对Fig.4 Multiple sequence alignment of PaGLK and BpGLK1 in birch
对不同发育期各参试株系的叶色参数L*值分析,结果表明,PaGLK 过表达株系中的G1 株系在整个发育阶段都显著低于WT 株系,而G2、G3 株系的L*值仅在8 月1 日、8 月15 日显著低于WT 株系,其他发育阶段与WT 株系差异不显著(见图5)。参试株系的3 个抑制表达株系从6 月初开始到9 月中旬其L*值持续高于WT 株系,并达到显著水平(P<0.05)。说明,银中杨PaGLK 基因的低量表达使叶片的亮度其他株系。各株系的叶色参数L*值时序变化均在7月15日该值最大,此时3个抑制表达株系的L*值均显著高于WT及过表达株系,其均值较WT 株系均值高15.4%、较3 个过表达株系均值高19.9%。
不同发育期各参试株系b*值测定,结果表明,G1过表达株系的b*值在整个发育阶段都显著低于WT株系,而G2、G3株系在5月15日到7月15日之间其叶片b*值与WT 株系差异不显著,从8 月开始直到调查结束,b*值一直低于WT 株系,并达到显著水平(P<0.05)(见图5)。抑制表达株系从7 月中旬到9 月中旬这期间的b*值一直显著高于WT株系,并达到显著水平(P<0.05)。在6 月15 日的b*值低于其他时期,并且抑制表达株系的b*值与对照株系差异不显著。随着参试株系的生长7 月15日到9月15日之间,3株抑制表达株系的b*值均显著高于WT株系。
RHS 比色卡测定结果显示(见表3),WT 株系始终呈现中等黄绿色,抑制表达株系的叶色始终呈现深黄绿色(RHS2015 144B),而过表达株系的叶色在7月中旬为中等橄榄绿色和深黄绿色,随后渐渐的变为浅橄榄绿。
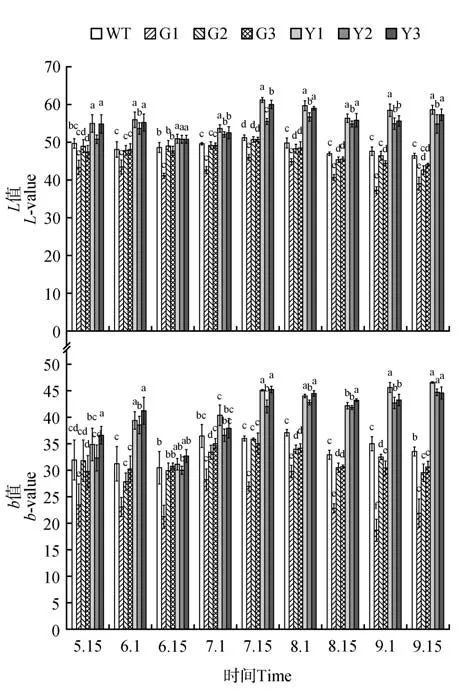
图5 参试株系叶片L*值、b*值时序变化注:a、b、c、d为同一时间点参试株系L*值、b*值的多重比较Fig.5 Temporary variation of test lines about value b and value LNote:a,b,c and d in figures indicate the multiple comparisons between test lines about value b*and value L*in the same time
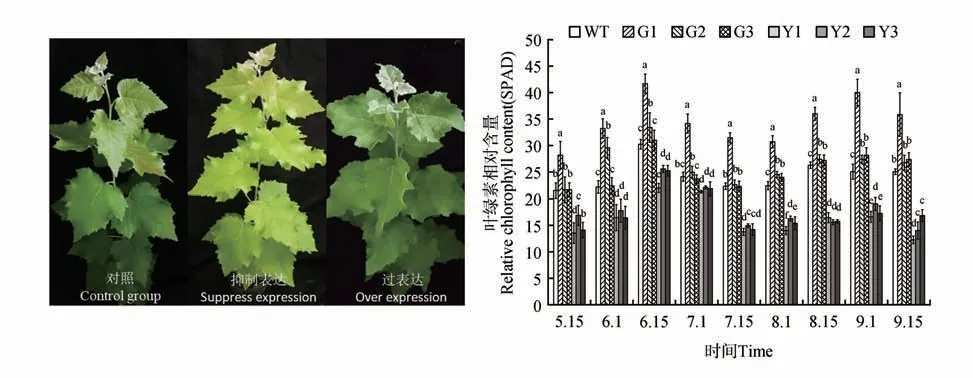
图6 参试株系的叶色观察和叶绿素相对含量(SPAD)时序变异注:a、b、c、d为同一时间点参试株系SPAD值的多重比较Fig.6 Observation of leaf color and temporal variation of relative chlorophyll conten(tSPAD)in the test linesNote:a,b,c and d in figures indicate the multiple comparisons between test lines about SPAD value in the same time
2.3 转基因银中杨叶绿素含量分析
转基因银中杨叶的叶色不同于WT 株系(图6),对不同发育期的各参试株系进行SPAD 的测定,结果表明(见图6),参试株系在整个生长过程中,过表达株系G1 的SPAD 始终显著高于对照株系,G2、G3 在8 月1 日到9 月1 日始终高于WT 株系,并达到显著水平(P<0.05)抑制表达株系的SPAD 在6 月1 日到9 月15 日 都显著低于WT 株系和过表达株系,其中在9 月15 日的SPAD 是最低的,其均值低于WT 株系的42.7%,低于过表达株系SPAD均值的52%。
2.4 转基因银中杨的生长特性分析
2.4.1 转基因银中杨苗高生长模型的建立与拟合
分别对转基因株系苗高生长过程进行拟合(见图7)转基因及WT 株系苗高生长过程为“S”型曲线,用四参数Logistic 方程式分别对转基因及对照银中杨苗高的平均值进行拟合,并绘制出“S”形生长曲线(见图7)。各生长模型方程的拟合系数均高于0.99,达到显著水平,说明用四参数Logistic曲线方程对转基因及WT 株系生长节律进行拟合是准确可靠的,可用于转基因及WT株系高生长分析与预测。
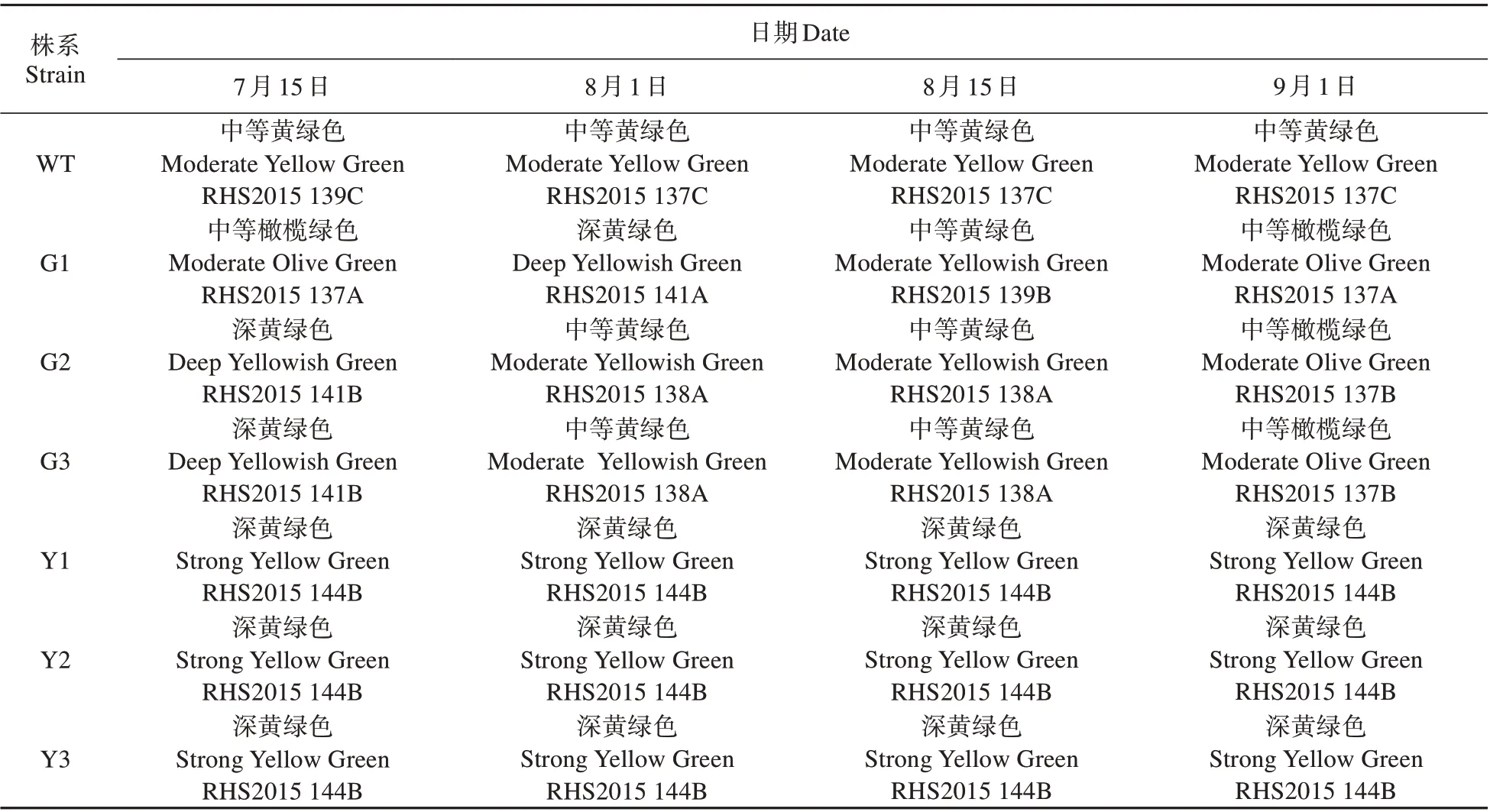
表3 参试株系的叶色时序变化Table3 Time series of leaf color of the tested plants
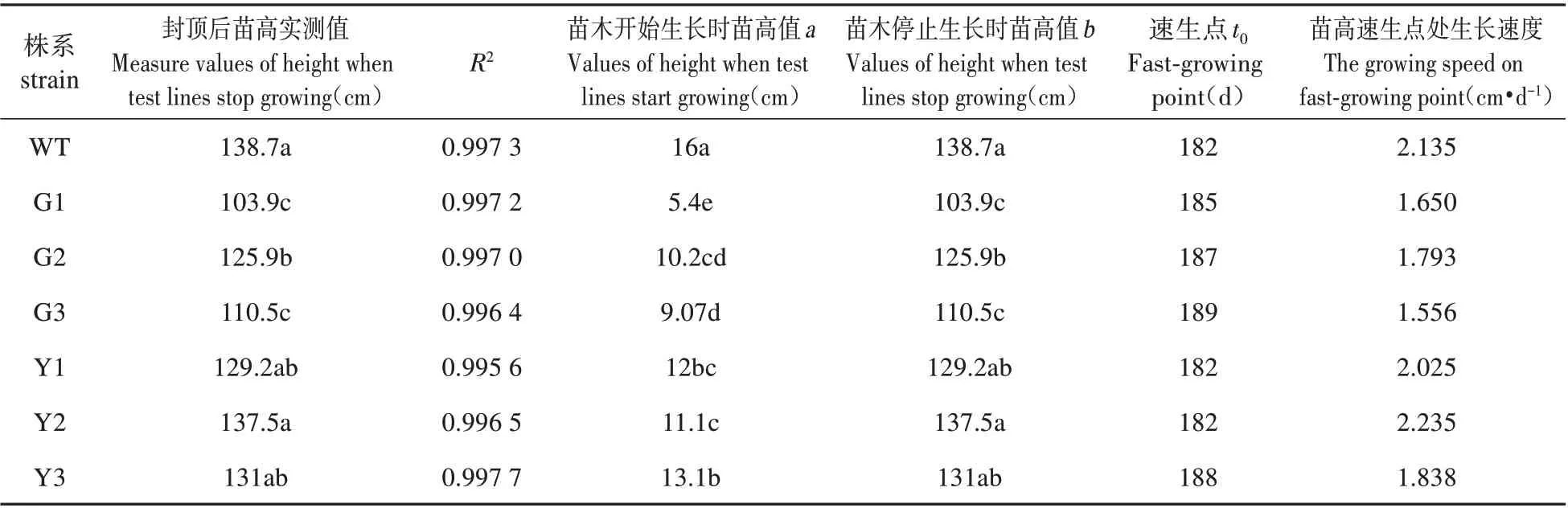
表4 转基因银中杨苗高的Logistic模型Table 4 Logistic model of poplar seedling height in transgenic silver

图7 转基因株系树高逻辑斯蒂拟合曲线Fig.7 Logistic fit curve of tree height of transgenic lines
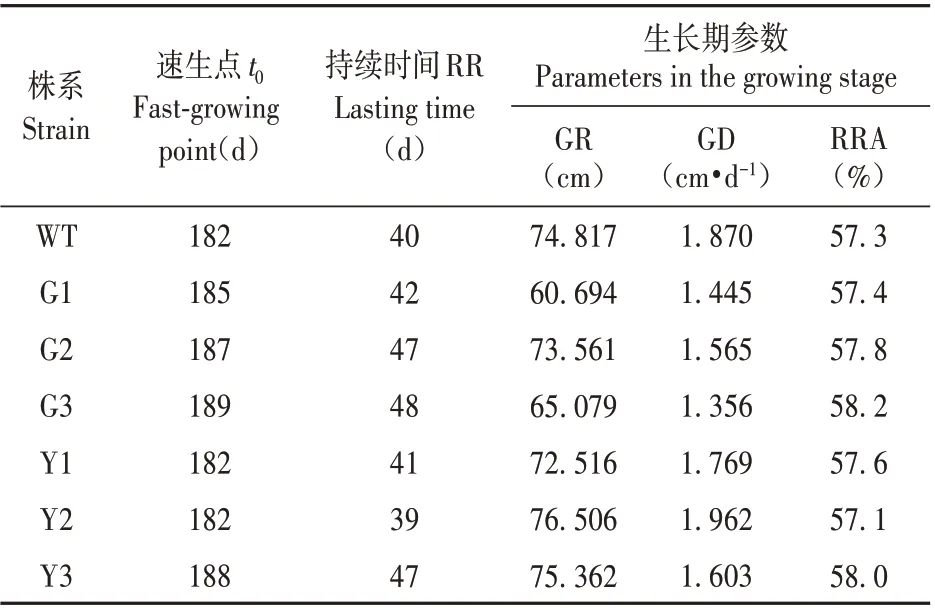
表5 转基因株系速生期生长参数比较Table 5 Comparison of growth parameters of transgenic strains in the fast growing period
由表4 可知,过表达株系与WT 株系的苗高生长(即停止生长后的实测值)差异显著(P<0.05),过表达株系当年高生长显著低于WT株系,其苗高均值低于WT 株系的18.22%,其中G3 苗高速生点最高,为1.793 cm·d-1,低于WT 株系。抑制表达株系停止生长后的苗高与WT株系差异不显著,其中Y2的苗高速生点最高,为2.235 cm·d-1。
2.4.2 转基因银中杨速生期生长参数变异
转基因银中杨苗高从5 月中旬开始生长,9 月中旬封顶,生长期约为120 d。转基因株系与WT株系从开始生长、到进入速生期以及速生期结束的时间基本一致。由表5可知,过表达株系在速生期内苗高的平均生长量(GR)低于对照株系,其速生期内苗高日生长量均值(GD)也低于WT 株系,其均值为WT 株系的22.19%。然而抑制表达株系中的Y2 速生期内苗高日生长量均值(GD)高于WT 株系,另外两个株系速生期内苗高日生长量(GD)没有高于WT 株系,但是速生期的持续时间长于WT株系,因此导致最终停止生长时的高生长与WT差异不显著。
3 讨论
银中杨是银白杨与中东杨杂交选育出的三倍体雄性无性系,该无性系不仅具有树干通直,树皮灰绿、树姿优美的特点,还具有雄性败育、无散粉的特点,在城市园林绿化中深受人们青睐[20]。以其为受体获得的转基因金叶银中杨,可以免去外源基因通过花粉向非转基因品种或野生近缘物种漂移给人们带来的后顾之忧,可以说通过基因工程技术创制的金叶银中杨在城市园林绿化中发展前景广阔。
Golden2-like(GLK)基因家族的成员可以协调光合作用的表达并控制不同植物物种中叶绿体的发育[7,23~26]。根据报道,拟南芥和苔藓中,GLK1 和GLK2 同时缺失的突变体的叶片表现为叶绿素含量降低,叶片变黄。番茄中SlGLK1 的缺失也能引起叶片颜色变浅[3,7]。研究证明,白桦BpGLK1 抑制表达株系的叶绿素含量明显降低,叶片呈现深黄绿色,过表达株系的叶绿素含量比对照高[15],植物叶色变异也往往与叶绿体中的色素含量的变化有关[27~28],本试验中转PaGLK 银中杨苗期试验显示,过表达株系叶色为绿色,9 月时叶色为中等橄榄绿色,株高生长较WT 缓慢;而3 个抑制表达株系的叶色参数代表叶片亮度的L*值均显著高于WT 株系,尤其是Y1 和Y3 株系叶片亮度更高,代表叶片黄色的b*值也显著高于WT 株系,在整个生长季,Y1和Y3株系一直保持鲜艳的黄色。从叶片亮度及色彩方面分析,3 个抑制表达株系中Y1 和Y3 株系更鲜艳,应用推广潜力更大,后续还需继续追踪调查。
光合作用可以为植物提供能量,从而促进植物生长。叶绿体是植物细胞内最重要、最普遍的质体,它是进行光合作用的重要场所。所以,叶绿体的发育与植物生长发育有密切的关系。在水稻低叶绿素突变体中发现,虽然叶绿素含量降低,但是叶绿体的发育没有受到影响,在高光照条件下具有较高的光合速率[29]。适当降低叶绿素含量,不仅有利于减少光抑制,而且还有利于氮素在光合系统内的分配,从而提高光合氮素利用效率[30~31]。本试验中,转PaGLK 银中杨苗期试验显示,PaGLK 抑制表达并未影响银中杨苗期株高生长,移栽当年停止生长时抑制表达株高均值为132.58 cm,与WT 株系差异不显著,但是,PaGLK过表达株系的株高却显著低于WT株系,可能叶绿素含量显著增高,叶片吸收了过量的光能,导致光抑制现象所致。总之,光合作用是一系列复杂的代谢反应总和,仅维持叶片高叶绿素含量并不是提高有效光合速率的必要条件[32]。研究表明,在拟南芥和白桦的研究中,GLK 主要通过调控捕光天线蛋白、光系统复合体蛋白以及叶绿素合成等相关基因的表达,影响植物的光合色素的合成及叶绿体的发育[14~15,23],GLK 基因的缺失及抑制表达均可使植物叶片褪绿黄化,并且该性状在大田中稳定表现[14~15,22]。因此,在其他植物中GLK 基因可以作为黄色彩叶树育种的候选基因。

