甘肃武威地区不同成熟期‘黑比诺’葡萄中的多酚测定
史肖,张波,牛见明,刘琦,李宁宁,陈欣然,王凯丽,马腾臻,韩舜愈*
1(甘肃农业大学 食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃省葡萄与葡萄酒产业技术研发中心,甘肃 兰州,730070)2(甘肃农业大学 生命科学技术学院,甘肃 兰州,730070)
甘肃河西走廊葡萄酒产区位于北纬36°46′~39°57′,气候干旱少雨,光照充足,昼夜温差大,具有种植酿酒葡萄得天独厚的地理优势和气候条件[1-2]。现普遍认为地处河西走廊最东端的武威地区属于国内酿酒葡萄种植的最佳地理位置之一,该地区种植的葡萄具有营养价值高、自然灾害小、病虫害少等特点。据统计,黑比诺是武威地区种植面积最大的红葡萄品种,作为该地区内最具代表性的酿酒葡萄种植基地,38°和莫高两大基地的黑比诺葡萄种植面积已超过一万亩,并仍在逐年扩大[3]。
红葡萄酒中的多酚类物质,对葡萄酒的色泽、口感、平衡起决定性作用,并且多酚具有很强的抗氧化功效[4-5]。葡萄酒中的多酚主要来源于葡萄浆果,其中果皮是多酚物质存在的重要部位,发酵前的浸渍处理和带皮发酵是浆果中多酚物质进入红葡萄酒的重要途径[6]。葡萄多酚可分为花色苷酚与非花色苷酚两大类,花色苷酚及其衍生物是葡萄酒重要的呈色物质,但由于单体花色苷不稳定,因而多存在于发酵过程或新酒中,并且随着葡萄酒的陈酿,单体花色苷与辅色因子结合形成聚合花色苷,从而增加葡萄酒色泽的稳定性。非花色苷酚除抗氧化功能外,辅色作用是其在葡萄酒品质提升中的重要体现,KONG[7]研究发现,香豆酸和咖啡酸可与花色苷的糖苷部位结合形成酰化花色苷,从而使葡萄酒具有更好的颜色品质。QINA[8]在研究酚酸对葡萄酒颜色时发现,外源添加酚酸可提高19%~27%的颜色强度。ZHANG等[9]在模拟酒中研究了原儿茶酸、没食子酸等5种非花色苷酚作为辅助因子对二甲花翠素-3-O-葡萄糖苷的辅色作用,其结果显示,非花色苷酚浓度越高、温度(10~20℃)越低,辅色效应越强。
酿酒葡萄果实成熟是一个极其复杂的过程,有报道指出,葡萄果皮中的花色苷开始合成于转色期,在葡萄浆果接近成熟时含量最高[10-12];酚酸、黄酮醇在转色完成后逐渐积累并达到最大值[13];白藜芦醇在幼果期含量较高,当进入转色期含量出现下降[14];李惠清等[15]在进行酿酒葡萄转色期内花色苷积累的差异性研究时发现,不同葡萄品种中花色苷酚的含量和比例具有组织特异性,其中果皮和果肉中含量最高的花色苷分别为二甲花翠素-3-O-葡萄糖苷和甲基花青素-3-O-葡萄糖苷;姜寿梅等[16]研究结果显示,在从转色开始到转色完成后1~2周时,葡萄果皮中各非花色苷酚类物质含量积累到最高,随后又开始缓慢下降,在葡萄采收前2周时,酚酸含量趋于稳定、白藜芦醇含量继续降低,其他非花色苷酚含量再次升高,但这种含量波动性变化的内在原因,该文章并没有进行深入探究。目前关于葡萄多酚的研究多集中在转色期,而成熟过程中葡萄多酚的研究较少,并且成熟期内葡萄多酚的合成积累规律及代谢变化机制的研究也鲜有报道。此外,成熟过程中葡萄多酚的含量及其合成代谢直接决定着最终葡萄酒中多酚的含量,进而会影响到葡萄酒的颜色品质与酒体平衡,因此研究这一时期葡萄多酚含量的变化规律对改善葡萄酒品质的价值更大。
本文以甘肃武威地区38°、莫高2个酿酒葡萄种植基地的黑比诺葡萄为原料,通过超高效液相色谱-电喷雾离子化串联三重四级杆质谱(ultra performance liquid chromatography-electraspray ionization-triple quadrupole tandem mass spectrometry, UPLC-ESI-QQQ-MS)和超高效液相色谱-电喷雾离子化串联质谱(ultra performance liquid chromatography-electraspray ionization tandem mass spectrometry, UPLC-ESI-MS/MS)技术,研究不同成熟期葡萄果皮中花色苷与非花色苷酚的变化规律,以期为从原料方面改善武威地区葡萄酒品质及提升黑比诺葡萄酒颜色方面的研究提供理论参考。
1 材料与方法
1.1 试验材料
黑比诺酿酒葡萄:2017年采自甘肃武威地区2个不同酿酒葡萄种植基地:民勤38°酿酒葡萄种植基地(北纬38°,东经104°43′)、黄羊镇莫高酿酒葡萄种植基地(北纬37°42′,东经103°19′),具体采样时期如表1所示。

表1 采样时期Table 1 Sampling period
1.2 试剂与仪器
试剂:二甲花翠素-3-O-葡萄糖苷(Mv-3-O-glu)标准品(纯度≥98.0%),美国Miragen公司;甲酸、乙腈、甲醇均为色谱纯,购自德国Merck有限公司;无水葡萄糖、偏重亚硫酸钠、次甲基蓝指示剂均为分析纯,购自天津市光复精细化工研究所。
仪器:JJ-2冻干机,金坛市杰瑞尔电器有限公司;MS3 Digital涡旋仪,德国Ikams公司;ZWF334振荡仪,上海智城分析仪器制造有限公司;H2050R高速冷冻离心机,长沙湘仪离心机仪器有限公司;RE-6000A旋转蒸发仪,上海亚荣生化仪器厂;1290-6460超高效液相色谱-质谱联用仪、Poroshell 120 EC-C18色谱柱、Zorbax SB-C18色谱柱,安捷伦科技有限公司。
1.3 试验方法
1.3.1 成熟度指标测定
总糖、总酸参照国标GB/T 15038—2006中推荐方法测定[17]。
1.3.2 花色苷酚的提取与测定
参照本实验室陈欣然等[18]的方法并略作修改,具体操作如下。
花色苷酚提取:准确称取0.05 g葡萄皮冻干粉,加10 mL含有2%甲酸的甲醇溶液,超声10 min,涡旋振荡20 min,离心5 min(13 000 r/min)后,收集上清液至250 mL圆底烧瓶。按上述步骤重复提取3次,合并上清液并旋蒸至干(120 r/min、25 ℃),用溶剂(A相∶B相=9∶1)定容至10 mL,于-20℃保存待测。整个操作过程注意避光,测样前用0.45 μm滤膜过滤。
色谱条件:使用Poroshell 120 EC-C18色谱柱(150 mm×2.1 mm, 2.7 μm);流动相A:(V甲酸∶V水=0.1∶100),流动相B:(V甲酸∶V甲醇∶V乙腈=0.1∶50∶50);柱温30 ℃;进样量为3 μL;梯度洗脱程序:0~27 min(90% A);27~28 min(44%A-56% B);28~33 min(90%A-10%B),洗脱时间为33 min,流速为0.2 mL/min。
质谱条件:ESI正离子模式下,离子源温度350 ℃;雾化器压力35 psi;干燥气流速12 L/min;干燥气温度350℃;离子扫描范围100~1 000 m/z。
定性分析:通过样品图谱信息与保留时间和谱库相应物质信息对比判定。
定量分析:采用Mv-3-O-Glu标准品进行外标法定量,其他花色苷酚以Mv-3-O-Glu当量计。
1.3.3 非花色苷酚的提取与测定
参照本实验室王凯丽[19]的方法并略作修改,具体操作如下。
非花色苷酚提取:准确称取2.5 g葡萄皮冻干粉,加入25 mL 90%(体积分数)乙酸乙酯水溶液,室温条件下于摇床中(160 r/min)提取30 min,收集上清液至250 mL圆底烧瓶。按上述步骤重复提取5次,合并上清液并旋蒸至干(120 r/min、30 ℃)后,用甲醇溶液定容至10 mL,于-20 ℃保存待测。整个操作过程注意避光,测样前用0.45 μm滤膜过滤。
色谱条件:使用Zorbax SB C18色谱柱(150 mm×2.1 mm,3.5 μm);流动相A:0.2%醋酸水溶液;流动相B:乙腈;流速:0.2 mL/min;30℃柱温;进样量10 μL。梯度洗脱程序:0~5 min(2%~7% B)、5~45 min(7%~30%B)、45~46 min(30%~65%B)、46~47 min(65%~95%B)、47~50 min(95%~2%B)。
质谱条件:ESI离子源温度350 ℃;负离子模式;雾化气压力为30 psi;干燥气流速10 L/min;干燥气温度350 ℃;离子扫描范围50~1 500m/z。
定性分析:通过样品图谱信息与保留时间和谱库相应物质信息对比判定。
定量分析:通过建立各非花色苷酚的标准曲线计算葡萄皮中非花色苷酚的含量。
1.4 试验数据与统计分析
使用Microsoft Excel 2010对试验所得数据进行整理,利用OriginLab Origin 9.1绘图,使用IBM SPSS Statistics 20.0进行多重比较(Duncan,P<0.05)及相关性分析,试验结果以平均值±标准偏差表示。
2 结果与分析
2.1 不同成熟期葡萄成熟度
糖酸比常用来表示葡萄的理论成熟度,也是目前评价葡萄成熟度最直观的指标[20]。在葡萄成熟过程中,总糖不断积累,总酸逐渐降低,造成糖酸比水平的逐渐升高。分析图1可知,随着葡萄的成熟,两供试基地的黑比诺葡萄糖酸比水平均呈现上升的变化趋势,在采收时其糖酸比分别达到整个变化的最高值32.55(莫高)和39.87(38°)。研究显示,糖酸比的高低对葡萄酒的质量至关重要,只有在糖酸比大于20时,才能具有酿造葡萄酒的质量潜力。分析本试验的结果我们发现,供试2个产地的样品均达到酿制葡萄酒的基本品质要求,特别是莫高基地的葡萄样品,其糖酸比还处于30~35,表明该样品的成熟度水平较优于38°基地样品(研究认为糖酸比超过40可能会造成葡萄酒的酒精度过高以及酒体不平衡等问题[21])。

图1 两个基地不同成熟期黑比诺葡萄糖酸比Fig.1 The sugar-acid ratio of Pinot Noir grapeat different ripening stages in two bases注:图中小写字母表示同一种植基地不同成熟期各水平间存在显著性差异(P<0.05)(下同)
2.2 花色苷酚
花色苷酚的合成与积累开始于转色阶段,是赋予葡萄及葡萄酒颜色的主要物质,其含量影响着葡萄浆果及葡萄酒的色泽、风味及营养价值等[22]。本试验初步测定出5种单体花色苷,分别为花青素-3-O-葡萄糖苷、花翠素-3-O-葡萄糖苷、甲基花青素-3-O-葡萄糖苷、甲基花翠素-3-O-葡萄糖苷和二甲花翠素-3-O-葡萄糖苷等,其中二甲花翠素-3-O-葡萄糖苷在所检测出的花色苷中含量最高,这与一些学者报道的有关欧亚种葡萄的花色苷含量特性相似。
由图2可知,从转色完成(T1)到采收结束(T4),38°和莫高2个供试基地葡萄样品的花色苷含量变化均呈现先降低后升高再降低的波动变化趋势,分别从起始(T1)的1 181.86和1 186.33 mg/kg逐渐下降至901.01和566.12 mg/kg(T2),又迅速积累至1 235.59和1 017.13 mg/kg(T3),并最终在采收时回落到821.21和738.76 mg/kg(T4时期)。这与马立娜[23]研究中发现的花色苷在成熟期含量逐渐增加的结果有一定差别。由图2-A、2-B可知,在T1到T3时期内,花翠素-3-O-葡萄糖苷和甲基花翠素-3-O-葡萄糖苷含量变化幅度较小,但到T4时期,二者含量均大幅降低;图2-C、2-D分别为花青素-3-O-葡萄糖苷与甲基花青素-3-O-葡萄糖苷在转色完成后的含量变化情况,这两种单体花色苷含量在葡萄成熟过程中也呈现波动变化,并且各个时期花青素-3-O-葡萄糖苷与甲基花青素-3-O-葡萄糖苷含量具有显著性差异(P<0.05),其中莫高样品中变化幅度更大;由图2-E可知,随着葡萄的成熟,二甲花翠素-3-O-葡萄糖苷含量变化幅度较小,且在T3时期含量达到最大值,但在T4时期,其含量出现大幅下降,并且显著低于转色完成时的含量。此外,由图2可知,在整个检测阶段,武威38°地区葡萄样品中总花色苷酚含量明显高于莫高地区,例如在T2时期,38°地区样品为后者的1.59倍;采收时其含量为后者的1.11倍。分析5种单体花色苷酚在各时期含量后发现,二甲花翠素-3-O-葡萄糖苷,在T5时期含量最高,为同时期花青素-3-O-葡萄糖苷的3.51倍,花翠素-3-O-葡萄糖苷的1.80倍,甲基花青素-3-O-葡萄糖苷的1.25倍和甲基花翠素-3-O-葡萄糖苷的1.09倍。
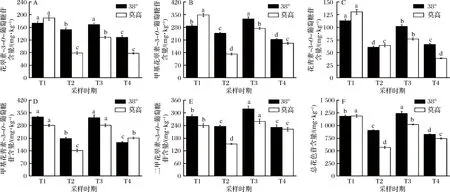
A-花翠素-3-O-葡萄糖苷;B-甲基花翠素-3-O-葡萄糖苷;C-花青素-3-O-葡萄糖苷;D-甲基花青素-3-O-葡萄糖苷;E-二甲花翠素-3-O-葡萄糖苷;F-总花色苷图2 两个基地不同成熟期黑比诺花色苷酚的含量Fig.2 The content of anthocyanin phenols in Pinot Noir at different ripening stages in two bases
花色苷的合成主要通过前体物质苯丙氨酸转化为各类花色苷,并受温度的调节[24]。有研究报道,葡萄中花色苷的含量在20 ℃时会显著提高,在30 ℃时花色苷的积累则会有所降低或是趋于停止。通过查阅当地的气象资料我们发现,武威38 °基地所处区域,同年第3季度虽昼夜温差(12 ℃)较莫高基地所在区域更大(10 ℃)。具体到本试验过程中花色苷含量的变化,我们分析这可能是供试区域花色苷含量出现波动的原因之一。而比较2个不同地区的样品发现,各类单体花色苷的含量也基本保持与总花色苷相同的变化规律,特别是在T2时期之后,各单体花色苷含量在武威38°地区葡萄样品中均明显偏高。例如,T2和T3时期,其花色苷含量分别是同期莫高基地葡萄皮样花色苷含量的1.59倍和1.21倍。上述不同基地各类花色苷表现出的差异,除可能受前述温度因素影响外,还可能与不同地区土壤养分以及当地的光照等因素有关。研究认为,每个地区由于地域性各具特点,土壤质地和土壤中所含的矿质元素和化学物质也都各不相同,武威莫高和38°地区虽在行政区划上属于武威市管辖,但是莫高葡萄种植基地位于武威东南部,而38°在武威北部,两者之间的直线距离为130 km。同时,38°地区地处腾格里沙漠边缘,其自然环境也与同区域的武威莫高有较大区别。因此推测这可能是导致同一葡萄品种在不同地区产生品质差异的原因之一。同时,在花色苷的合成过程中,光照的影响也很重要。对照两地的气象数据我们发现,同年第3季度,38°基地所在区域阴雨天气维持时间较长,其中8月份阴雨天气长达20 d左右,因此38°基地的黑比诺葡萄受光照时长应该比同期莫高基地的更少,但具体的内容还需做进一步的研究。
2.3 非花色苷酚
非花色苷酚是指除花色苷酚以外的酚类物质,具有增强葡萄酒色度和稳定颜色的作用[25]。本试验共检测出27种非花色苷酚,其中酚酸类8种、黄烷醇类6种、黄酮醇类12种和芪类1种,2个基地各类非花色苷物质总量如图4所示。由图3、图4-E可知,从T1到T4时期,总非花色苷酚含量均呈先升高后下降再升高的变化趋势,其中38°基地葡萄样品的变化幅度更大(38°:32.96%~69.41%;莫高:13.23%~56.55%),且均在完全转色两周后(T2)含量达到最大(38°:873.89 mg/kg;莫高:336.47 mg/kg)。

图3 两个基地不同成熟期黑比诺非花色苷物质含量的热图比较Fig.3 Comparison of thermal map of non-anthocyanin phenols content in Pinot Noir at different ripening stages in two bases
通过对检出酚类物质进行热图化处理(图3),可以看出随着两基地黑比诺葡萄的成熟,各非花色苷单体含量呈不同的变化趋势,其中儿茶素、表儿茶素、杨梅素、新落妇苷、异鼠李素-3-O-葡萄糖苷在各时期相对含量较高,而原儿茶酸、水杨酸、反式-肉桂酸、山奈酚、木樨草素等含量相对较低。同时,由数据可知,酚酸类物质在葡萄果皮中的含量均很低,而黄酮醇类物质含量相对较高,这个结果与王凯丽[19]在其他葡萄品种中的研究发现相似,但各单体非花色苷的含量及其随成熟过程含量的变化略有差异,分析这可能与葡萄品种以及环境因素有关。有研究显示,光照和温度可能会影响葡萄果实中酚酸的含量积累,韩钰[26]在检测疆内炎热地区赤霞珠葡萄果皮中酚类物质时发现,没食子酸含量在生长过程中与其他研究人员的发现有较大不同。同时,SPAYD等[27]试验表明,位于阴面的果实中的酚类物质的含量均低于位于阳面的葡萄果实,但是在生长季中气温偏高的时期,由于光照使果实表面温度以及果实周围的温度过高,将对果实品质带来不利的影响。而BAPTISTA等[28]研究也表明,不同产地内的葡萄多酚物质尽管在组成上较为相似,但是含量却有明显差异,这种不同除表现在地理方位因素外,还与不同地区下光强或光质强度有关。而综合葡萄植株的生长状况,年均温、降雨量、相对湿度、土壤条件、负载量等因素,这些均会对葡萄果实的生长发育具有一定的影响作用,并最终影响葡萄与葡萄酒中多酚潜能。当然,关于葡萄酒中的多酚含量还会与相应的生产及陈酿工艺有关,这些都将会造成其多酚类物质含量和组成的差异,影响每款葡萄酒的特征和风格。
2.3.1 酚酸类
酚酸是苯丙氨酸在苯丙烷类代谢合成的仅含一个苯环的多酚类物质,对葡萄酒的色泽具有重要作用。植物体内酚酸按其分子结构可分为7个碳原子的羟基苯甲酸(hydroxybenzoic acids,HBA)以及9个碳原子的对羟基肉桂酸(hydroxycinnamic acids,HCA)两类[29]。热图中由上至下,从没食子酸到阿魏酸为酚酸类物质,由图3、图4-A可知,随着葡萄的成熟,2个基地葡萄酚酸类物质的总量呈现不同的变化趋势,38°基地葡萄酚酸含量呈先下降后上升的趋势,而莫高基地葡萄酚酸含量先下降后上升再下降,并且2个基地的黑比诺酚酸含量均在T1时期最大,在T3、T4时期出现第2次高峰,但均显著低于T1时期。姜寿梅等[16]研究发现,葡萄在成熟过程中,酚酸含量为“升—降—升”的趋势,且转色完成时酚酸含量最高,这与本试验的研究结果相似。比较各单体酚酸物质发现,2个产地不同时期酚酸类物质中丁香酸含量相对最高,分别占同期酚酸类物质总含量的42.18%和63.92%,其次为香草酸(分别为27.18%和28.43%),而反式肉桂酸含量最低,仅占酚酸类物质总量的0%~1.01%。
2.3.2 黄烷醇类
黄烷醇是指经植物类黄酮代谢途径合成的黄烷醇单体,因其化学结构中C3环上存在羟基,因而也称黄烷-3-醇[30]。热图中由上至下,从儿茶素到原儿茶素B1为黄烷醇类物质,如图3、图4-B所示,试验共检测出6种黄烷醇类物质,其中儿茶素(9.63~98.78 mg/kg)、表儿茶素(2.39~50.00 mg/kg)是主要的黄烷醇,在两个基地中分别占同时期黄烷醇总量的9.12%~79.66%和12.46%~70.34%。从T1到T4时期,38°基地黑比诺在T1时期黄烷醇总含量达到最大(74.73 mg/kg),之后迅速下降,降低了64.93%,在T4时期,又急剧升高,其总含量与T1时期接近;莫高基地黄烷醇总量先急剧上升,在T2时期最高(336.47 mg/kg),随后又大幅降低,但在采收时呈上升趋势;同时还发现,不同的黄烷醇单体,其含量变化规律也不相同,这与温鹏飞等[31]的研究结果相近。DOWNEY等[32]研究表明,葡萄果实中黄烷醇类物质的含量受环境因素的影响较大,包括光照强度、温度、土壤类型、灌溉条件和果实成熟度等,并且与各化合物自身的稳定性也有很大的关系,结合两基地的实际环境条件,这可能也是引起黄烷醇含量差异的重要原因。
2.3.3 黄酮醇类
黄酮醇是葡萄与葡萄酒中的重要酚类化合物,其与葡萄酒的苦味、色泽密切相关。通常情况下,黄酮醇类物质主要以糖苷的形式存在于自然界中,但有时也会以游离态的形式存在[33]。热图中由上至下,从槲皮素到异鼠李素-3-O-葡萄糖苷为黄酮醇类物质,分析图3、图4-C可知,在葡萄成熟过程中,38°基地葡萄样品中黄酮醇总量呈先上升后下降再上升的变化趋势,T2时含量达最高值(834.48 mg/kg),而莫高基地葡萄样品中黄酮醇总量持续缓慢增加,采收时其含量为244.79 mg/kg。杨梅素和异鼠李素-3-O-葡萄糖苷是检出含量最高的两类黄酮醇,但其在2个基地的葡萄样品中变化趋势差异较大,在38°葡萄样品中先增加后减少再增加,T2时期含量最高(分别为584.71和71.12 mg/kg),而在莫高葡萄样品中先下降后上升。本试验共检测到12种黄酮醇类化合物,包括杨梅素、山奈酚、芦丁、槲皮素及其衍生物等,占非花色苷酚总量的82.23%,是葡萄中主要的非花色苷酚类物质,这与姜寿梅等[16]的研究结果类似。
2.3.4 芪类
芪类是指在植物体内经苯丙烷类和二苯乙烯类代谢途径合成的,主要包括白藜芦醇及其衍生物[34]。本试验检测出的芪类为白藜芦醇。由图3、图4-D可知,莫高基地黑比诺葡萄皮中白藜芦醇含量从T1到T4总体上呈先上升后下降的趋势,这与姜寿梅等[16]在西拉葡萄果皮中的研究结果一致。并且其含量在不同时期相比于其他酚类物质变化较小。而38°基地样品中白藜芦醇先大幅降低,最低只有1.17 mg/kg,随后升高至8.95 mg/kg,且相比T1时期降低了69.19%。
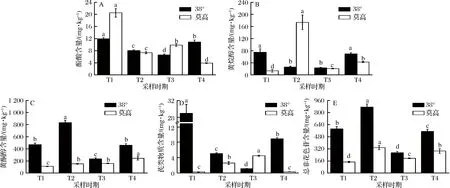
A-酚酸;B-黄烷醇;C-黄酮醇;D-芪类物质;E-总非花色苷图4 两个基地不同成熟期黑比诺各类非花色苷酚的含量Fig.4 The content of various non-anthocyanin phenols in Pinot Noir at different ripening stages in two bases
2.4 相关性分析
为探究黑比诺葡萄成熟度、花色苷酚总量、非花色苷酚总量及各类非花色苷酚含量之间的关系,故对两基地葡萄的糖酸比、花色苷酚总量、非花色苷酚总量以及四类非花色苷酚含量分别进行相关性分析,其结果见表2、表3。由表2可知,38°基地黑比诺葡萄的糖酸比与其葡萄皮中花色苷酚和非花色苷酚总量均为负相关,花色苷酚总量与非花色苷酚总量为显著负相关(0.5≤|r|<0.8)。四类非花色苷酚含量之间也具有一定的相关性,其中酚酸和黄烷醇以及酚酸和黄酮醇均为高度正相关(0.8≤|r|<1),芪类与黄烷醇为显著正相关,说明各类非花色苷酚在葡萄成熟过程中的合成与代谢会受到其他酚类物质的影响。由表3可知,莫高基地黑比诺葡萄的糖酸比与花色苷酚总量呈中度负相关(0.3≤ |r|<0.5),与非花色苷酚总量呈显著正相关,且花色苷酚总量与非花色苷酚总量呈高度负相关,同时酚酸与黄烷醇和黄酮醇均具有一定的相关性。
综合分析表2、表3可知,糖酸比与花色苷酚和非花色苷酚总量均有较高的相关性,表明在葡萄成熟过程中,葡萄皮中多酚类物质的合成代谢具有一定的内在规律,KENNEDY等[35]研究表明,酚类物质的生物合成和积累与葡萄果实生长发育进程,特别是成熟度密切相关,葡萄的成熟度不同,其果实内酚类物质的含量也不同,这与本试验的研究结果一致。此外,花色苷酚与非花色苷酚含量表现出很高的负相关,表明非花色苷酚与花色苷酚合成代谢过程中具有一定的相互制约的关系,但其内在的影响机制仍不清楚,还需进一步深入探究。
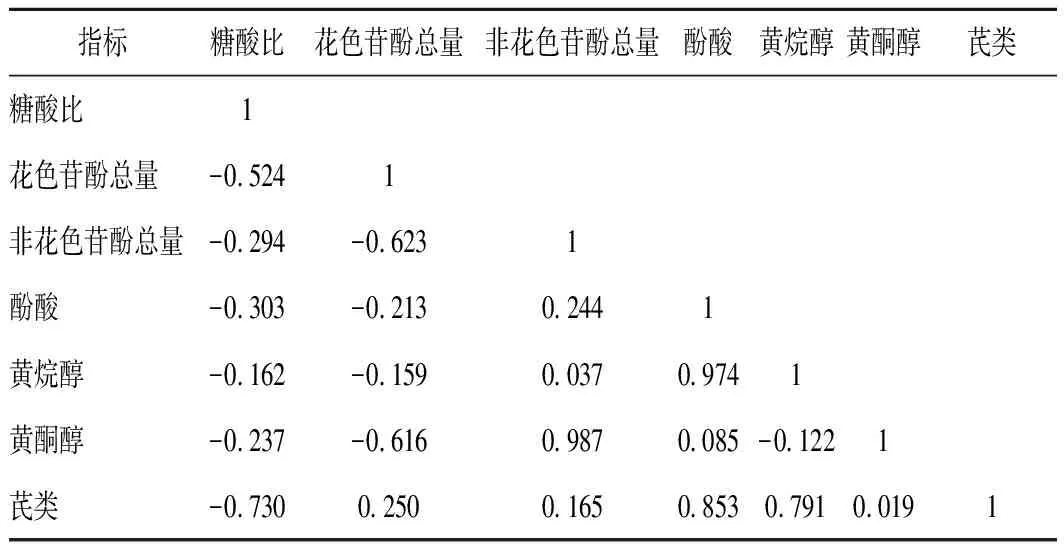
表2 38°基地黑比诺葡萄各指标的相关性分析Table 2 Correlation analysis of indexes of Pinot Noirgrape in 38° base
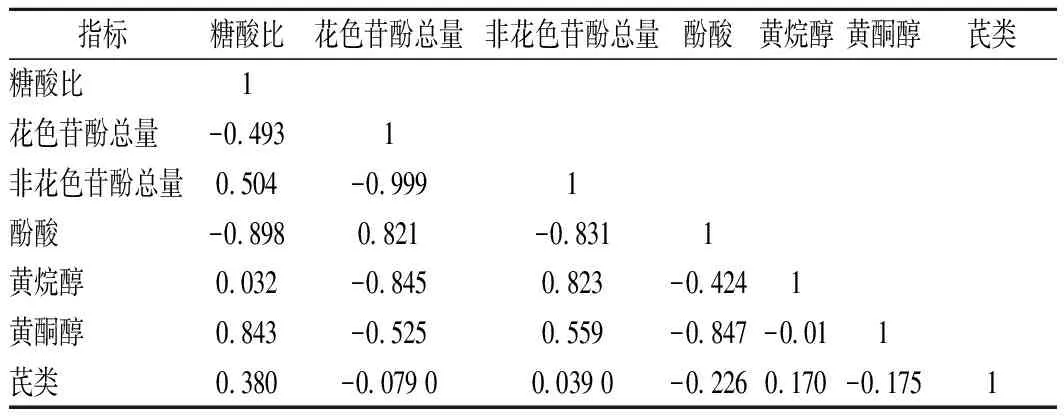
表3 莫高基地黑比诺葡萄各指标的相关性分析Table 3 Correlation analysis of indexes of Pinot Noirgrape in Mogao base
3 结论
本试验研究了甘肃武威地区内38°、莫高2个酿酒葡萄种植基地不同成熟期黑比诺葡萄的糖酸比以及果皮中花色苷与非花色苷酚的变化规律。研究结果表明:
(1)从转色完成到采收过程中,葡萄浆果的糖酸比逐渐升高,并且在T3时期,两基地的葡萄已基本达到最佳采收期;
(2)花色苷酚研究结果显示,在转色结束后葡萄果皮中花色苷酚含量呈现先减小后增大再减小的波动变化规律,并且T3时期的花色苷酚含量相对较高;
(3)非花色苷酚研究结果显示,2个基地非花色苷酚含量差异较大,其含量呈现先增大后减小再增大的变化趋势,最高含量大多集中在葡萄成熟的前中期;
(4)相关性分析结果显示,在葡萄成熟过程中,糖酸比与花色苷酚和非花色苷酚总量均有较高的相关性,总花色苷酚与总非花色苷酚之间呈高度负相关,酚酸的变化对果实中黄烷醇和黄酮醇的积累有一定的影响,且芪类与黄烷醇为显著正相关。

