不同采样方法对老年急性加重COPD病人下呼吸道病原学诊断的临床价值
COPD是一种慢性呼吸系统疾病,在中老年人群中发病率、致死率较高。老年COPD病人多因免疫力下降,肺功能降低,无法及时清除气道及肺内病原菌,导致反复发作急性加重(acute exacerbations of chronic obstructive pulmonary disease,AECOPD)。临床中AECOPD病人因下呼吸道标本送检合格率及送检标本病原菌检出率低等因素,不能及时诊断病原菌,导致临床常采用经验性抗感染药物。AECOPD病人下呼吸道的正常菌群易随着病情的进展发生变化,条件致病菌随之增多,这与临床广泛的抗感染药物运用有着密切的关系,同时也增加了临床治疗的难度和复杂性。因此寻找一种及时明确致病菌的方式,对临床诊疗工作具有重要的意义。
1 资料与方法
1.1 一般资料 选择2017年6月至2018年12月在我科住院的老年AECOPD病人256例。入选标准:所有病人均符合2017年修订版《慢性阻塞性肺疾病全球倡议(GOLD)指南》中制定的诊断标准[1],入院时有以下情况之一:(1)咳嗽咳痰、呼吸困难较平时加重;(2)痰量增多或咯黄色痰、脓性痰;(3)影像学有炎性改变。排除标准:(1)既往或本次入院肺功能存在通气或换气功能极重度下降;(2)最近发生急性冠脉综合征且病情尚未稳定;(3)SBP超过180 mmHg和(或)DBP超过110 mmHg未控制;(4)存在恶性心律失常;(5)有胸腹主动脉瘤且有破裂危险;(6)凝血功能异常,有出血倾向;(7)病人不能配合气管镜操作的。所有入选病人随机分为常规纤维支气管镜留取痰液组(A组)、常规纤维支气管镜留取痰液+250 mL肺泡灌洗液组(B组)、常规纤维支气管镜留取痰液+60 mL肺泡灌洗液组(C组)。病人均签署纤维支气管镜检查知情同意书。A组88例,男56例,女32例,年龄66~87岁,平均(76.52±10.35)岁,平均病程(20.69±9.85)年;B组86例,男58例,女28例,年龄63~86岁,平均(75.56±12.66)岁,平均病程(21.52±8.78)年;C组82例,男50例,女32例,年龄64~88岁,平均(75.82±11.93)岁,平均病程(20.35±9.20)年。3组性别、年龄、病程比较,差异均无统计学意义(P>0.05)。
1.2 方法
1.2.1 常规纤维支气管镜留取痰液:纤维支气管镜操作前,病人去枕平卧,头部后仰开放气道,2%利多卡因5 mL雾化吸入5 min麻醉咽喉部,鼻腔内滴入2%利多卡因0.5 mL,使用Olympus BF-P30进行操作,到达主支气管后,经气管镜操作孔送入一次性吸痰管吸取痰液后退出吸痰管,将吸痰管内痰液注入无菌痰液管送检。
1.2.2 肺泡灌洗液留取:根据影像学检查选择灌洗部位[2],影像学检查提示病变局限者,将气管镜顶端嵌顿于病变肺段或亚段的支气管开口处,弥漫性病变者选择右肺中叶或左肺上叶舌段[3]。在目标肺段注入2%利多卡因2 mL进行局部麻醉,麻醉生效后经操作孔分次快速注入37 ℃ 0.9%生理盐水250 mL,之后立即给予100 mmHg的负压进行吸引回收,回收液≥30%即可,获取肺泡灌洗液混合后送检。灌洗量为60 mL者,分3次灌入,每次20 mL,混合3次回收的灌洗液送检。操作过程中严密监测病人血压、心率及指脉氧,心率超过120次/min或SpO2低于80%时暂停操作,若心率、SpO2不能恢复则终止操作。
所有收集的标本均在2 h内送检[4],送检标本分别进行涂片检查及细菌培养。
1.3 合格标本判断 标本涂片后放置显微镜下观察,每低倍镜的多核白细胞数目>25个、鳞状上皮细胞数目<10个,或多核细胞数目/上皮细胞数目>2.5∶1,为合格标本。
1.4 合格标本病原菌检出率的判断 对合格标本进行细菌的定量培养,气管镜所取深部痰液标本,定量培养分离的致病菌或条件致病菌浓度≥107CFU/mL有临床诊断意义;肺泡灌洗液标本定量培养分离的致病菌浓度≥104CFU/mL时具有临床诊断意义[5]。
1.5 统计学方法 采用SPSS 17.0软件进行数据分析。计数资料用例数表示,组间比较采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 3组标本合格率比较 3组纤维支气管镜留取痰液标本合格率比较,差异无统计学意义(P>0.05)。B组及C组的肺泡灌洗液标本合格率均明显高于痰液标本,差异有统计学意义(P<0.01)。B组与C组的肺泡灌洗液标本合格率比较,差异无统计学意义(P>0.05)。见表1。

表1 3组标本合格率比较
2.2 3组合格标本病原菌检出率比较 3组痰液合格标本病原菌检出率比较,差异无统计学意义(P>0.05)。B组及C组的肺泡灌洗液合格标本病原菌检出率明显高于痰液合格标本,差异有统计学意义(P<0.01)。见表2。
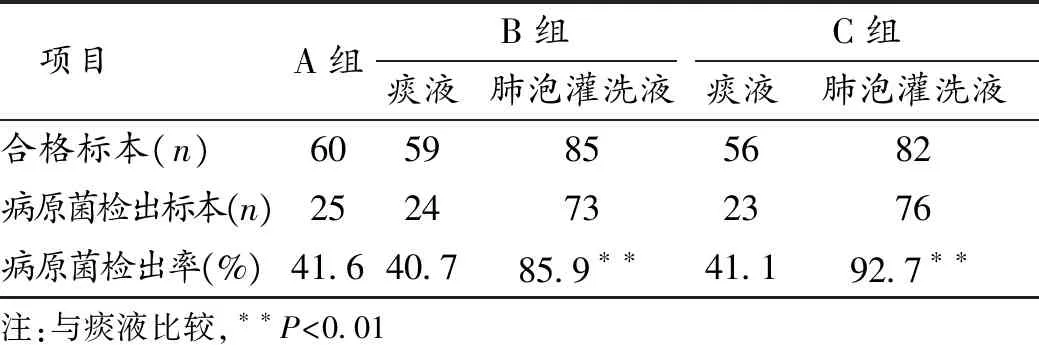
表2 3组合格标本病原菌检出率比较
3 讨论
COPD病人肺部的微生物群随着疾病的严重程度及急性加重而发生变化,如果不能及时明确病原菌,可能带来治疗上的困难,延长住院时间,增加治疗费用,甚至可能造成病人死亡率增加[6]。不同方法采集的标本合格率不同,对AECOPD合并下呼吸道感染病人的病原菌检出率差别较大,而合格标本又是保证检出病原菌准确性的前提。本研究中,肺泡灌洗液组的标本合格率明显高于无菌吸痰管留取的痰液(P<0.01),与国内其他研究结果一致[7],由此可见,为留取一份合格的标本,选择肺泡灌洗是较为理想的方法。B、C组的肺泡灌洗量虽然不同,但是2组灌洗后回收的标本,其合格率差异无统计学意义,该结果表明肺泡灌洗量不影响标本合格率。对合格标本进一步行病原菌检测发现,肺泡灌洗液病原菌检出率明显高于痰液(P<0.01)。笔者分析其与采样位置有关,肺泡灌洗时,气管镜可直接到达病变部位的肺段或亚段。本研究结果还显示分次多量灌洗所得灌洗液标本病原菌检出率高,但灌洗量250 mL与灌洗量60 mL所送检的标本病原菌检出率差异无统计学意义(P>0.05)。不同文献及指南对灌洗量的推荐有一定的差异[8-9]。国外相关动物研究推荐肺泡灌洗液量为250~500 mL[10]。国内肺泡灌洗病原学检查专家共识推荐量为60~120 mL,既有利于查找病原体,又可防止在灌洗过程中感染扩散[2]。
老年COPD病人,因病程相对较长,反复出现急性加重情况,使得病人下呼吸道存在一定的细菌定植情况,且细菌的定植率与下呼吸道感染频率相关[11]。随着纤维支气管镜在临床广泛运用,使用气管镜留取标本送检并及时获得准确病原菌的方法越来越受到临床的重视。无论经支气管镜使用一次性无菌吸痰管采集深部痰液,或定位于病变部位行支气管肺泡灌洗后留取肺泡灌洗液作为标本送检,均能避开口咽部的定植菌,在一定程度上减少了口咽部定植菌的干扰,且在镜下可以直接到达病灶部位进行采样,标本合格率较高,取得的标本细菌浓度较高,培养阳性率高,培养出的病原菌对临床诊断价值更高。由于纤维支气管镜已经在临床中普遍开展, 支气管肺泡灌洗只要严格按照纤维支气管镜检查的适应证及禁忌证开展此项检查,提高技能熟练程度,该项方法就可以安全开展,其安全性和耐受性得到国内外学者的认同[12]。
综上所述,对于老年AECOPD伴下呼吸道感染的病人,采用支气管肺泡分次灌洗且灌洗液总量为60 mL时,所获取的标本合格率较高,病原菌检出率较高。

