全脊椎切除治疗颈胸段脊柱肿瘤对神经功能的影响
刘志刚,郭庆功
(河南大学第一附属医院骨科,河南开封 475001)
颈胸段是连接前凸颈椎至后凸胸椎的一段脊柱,具有组织解剖结构复杂的特点,另外该处还包括多个重要的组织器官:食管、大动静脉、气管、肺脏及胸导管等[1]。目前,脊柱肿瘤患者多采用手术治疗,但由于颈胸段脊柱肿瘤发生率低,虽然全脊椎切除术已经取得了很大的进展,但仍然存在显露困难、并发症发生率高等不足,且国内外相关的研究报道也比较少,可借鉴的技术及经验也不够[2]。本研究重点探讨颈胸段肿瘤患应用全脊椎切除联合脊柱稳定性重建的疗效,现报道如下。
1 资料与方法
1.1 一般资料
选取河南大学附属第一医院2014年1月-2016年12月收治的颈胸段脊柱肿瘤患者27例,其中男14例,女13例;年龄21-65岁,平均(35.12±5.74)岁。术前评估:包括实验室检查和影像学检查。实验室检查包括血常规、尿常规、肝肾功能和血凝等;影像学检查判断肿瘤位置、严重程度、神经是否压迫和肿瘤是否转移等。术前穿刺活检进行脊柱肿瘤的病理诊断,与术后病理诊断相符合的有27例,甲状腺滤泡型转移癌4例(甲状腺均已切除),Ewing肉瘤3例,骨母细胞瘤7例,骨巨细胞瘤12例;前列腺癌转移瘤1例,肿瘤于3周时间发展至双下肢不全瘫,仍有加重趋势,因脊髓损害较严重且进展迅速而未进行病理检测,术后病理诊断为浆细胞性骨髓瘤。26例患者术前明确肿瘤侵袭范围,均行X线片、CT、增强MRI等检查,累及单节椎体C74例,T48例,累及两椎体T3-T44例,累及C7-T26例,T3-T54例。评价是否有转移灶:进行Tomita脊柱肿瘤外科分期,均为间室外病变,包括Ⅳ型、Ⅴ型、Ⅵ型:5例,13例,8例。经Tomita转移瘤外科治疗评分[3],有转移瘤10例。术前均均下胃管以防止误吸,为减少术中出血,27例术前行病椎选择性节段血管栓塞。本院医学伦理委员会审核并通过本研究。
1.2 手术操作
后路组:对14例肿瘤累及椎体T2-T4患者行单一后路全脊椎切除,患者后正中切口,显露病椎及附近椎体,切除2-4cm病椎旁双侧肋骨。置入椎弓根螺钉于病椎上下两个节段。显露壁层胸膜,钝性剥离椎旁组织。锯断病椎的椎弓根,切除后方附件,骨蜡封闭椎弓根离断处。由于妨碍游离、牵拉脊髓,3例结扎了神经根。仔细游离硬膜囊腹侧,尤其肿瘤突进椎管压迫硬膜囊的部分,伸入挡板保护脊髓。锯断椎间盘腹侧2/3,骨刀离断椎间盘背侧1/3,整块切除病椎椎体。之后采取钛网、前路钛板和钉棒进行系统重建,14例患者种采用自体骨和异体骨填充8例,采用自体肋骨填充6例。
前后路组:对13例肿瘤累及椎体C7-T1者,行一期前后联合入路全脊椎切除,3例采用前、后路顺序,10例采用后、前路手术顺序。切除病椎后方椎板、侧块等,颈椎及胸椎节段分别采用侧块及椎弓根固定。患者重新换为仰卧位,肩部垫枕,颈前横切口,离断肩甲舌骨肌,钝性分离至椎前,横断部分颈长肌,全脊柱切除病椎椎体和剩余部分的横突、侧块等。肿瘤切除后,伤口采用顺铂溶液浸泡2.5min,之后均采用钛网、前路钛板和钉棒进行系统重建,采用自体肋骨进行填充。
1.3 术后处理
术后病理检查切除的病椎及组织。伴术前脊髓压迫者,术后予以神经营养药物治疗,常规抗生素抗感染治疗7d。术后卧床7d,佩戴支具下地活动;指导患者肢体功能锻炼。依据肿瘤性质接受放疗3例,化疗2例,放疗加化疗2例。所有患者术后均进行3-24个月的随访。
1.4 观察指标
(1)采用疼痛程度数字评分(VAS评分)[4]评估2组患者手术前后的疼痛情况,分数越高表示疼痛值越高;(2)采用Frankel分级[5]分别于手术前后对所有患者进行脊柱稳定性神经功能评定,分为A级、B级、C级、D级、E级共5级,依次表示神经功能从完全丧失到完全恢复。(3)随访期间,2组患者均进行影像学检查观察植骨融合、复发、内固定稳定性,记录所有患者的生存情况。
1.5 统计学方法
2 结果
2.1 两组围术期情况
本研究中两组患者的死亡例数、手术时间、出血量之间比较,差异无统计学意义(P>0.05)。见表1。无窦道形成和脑脊液漏发生,伤口一期愈合。术中出现胸膜破裂3例,修补后观察术后无胸腔积液发生。一过性声音嘶哑2例,对症治疗后恢复。
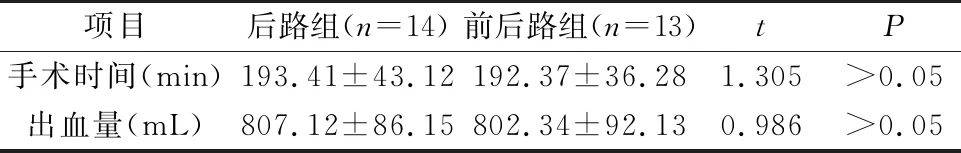
表1 两组围术期指标对比
2.2 两组患者神经功能及VAS评分对比
2例神经功能由Frankel D级下降至B级,其余患者术后Frankel分级均有明显改善,见表2。与术前比,2组患者术后3、6个月的疼痛VAS评分显著降低(P<0.01),见表3。
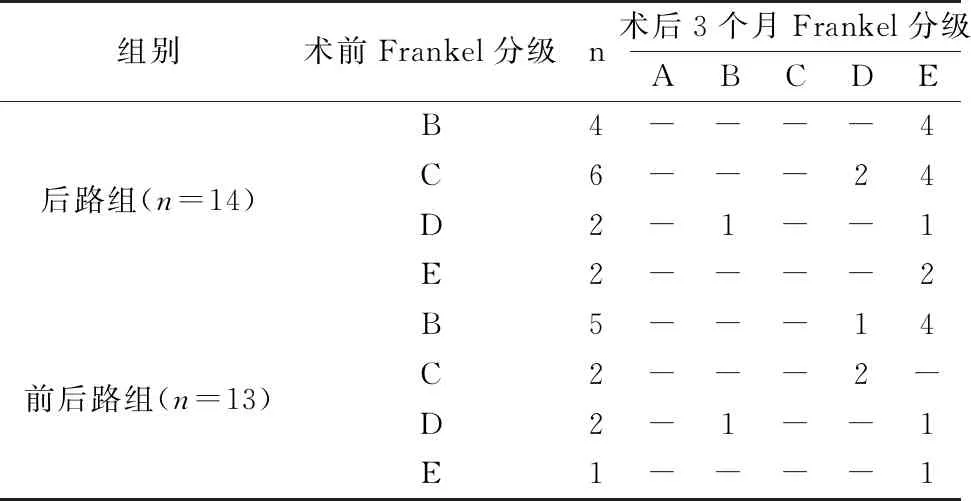
表2 2组患者术前后神经功能Frankel分级的比较(n)
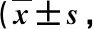
表3 2组患者术前后疼痛VAS评分的比较分)
注:术后3、6个月与术前比,*P<0.01
2.3 两组患者术后随访情况
术后随访3-24个月,平均(20.26±2.30)个月。27例患者神经功能均获得改善,随访期内均无局部复发及内固定失败病例;前列腺转移癌1例患者于术后17个月死亡,因肿瘤发生全身多处转移。所有病例均CT均显示植骨融合。
3 讨论
颈胸段脊柱恶性肿瘤较少,临床发生率低,当恶性肿瘤细胞破坏脊椎的骨性结构,容易出现后凸畸形和脊柱不稳定,损伤脊髓和神经,患者疼痛明显,出现不全截瘫甚至全瘫。因为胸腔的存在,颈胸段脊柱前方部位较深,外科手术中组织解剖显露困难是主要难点[6]。因此,本研究旨在探讨全脊椎切除联合脊柱稳定性重建治疗颈胸段肿瘤的治疗效果及对神经功能的影响。
全脊椎切除手术方式可分为前、后联合入路和单一后路两种。前方入路手术视野开阔,分离椎体周围组织相对更为直观,对血管、神经及周围重要器官的损伤也大大减轻[7]。脊柱重建手术操作过程中,前方重建时放置的内植物较切除的椎体高度明显缩短,后方钉棒系统重建时轻度的加压使得前方内植物牢靠和稳定[8]。较脊柱其他部位,颈胸段在生物力学及解剖结构方面较为特殊,造成C7-T1处应力集中[9]。本研究中,C7-T1段肿瘤患者中6例钛网填充自体骨,21例填充自体骨+异体骨,C7-T4段肿瘤行前后联合入路全脊椎切除,置入钛网并加用前路钛板,前柱内固定无移位或下陷,植骨均融合,可降低钛网移位或断裂的风险,增加前柱内固定的稳定程度。与术前比,2组患者术后3、6个月的疼痛VAS评分显著降低,前后路组与后路组在手术前后疼痛VAS评分差异不显著,表明两种全脊椎切除术联合脊柱重建手术均可以有效减轻患者痛苦,提高临床疗效。颈胸段脊柱肿瘤发生时,常容易出现脊柱不稳定和后凸畸形,出现严重疼痛[10]。两种手术方式都通过椎体间撑开操作,很好地重建了脊柱的稳定性,恢复了椎体正常序列。本研究术中进行了适当的椎体间撑开操作,有效纠正了后凸畸形,且前路操作直接去除了突入椎管内的脓肿占位,更有利于神经功能的恢复。本研究中的2组患者神经功能均获得改善或保持原有水平,表明这种手术方式的选择可以有效避免在处理颈胸段远端病变时前方入路带来的骨性结构和肺脏损伤,可以有效缓解肿瘤压迫,实现病变的彻底清除,具有很好的临床可行性和安全性,有利于患者术后恢复[11]。
综上所述,全脊椎切除联合脊柱稳定性重建可以获得满意的局部控制,有效减轻颈胸段肿瘤患者的痛苦,改善其神经功能,临床应根据肿瘤部位制定个体化手术方式及脊柱重建方案。

