浙贝母黑斑病致病菌的分离鉴定及分子检测
浙江中医药大学生命科学学院 杭州 310053
贝母(Fritillaria.sp)为多年生草本药用植物,药典收藏的有川贝母(Fritillaria cirrhosa D.Don)、伊贝母(Fritillaria pallidiflora Schrenk)、平贝母(Fritillaria ussuriensis Maxim)和浙贝母 (Fritillaria thunbergii Miq.)等8种。川贝母主产于四川、云南、甘肃等地,伊贝母主产于新疆、黑龙江等地,浙贝母是著名的“浙八味”之一,浙江、江西、湖南等省份有大面积栽培,浙江省主要分布在磐安、东阳、鄞县、缙云等县市,有300多年的种植历史,是当地农民收入的主要来源[1]。近年来,随着种植面积的不断扩大,特别是长期连作和鳞茎营养繁殖,导致贝母病害日益突出,严重影响贝母的产量和质量[2-3]。其中黑斑病是贝母的重要病害之一,主要危害叶片,浙江产区常于3月下旬开始发病,发病初期为叶顶端出现黄褐色水渍状病斑,病部与健康部有明显界限,后向基部蔓延,直至植株地上部分提早枯死,地下鱗茎瘦小,造成严重减产,特别是多雨年份病害更加严重[3-4];同时,黑斑病以菌丝及分生孢子极易在被害植株和病叶上越冬,第二年会再次浸染危害[5-6]。因此,贝母黑斑病的防控是保障贝母产业发展的重点[7]。
关于贝母黑斑病致病菌种类鉴定的研究报道极少,仅有的资料均主要依据真菌的菌落、菌丝及孢子形态、大小、色泽等形态学特征进行鉴定。例如,研究发现浙贝母黑斑病由半知菌亚门的交链孢菌(Alternaria alternate(Friss.) Keissler)侵染所致,病菌菌丝随病残组织遗落在土中越冬,第二年再次侵染贝母[3]。伊贝母黑斑病的致病菌为链格孢属真菌,但具体的种类未鉴定。而链格孢属真菌种类繁多,近缘种的菌落、菌丝和孢子形态相似,难以依靠上述特征加以区分[8]。分子生物学方法是目前普遍采用的真菌鉴定方法,真菌分类学家Woudenberg提出了以链格孢属真菌新的分子标准作为种水平的界定标准[9]。但至今未见对贝母黑斑病病原真菌的分子鉴定研究报道,贝母黑斑病是由链格孢菌还是其他链格孢属真菌侵染造成,亦或是多种链格孢属真菌侵染均可致病,至今尚不明确。为此,本研究拟采用多个基因片段作为DNA条形码,对田间采集的浙贝母黑斑病病原真菌进行分子鉴定,为贝母黑斑病的防治及病原真菌的流行病学研究提供实验基础。
1 材料和方法
1.1 材料
1.1.1样本收集 2015至2018年4年间,本实验室从浙江省磐安县新渥镇弹上村、新渥村和冷水镇白岩村等地陆续采集疑似浙贝母黑斑病病叶共12批次,用于分离纯化病原菌。见表1。
1.1.2主要试剂 基因组DNA提取试剂盒购自自宝日医生物技术(北京)有限公司(批号:9002-93-1);2×Taq Master Mix(含染料)购自上海生工生物工程公司(批号:F715KA2424);DNA的核糖体内转录间隔区(internal transcribed spacer,ITS)、翻译延伸因子-1α(translation elongation factor-1α,TEF-1α)、甘油醛-3-磷酸脱氢酶 (glyceraldehyde-3-phosphate dehydrogenase,G3PDH) 和RNA聚合酶Ⅱ亚基(the second largest subunit of the nuclear RNA polymerase enzymeⅡ,RPB2)的引物均由上海生工生物工程公司合成。见表2。

表1 浙贝母病株采集信息Tab.1 Information of disease strains of Fritillaria thunbergii Miq collection

表2 引物序列Tab.2 Primer sequences
1.2 方法
1.2.1病原真菌的分离纯化及形态学鉴定 采用植物患病组织分离法对病原真菌进行分离[9],将分离菌株纯化为单一菌种,根据其在马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上培养的菌落、菌丝和分生孢子等形态特征,参照文献[8]对病原真菌进行形态学鉴定,并保存于PDA斜面上备用。
1.2.2病原真菌的分子鉴定 选取经形态学鉴定为链格孢属(Alternaria genus)的真菌进行分子鉴定[2-3]。采用植物基因组DNA提取试剂盒提取基因组DNA,用真菌核糖体DNA ITS通用引物、TEF-1α、G3PDH和RPB2基因的引物分别对病原真菌进行PCR扩增。PCR反应体系为25μL:2×Taq Master Mix 12.5μL,上下游引物各1μL,模板DNA 1μL,ddH2O 9.5μL。各引物的PCR反应条件如表3。
PCR扩增产物于江苏金唯智生物科技公司双向测序,采用Codoncode Aligner软件拼接,以 GenBank数据库 (http://blast.ncbi.nlm.nih.gov/) 对序列进行BLAST比对分析,利用MEGA 7.0.26软件采用邻接法(neighbor joining,NJ)构建系统发育树,用1 000次重复Bootstrap检验系统发育树各分支的支持率,以支持率≥50%为阈值,作为成功鉴别物种的界限[10]。

表3 各引物的PCR反应条件Tab.3 PCR reaction conditions of each primer
1.2.3病原真菌的致病性检测 采用活体盆栽摩擦接种法检测其致病性。用接种针刺伤健康浙贝母幼苗的根部,将从病株上分离、纯化的菌株打成菌饼后覆于刺伤部位,并以铝箔纸覆盖,将接种空白PDA的刺伤植株作为对照组,重复4组。接种后的植株于室温培养,观察、记录植株发病情况,并从发病部位再次分离病原真菌,并检测是否为同一真菌[11]。
2 结果
2.1病原真菌的分离纯化和形态学鉴定 经分离纯化获得34株菌株。根据分离物在培养基上的菌落形态、菌丝及分生孢子形态的显微观察,其中15株菌株属于链格孢属真菌,其余为镰刀菌(Fusarium)、葡萄孢菌(Botrytis)、毛壳菌(Chaetomium)等其他菌种。15株链格孢属真菌菌株中,11株菌株的形态学特性如图1所示,菌落为圆形、毛毡状,菌落初期为白色,后渐变为青褐色至黑褐色,边缘灰白色,菌落背面呈黄褐色;菌丝生长旺盛,在光学显微镜下观察,菌丝有隔,无色或淡褐色、半透明,孢子链多为短分枝,具1~5个孢子;分生孢子单生或短链生,棕褐色,大多为倒棍棒形,纵横皆有隔膜,多为横隔膜,短喙或无喙。将各菌株初步定名为分离物1-1~1-11,初步鉴定为链格孢菌(Alternaria alternata,A.alternata)。另4株菌株的形态学特性如图2所示,菌落为近圆形、细毛毡状,菌落初期为灰白色,后渐变为青褐色至黑褐色,后期菌落产生黑色色素;菌丝有隔,无色或淡褐色、半透明,孢子链多为短分枝,具1~5个孢子;分生孢子单生或短链生,黄褐色,颜色较另外11株菌株稍浅,呈倒棍棒形,有纵横隔膜,纵隔膜较另外11株菌株更多,短喙或无喙。初步定名为分离物2-1~2-4,初步鉴定为细极链格孢菌(Alternaria tenuissima,A.tenuissima)。
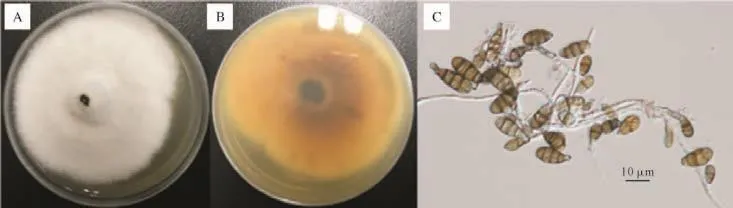
图1 分离物1-1~1-11的形态学特性Fig.1 Morphological characteristics of the isolates 1-1~1-11
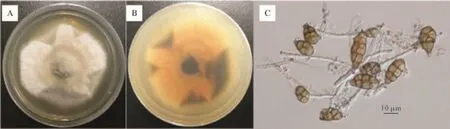
图2 分离物2-1~2-4的形态学特性Fig.2 Morphological characteristics of the isolates 2-1~2-4
2.2不同菌落DNA序列的变异分析 分离物1-1~1-11 PCR扩增的ITS、TEF-1α、G3PDH、RPB2片段长度分别均为562bp、261bp、945bp和645bp。见图3。经比对分析,分离物1-1~1-11各片段的DNA序列完全相同,判定来源于同一菌种,命名为分离物1。分离物2-1~2-4的相应片段长度分别均为566bp、282bp、942bp和644bp。见图3。经比对分析,4个分离物同一DNA的序列完全相同,来源于同一菌种,命名为分离物2。

图3 ITS、TEF-1α、G3PDH及RPB2序列PCR扩增产物电泳图谱Fig.3 Electrophoresis of PCR amplification products of ITS,TEF-1α,G3PDH and RPB2 sequences
2.3链格孢属真菌的多序列比对分析 将分离物1和分离物2与GenBank数据库中常见链格孢属真菌的ITS、TEF-1α、G3PDH及RPB2序列进行多序列比对。
2.3.1ITS序列的同源性比对 分离物1的ITS序列与GenBank中链格孢菌(登录号:MG182428)、细极链格孢菌(登录号:MF356594)、芸苔链格孢菌(登录号:MG733697)等16条序列的同源性均为100%;与葱链格孢菌(登录号:KU293590)、苹果链格孢菌(登录号:KU293580)同源性为99.82%;与长柄链格孢菌(登录号:MK675101)、鸭梨链格孢菌(登录号:MK675102)、乔木交链孢菌 (登录号:MK460966)、甘蓝链格孢菌(登录号:MK311298)同源性为99.64%。
分离物2的ITS序列与链格孢菌 (登录号:MK972905)、细极链格孢菌(登录号:MK967997)、长柄链格孢菌(登录号:MK675101)、鸭梨链格孢菌(登录号:MK675102)等102条序列同源性均为100%。分离物1、2之间同源性为98.23%,上述链格孢属真菌的ITS序列存在5个变异位点,560个保守位点,变异比例为0.88%。
2.3.2TEF-1α序列的同源性比对 分离物1的TEF-1α序列与链格孢菌(登录号:KY175227)、细极链格孢菌 (登录号:LT707524)等12条序列的同源性均为100%;与长柄链格孢菌(登录号:KY542121)同源性为98.89%;与乔木交链孢菌 (登录号:KY965831)为98.53%;与甘蓝链格孢菌 (登录号:MH424919)为88.21%;与芸苔链格孢菌 (登录号:KC584641)为86.55%。
分离物2的TEF-1α序列与细极链格孢菌 (登录号:LT707524)、链格孢菌(登录号:LC136862)等15条序列的同源性均为100%;与乔木交链孢菌(登录号:KY965831)同源性为98.58%;与长柄链格孢菌(登录号:KY549590)为98.63%。分离物1、2之间同源性为100%,上述链格孢属真菌的TEF-1α序列存在42个变异位点,168个保守位点,变异比例为20%。
2.3.3G3PDH序列的同源性比对 分离物1的G3PDH序列与链格孢菌(登录号:XM_018523704)的同源性为100%;与乔木交链孢菌(登录号:XM_028650964)同源性为99.67%;与A.alternate(登录号:LT707520)为99%。
分离物2的G3PDH序列与细极链格孢(登录号:KY290574、KP851965)的同源性为100%;与A.alternate(登录号:LT707520)同源性为99%;与苹果链格孢菌(登录号:AY762954)为99.34%。分离物1、2之间同源性为76.35%,上述链格孢属真菌的G3PDH序列有7个变异位点,511个保守位点,变异比例为1.35%。
2.3.4RPB2序列的同源性比对 分离物1的RPB2序列与GenBank中链格孢菌 (登录号:MG250634、KT889294)同源性均为100%;与细极链格孢菌(登录号:MG013472)、长柄链格孢菌(登录号:KY056664)同源性为99.17%;与乔木交链孢菌 (登录号:KC584377)为98.58%;与苹果链格孢菌 (登录号:LC275237)为99.07%;与芸苔链格孢菌 (登录号:MG250626)为92.33%。
分离物2的RPB2序列与细极链格孢菌 (登录号:LT707523、LC134328、LC134327、LC134326)的 同 源性均为100%;与链格孢菌(登录号:LC132704)同源性为99.26%;与乔木交链孢菌(登录号:MH345693)为99.05%;与芸苔链格孢菌 (登录号:KY549622)为92.37%。分离物1、2之间同源性为99.05%,上述链格孢属真菌的RPB2序列存在65个变异位点,643个保守位点,变异比例为9.18%。
2.4系统发育树的构建 选取ITS、TEF-1α、G3PDH及RPB2序列首尾相连,并引入离蠕孢属的玉米小斑病菌(B.maydis)和稻平脐蠕孢菌(B.oryzae)作为外群构建多序列系统发育树[12],系统发育树参比菌种序列的GenBank登录号见表4。链格孢属与离蠕孢属分为两个大组,链格孢属的大组又分为两大支,其中侵染链格孢菌(A.infectoria)单独为一支,其他链格孢属聚为另一大支,分离物1与链格孢菌聚在一起,分离物2与细极链格孢菌聚在一起;同时,系统发育树很好地显示了各链格孢菌属种间的亲缘关系。见图4。
2.5病原真菌的致病性测定 取分离物1和分离物2的菌饼接种健康浙贝母幼苗后,植株的发病症状与田间症状相同:叶尖卷曲枯萎,呈褐色渍状,有黑色斑点,病部与健康部有明显界限,菌种与接种真菌相同;对照组的浙贝母植株未出现任何发病症状。见图5。
表4 系统发育树参比菌种序列的GenBank登录号Tab.4 GenBank login number of phylogenetic tree reference strain sequence
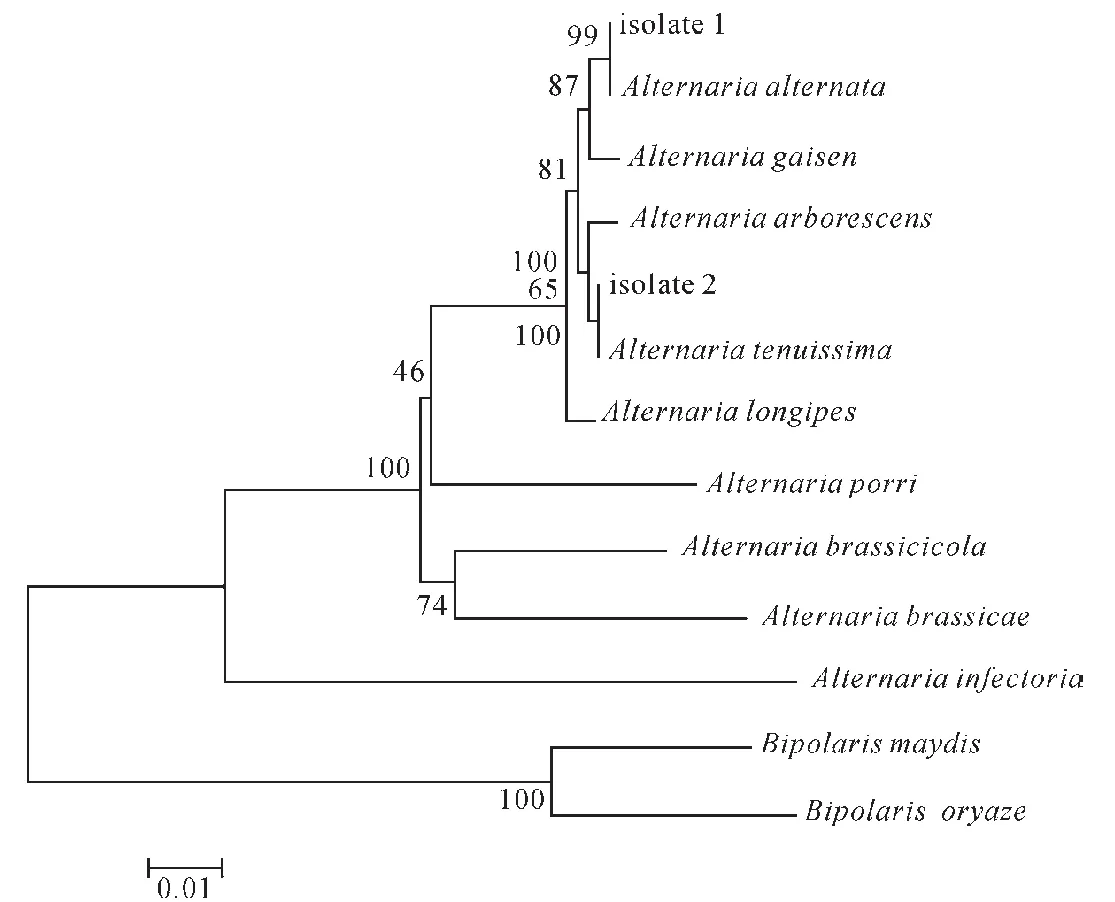
图4 系统发育树Fig.4 Phylogenetic tree

图5 浙贝母黑斑致病性测定结果Fig.5 Results of pathogenicity determination of black spot disease of F.thunbergii
3 讨论
浙贝母黑斑病是浙贝母的重要病害之一,以往的研究报道为链格孢菌侵染所致[4]。本研究中通过患病组织分离纯化,对菌落、菌丝和孢子形态进行观察及致病性检测,发现有两种链格孢属真菌可导致浙贝母黑斑病,分别为链格孢菌和细极链格孢菌,其中细极链格孢菌系首次报道为浙贝母黑斑病的病原真菌,这为浙贝母黑斑病的研究和防治提供了新的思路。此外,本研究的成果也为浙贝母干腐病、灰霉病等其他真菌性病害致病菌的分类鉴定提供了思路。
链格孢属真菌的属级形态特征较为明显,但仅仅根据菌丝形态和产孢表型难以区分鉴定到种,且其形态特征易受环境因素影响,尤其是链格孢小孢子种,其菌落形态差异有限。因此,近年来分子生物学技术逐渐成为当前链格孢属病原真菌分类鉴定的主要手段。Luan等[13]利用5.8S rDNA和ITS序列首次报道细极链格孢菌致蓝莓黑斑病。Berbegal等[14]利用ITS序列首次报道链格孢菌致石榴黑斑病。谢红辉[15]分析了41个链格孢属种和2个匍柄霉属种的5.8S rDNA和ITS序列,并构建了系统发育树,结果表明链格孢属种间形态差异大者可以根据序列分析加以区分,而形态差异小的则不能区分。因此,在分子鉴定过程中,需要多个DNA片段同时使用,才能达到鉴定的效果[14-18]。本实验在对分离物1和分离物2的鉴定中,利用菌落、菌丝和孢子形态观察法亦无法准确鉴定两种真菌的种类。因此,进一步采用DNA条形码技术进行种类鉴定,并不断增加DNA片段的种类,最后采用ITS、TEF-1α、G3PDH和RPB2等4个序列,并对上传至GenBank的所有链格孢属真菌的相应序列进行比对分析,发现上述几种基因序列的变异比例在0.88%~20%。该结果表明,不同DNA序列在链格孢属真菌种间的变异比例差异较大,较之ITS和G3PDH序列,RPB2和TEF-1α序列更能体现链格孢属真菌的种间差异,与Mangwende等[16]的研究结果不谋而合,后者基于RPB2、GAPDH和TEF-1α序列对胡荽黑斑病的致病真菌进行鉴定,证实其为链格孢菌。Luo等[18]则利用ITS、甘油-3-磷酸脱氢酶(glycerol-3-phosphate dehyodrogenase,gpd)、内聚半乳糖醛酸酶(endo-polygalacturonase,endo-PG)和RPB2等序列鉴定中国鸢尾叶斑病病原真菌为Alternaria iridiaustralis。
分离物1与GenBank中链格孢菌ITS、TEF-1α、G3PDH、RPB2序列的同源性均为100%,而上述序列与其他链格孢属真菌的同源性有部分未达到100%。因此,确定分离物1为链格孢菌。分离物2的ITS、TEF-1α、G3PDH、RPB2与GenBank中细极链格孢菌的同源性均为100%,与其他链格孢属真菌的同源性则有部分未达到100%。因此,确定分离物2为细极链格孢菌。利用4个DNA片段作为条形码可以准确地将分离物1和分离物2,即链格孢菌和细极链格孢菌鉴定出来,为田间浙贝母黑斑病病原真菌的分子鉴定提供了实验依据。从基于ITS、TEF-1α、G3PDH、RPB2序列同源性比对和多序列联合构建的系统发育树中可以看出,仅凭单一序列提供的信息位点来分析某些种间差异,无法鉴定到种。而结合多个序列联合比对的结果进行系统分析,可以清楚的将菌株鉴定到种,且可明确各菌种的种间亲缘关系。
一般认为,A.alternata和A.alternate均表示链格孢菌,但在上传至GenBank的序列中,两者的ITS、TEF-1α、G3PDH序列均存在显著变异。本研究中,分离物1的ITS、TEF-1α、G3PDH序列与A.alternata的相同,RPB2序列则有一个碱基的差异,与A.alternate的则均有差异;分离物2的ITS、G3PDH、RPB2序列与细极链格孢菌一致,而且ITS序列与A.alternate相同,但其余3个序列均与A.alternate不同。有研究认为,链格孢菌存在明显的遗传分化,说明链格孢菌可能是一个复合种[19]。因此,两者是否为不同的种仍有待于进一步研究。目前也有报道利用链格孢过敏原 (Alternaria alternata major allergen,Alta1)、endo-PG、大亚基 (large subunit,LSU)、OPA10-2、OPA1-3和OPA2-1串联序列进行链格孢属真菌系统发育分析,以作为分类依据对链格孢属进行分子鉴定[20-21]。笔者将会参考此类研究,在现有基础上增加部分DNA序列,进一步对两种浙贝母黑斑病的致病菌进行确认。
综上所述,本研究证实浙贝母黑斑病的病原真菌有链格孢菌和细极链格孢菌,其中细极链格孢菌首次被证明可引起浙贝母黑斑病。但本研究仅对浙贝母黑斑病样品进行了致病菌检测,川贝母、伊贝母等其他贝母黑斑病是否也与链格孢菌和细极链格孢菌相关,仍有待于增加样品种类、扩大样本量进一步深入研究。

