南极苔原沼泽温室气体通量变化特征及其对气候变化的响应
王培 叶文娟 朱仁斌 徐华
研究论文
南极苔原沼泽温室气体通量变化特征及其对气候变化的响应
王培1叶文娟1朱仁斌1徐华2
(1中国科学技术大学地球和空间科学学院极地环境与全球变化安徽省重点实验室, 安徽 合肥 230026;2中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室, 江苏 南京 210091)
以南极阿德雷岛苔原沼泽为研究区域, 2016年12月至2017年1月南极夏季期间观测研究了温室气体CH4、CO2和N2O通量的变化规律及其对环境因子的响应关系。结果表明: 光照条件下干旱苔原沼泽表现为CH4吸收, 通量为(–5.4±4.3) μg CH4·m–2·h–1, 半干旱苔原与淹水苔原沼泽表现为净排放; 三个类型苔原沼泽观测点均表现为N2O净吸收, 最高吸收通量出现在淹水苔原, 为(–2.6±2.4) μg N2O·m–2·h–1; 黑暗条件下苔原沼泽一致表现为CH4和N2O净排放。光照与土壤水分减少增加了苔原CH4有氧氧化吸收, 同时促进了反硝化作用对N2O的还原转化。观测期间所有观测点均表现为CO2的汇, 最高CO2净交换量与光合作用强度都出现在淹水苔原区, 分别为(–40.1±17.6) μg CO2·m–2·h–1和(91.2±26.5) mg CO2·m–2·h–1; 而最高苔原沼泽呼吸速率出现在干旱苔原观测点, 为(73.1±17.6) μg CO2·m–2·h–1。夏季适宜的温度、降水条件促进了苔原植被的光合作用, 增加了苔原沼泽CO2吸收量。CO2、N2O、CH4通量随时间变化的相互关系规律不显著(>0.05), 但在降水与温度波动下, N2O与CH4通量都随CO2通量呈现相似的波动。三种温室气体与各种环境因子之间的响应关系值得进一步研究; 不同光照条件对CH4、N2O排放量的估算有重要影响。
南极 苔原沼泽 CO2通量 N2O通量 CH4通量
0 引言
温室气体排放是导致全球气候变化的重要原因, 甲烷(CH4)、二氧化碳(CO2)和氧化亚氮(N2O)源汇过程及地域排放特征是全球变化研究的重点内容[1]。极区有着范围广阔的季节性苔原冻土, 冻土在能量交换、湿度通量、碳氮循环和气候变化中发挥着重要作用, 对全球气候变化的响应和反馈较为敏感[2-4]。全球变暖对极区冻土环境产生了重要影响: 冻土消融改变了极区植被、水文状况和土壤结构的稳定性, 导致土壤微生物数量、活性和活动层厚度发生显著变化; 冻土中所束缚的大量有机质释放, 使得土壤呼吸速率和甲烷、氧化亚氮等温室气体排放量增加, 温室效应增强[5-6]。因此, 开展极地苔原温室气体源汇过程及其对全球变化的响应研究成为环境科学研究的热点。
近年来, 围绕北极苔原冻土碳氮循环中温室气体通量的交换过程及其影响因素, 已开展了大量的现场观测与模式研究, 阐明了气候、植被和土壤冻融过程等对温室气体通量的影响[7-11]。研究结果表明: 北极苔原是CH4的一个重要排放源[12]; 气温的升高导致冻土融化, 观测到较高的苔原N2O和CO2排放量[7,13]。我国学者率先开展了南极苔原土壤CH4和N2O通量的观测研究, 研究了气候因子、土壤因子与动物活动等对苔原温室气体通量的影响[14-18], 研究结果表明: 南极地区海洋动物的活动明显增强了N2O与CH4的排放[15,19-20], 温度升高、降水增加促进了苔原植被生长, 也增强了CO2的吸收[21-22]; 气温上升加速南极土壤中有机质分解, CO2排放量升高[21]; 乔治王岛冰盖消融期土壤有机质增加, 温室气体排放量增加[23]; 玛格丽特湾CO2通量空间变化与不同的植被类型相关[24]; 默多克谷中非生物过程被认为主导CO2通量变化[25], 直接影响CO2净交换, 且土壤水分变化是影响苔原CH4通量季节变化的重要因素[26]。这些因素同时通过土壤-大气界面交换、有氧-厌氧等条件的调控对温室气体通量产生综合影响。
但是, 极地苔原温室气体源汇过程及其影响因素仍需进一步深入研究[17,27], 尤其是在南极高纬度沿海苔原地区。这对于丰富地域温室气体通量特征数据、分析全球气候变化下的响应与反馈具有重要意义。另外, 光照对温室气体通量的影响在森林、草地等生态系统的影响研究较多[28-29], 而在极地沿海苔原地区, 温室气体通量估算的影响研究尚不充分[30-31]。研究结果表明, 北极苔原忽视光照将高估CH4通量, 而低估N2O排放[32], 光照下紫外辐射强度的改变也对苔原CH4和N2O通量产生重要影响[17], 而在南极还未见有光照对南极苔原温室气体通量影响的研究报道。有鉴于此, 在2016—2017年中国南极第33次科学考察期间, 本课题组在南极长城站附近的阿德雷岛苔原区设置观测点, 分别在光照和黑暗条件下开展了不同类型苔原沼泽温室气体通量的观测, 以探讨南极不同类型苔原沼泽CH4、CO2、N2O通量的夏季变化规律, 及其对光照、温度和降水等气候因子的响应关系。
1 研究区域与方法
1.1 研究区域
研究区域位于长城站所在法尔兹半岛附近的阿德雷岛(Ardley Island)(62°13′S, 58°56′W; 长2.0 km、宽1.5 km)。该岛位于亚南极的乔治王岛(King George Island)西南端, 靠近南极半岛北部。根据长城站气象观测记录资料, 站区年平均气温约–2.5°C, 每年风速超过17 m·s–1的天数为133 d, 平均气压为9.893×104Pa, 平均湿度在89%以上, 年降水量约630 mm, 季节分配均匀, 以降雪为主。12月中旬地表积雪开始融化, 土壤亦随之解冻, 3月下旬多数土壤融化深度达到40—70 cm。阿德雷岛是国际南极科学研究委员会(SCAR)确定的特别保护区, 主要为低地苔原, 地势平坦, 苔藓、地衣和藻类是主要的植被类型[33]。该岛东部为企鹅聚集区, 中部为相对干燥且地形起伏的高地苔原区, 西部为全新世晚期形成的海岸阶地沼泽区域, 平均海拔10—14 m, 面积约0.25 km2, 有机粘土层约15—20 cm, 苔原沼泽由边缘相对干旱的地衣植被区逐步过渡到淹水的苔藓、藻类植被区[31,34]。
在阿德雷岛西部的苔原沼泽区域(62°12′39′′S, 58°56′51′′W), 选择干旱苔原(D)、半干旱苔原(M)、淹水苔原(W)三个典型区域设置温室气体通量观测点, 每个观测点均设置光照和黑暗条件(L/B)加以对比观测。
1.2 气体样品采集
在2016年12月至2017年1月期间, 采用静态箱式法观测温室气体通量[14-15]。在选取的观测点将底座插入土壤或沉积物表面下5 cm, 将有机玻璃箱(50 cm×50 cm×25 cm)放置于底座上, 底座与箱体连接槽处用水密封。使用透明箱观测光照条件下温室气体通量, 使用厚遮光布覆盖箱体来观测黑暗条件下温室气体通量。在密封后的30 min内, 在第0、15和30 min, 分别用两通针从采样箱内抽取箱内顶层空气体样品(同时间点抽取两次, 作为平行样), 储存到准备好的真空瓶(17.5 mL)内, 同时测量并记录箱内气温、观测点周边不同深度的土壤温度及天气状况。观测频率视天气条件每周1—2次, 观测时间为上午当地时间9:00—11:00, 这段时间土壤温度接近于日平均值。观测期间降水、气温、日辐射强度等气象数据来自中国南极长城站气象观测站。
1.3 温室气体测定与通量计算
CH4、CO2和N2O浓度在中国科学院南京土壤所土壤与农业可持续发展国家重点实验室测定。CH4浓度用装有氢火焰离子检测器(FID)的气相色谱(Shimadzu GC-12A, Kyoto, Japan)测定, 色谱柱长2 m, 为80/100 目Porapak Q 填充柱。柱温为80°C, 注射器、检测器温度均为200°C。载气为N2(40 mL·min–1), 燃气为氢气(35 mL·min–1), 助燃气体为空气(350 mL·min–1)[35]。CO2浓度使用带有热导检测器(TCD)的气体色谱检测, 活性炭色谱柱柱温为130°C, 检测器温度150°C, 炉温380°C, 进样量0.5 mL。N2O使用配备电子俘获检测器(ECD)的色谱(HP5890GC2ECD)检测, 采用Ar-CH4(95∶5) 气作载气, 流速30 mL·min–1, 柱温85°C, 检测器温度330°C,反吹时间2.8 min. 进样管体积1.17 mL, 标准气体测定相对标准偏差(RSD)小于1%[20]。温室气体通量在平均箱室温度下, 通过温室气体浓度随时间变化率来进行计算。净生态系统碳交换(NEE)通过在光照下测量CO2浓度变化率计算, 同时生态系统呼吸(ER)在黑暗下测定。在本研究中, 苔原呼吸速率同时包括土壤呼吸和植被呼吸, 类似于牧场或草地。总生态系统光合作用(GEP)由NEE与ER的差值计算[36]。
1.4 统计分析
观测数据在Windows 10系统下利用Microsoft Excel 2016、SPSS 20.0和OriginPro 2018软件进行统计分析。用标准误差(SE)来评估单个通量的不确定性, 对同一区域的气体通量取平均值, 所有温室气体通量的数据均表示为平均值±标准误差。利用多元回归分析气象因子与通量之间的相关性(MRA), 采用Pearson相关分析分别测试CO2净交换与呼吸和光合作用的相关性。
2 结果与讨论
2.1 通量观测期气候条件
2016—2017年夏季阿雷岛平均气温为(1.9±0.2)°C, 整个观测期平均气温呈上升的趋势, 1月中旬到2月上旬达最高, 随后开始下降。2个月份除个别天数外大多是在0°C以上(图1a)。观测期间降水量与大气相对湿度变化趋势较一致(图1b), 降水较多的时段集中在1月上中旬与2月上旬, 其他时段天气较好, 光照加强, 相对湿度下降。与2013—2014年、2014—2015年夏季气候条件相比, 平均气温增加且波动幅度减小, 日照强度与降水量同比也有所增加, 表明与往年相比, 2016—2017年夏季土壤冻融频率降低, 气候较温暖湿润(表1)。

图1 研究区域2016—2017年夏季气候特征. a)日照强度与平均气温; b)降水量与湿度
Fig.1. Meteorological characteristics during the 2016—2017 summertime in the study area. a) daily mean air temperature and sunlight time; b) precipitation and atmospheric moisture
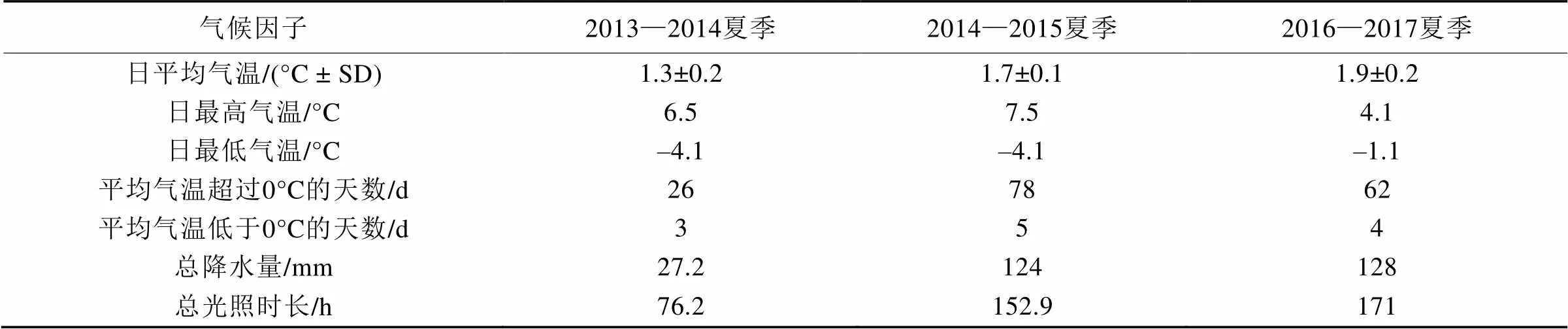
表1 近年来调查区域温室气体观测期的气候条件
2.2 苔原沼泽CH4通量
光照条件下, 干旱苔原观测点(DL)表现为CH4弱吸收, 平均吸收速率为(–5.4±4.3) μg CH4·m–2·h–1, 其他观测点均表现为CH4净排放, 其中最高平均排放速率为半干旱观测点(ML)的(16.8±9.5) μg CH4·m–2·h–1, 最高排放速率为67.3 μg CH4·m–2·h–1, 出现在淹水苔原观测点(WL)(表2)。半干旱苔原与淹水苔原的CH4平均通量较为接近, 且都高于干旱苔原观测点, 即它们的CH4排放通量高于干旱苔原, 这与之前的观测结果一致[34]。苔原土壤-大气CH4净交换通量由土壤中CH4的产生、传输和氧化过程所决定, 较高的土壤水分含量造成的厌氧条件, 有利于CH4产生, 同时抑制CH4氧化, 故苔原土壤水分状况是影响CH4通量变化的主导因素[31]。近年来, 厌氧CH4氧化过程研究表明湿地是不容忽视的CH4汇[37-39], 主要与硫酸盐还原与反硝化过程有关, 且一般速率较低[40-41]。因此, CH4氧化仍以有氧氧化为主。苔原湿地水位变化决定水气交换界面的位置, 形成不同的土壤含水量、含氧量与气体传输条件, 从而影响CH4产生及与CH4氧化相关的微生物活动[42-43]。
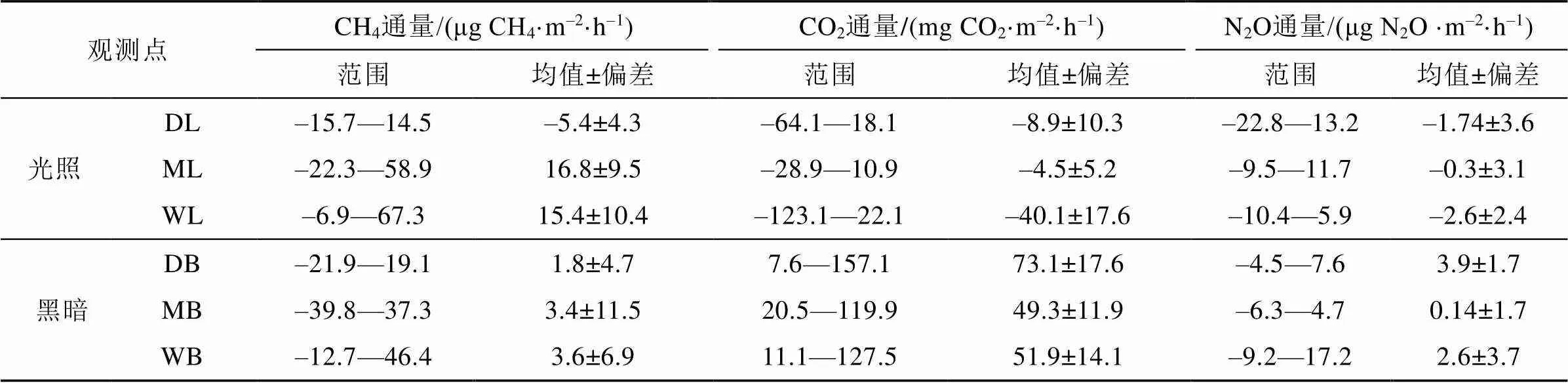
表2 在2016—2017夏季各苔原观测点光照与黑暗下温室气体通量比较
观测期间CH4平均通量表明, 光照增加了半干旱与淹水苔原的CH4排放, 但在干旱苔原反而转换为CH4吸收。半干旱与淹水苔原在光照条件下的CH4平均排放通量高于黑暗条件下, 可能的原因是苔藓在有氧条件下可以利用H2为电子载体还原CO2生成CH4[44], 光合作用增加了CO2利用速率, 植物根系分泌物为产CH4菌提供更多能量与营养物质[45], 从而促进苔原土壤CH4产生。另外光合作用与温度的改变引起苔藓植物气孔导度的变化, 从而影响CH4的传输而产生更多的CH4释放[46]。但与此相反, 干旱苔原光照下CH4平均通量(DL)相比较黑暗条件下(DB)表现为吸收, 光照下苔原植被光合作用增加土壤微环境的含氧量, 增强苔原土壤CH4有氧氧化。光照在干旱、半干旱和淹水苔原对CH4产生和氧化能力有着不同的影响, 从而导致排放与吸收通量变化的差异。
苔原夏季开始降水增多, 气温逐渐升高, 适合苔藓植物生长, 各观测点CH4排放通量逐渐上升, 到1月上旬时CH4排放通量达到峰值。随后一段时间内温度下降, 降水量减少, 苔藓生长受影响, 土壤间物质交换减弱, 有机质供给减少, 土壤含水量降低, 不利于厌氧条件形成, 从而促进土壤CH4氧化, 故CH4排放通量开始降低, 并出现CH4吸收。随后天气条件多变, CH4通量也存在较大的变化。通过对观测期气象因子与CH4通量多元回归分析, 干旱苔原CH4通量与气温呈显著负相关(回归系数=–0.78,<0.05), 与湿度显著正相关(=0.37,<0.05), ), 即气温上升与湿度较低时, CH4氧化作用增强, CH4吸收增多。淹水苔原CH4通量与降水量呈显著正相关(=0.94,<0.05), 降水量增加, 土壤中形成更多的厌氧区域, 增强了CH4产生。干旱、半干旱、淹水苔原三处观测点在光照与黑暗下的CH4通量变化波动都较大, 有时甚至变化趋势相反(图2)。大气与土壤间CH4交换受产生和氧化两个过程影响, 土壤中不同深度好氧与厌氧区域的变化较为复杂[47], 且苔藓植物生理活动易受天气条件影响, 影响CH4的传输释放。
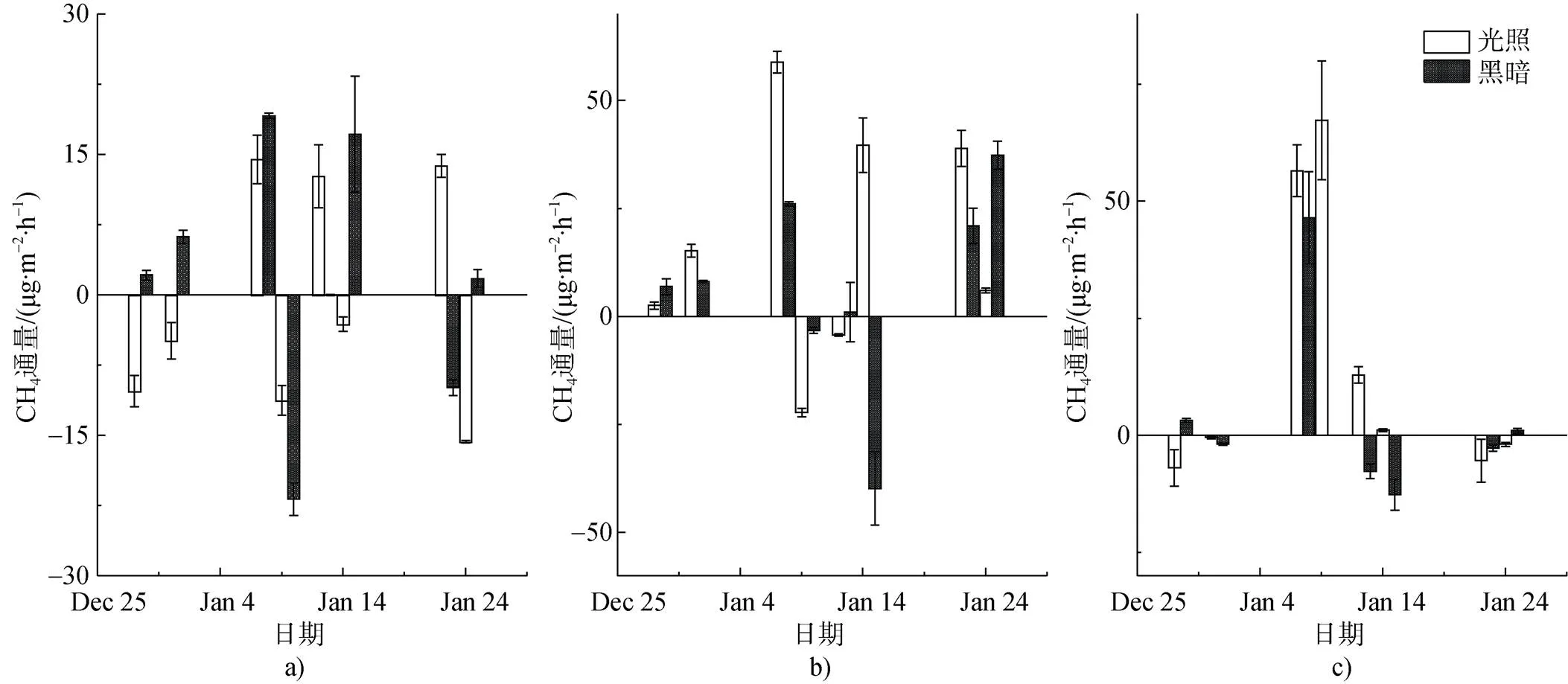
图2 在2016—2017年夏季观测期, 光照(L)和黑暗(B)条件下苔原沼泽CH4通量变化. a)干旱苔原区; b)半干旱苔原区; c)淹水苔原区
Fig.2. The CH4flux in the presence and total absence of sunlight during the summer of 2016—2017. a)dry site; b) mesic site; c) waterlogged site
2.3 苔原沼泽CO2通量
光照与黑暗条件下的CO2的通量变化如图3所示, 光照条件下NEE均值为负值(表2), 表现为CO2净吸收, 表明夏季生长期该区域苔原表现为大气CO2汇, 黑暗条件下无光合作用时的CO2通量即ER为正值, 表现为排放CO2。淹水苔原(WL)NEE平均速率为(–40.1±17.6) mg CO2·m–2·h–1, 明显高于干旱与半干旱苔原, GEP为 (–91.2± 26.5) mg CO2·m–2·h–1显示更强的CO2吸收能力。黑暗条件下测得的最大ER出现在干旱苔原(DB), 平均速率为(73.1± 17.6) mg CO2·m–2·h–1, 干旱苔原ER平均速率比其他观测点高(表2)。水分是苔藓植物生长的限制因子, 在光照下水分充足时, 植被光合作用加强[48-49], NEE最大。
NEE、GEP与ER都有相似的变化趋势(图4), ER增强时, NEE与GEP也相应增加, 到1月上旬达到峰值。NEE最高速率为–123.1 mg CO2·m–2·h–1(WL), ER最高速率为157.1 mg CO2·m–2·h–1(DB), 两者对气候条件有一致的响应关系。1月上旬降水较多, 土壤水分较充足, 气温适宜, 光照虽较少, 但苔藓植物的光合作用及其他代谢活动在弱光或中等光照强度下顺利进行[50], 而强烈的光照伴随着高温的综合作用, 会使苔原植被快速失水而变干燥, 反而降低了其活性[16,51], 这也是对极地环境长期适应和演化的结果。淹水苔原区在生长旺盛期的NEE与ER变化较小(图4c), 这可能由于过多土壤水分影响了底物与氧气的扩散, 从而使土壤呼吸速率急剧下降, 影响了CO2的交换[52-53]。所有观测点的ER与NEE均呈现显著负相关。NEE与ER的皮尔逊相关系数为: 干旱苔原=–0.89(=0.01); 半干旱苔原=–0.95(=0.01); 淹水苔原=–0.79(=0.05)。GEP与NEE的相关性为: 干旱苔原=0.61(=0.1); 半干旱苔原=0.69(= 0.05); 淹水苔原=0.87(=0.01)。淹水苔原的GEP与NEE相关性显著, 而在干旱苔原与半干旱苔原则相关性不显著。结果表明, 总体上观测期间该苔原沼泽区域ER对NEE的影响较大, 这与北极苔原[54-55]、林地[56]等其他生态区研究结果相似。
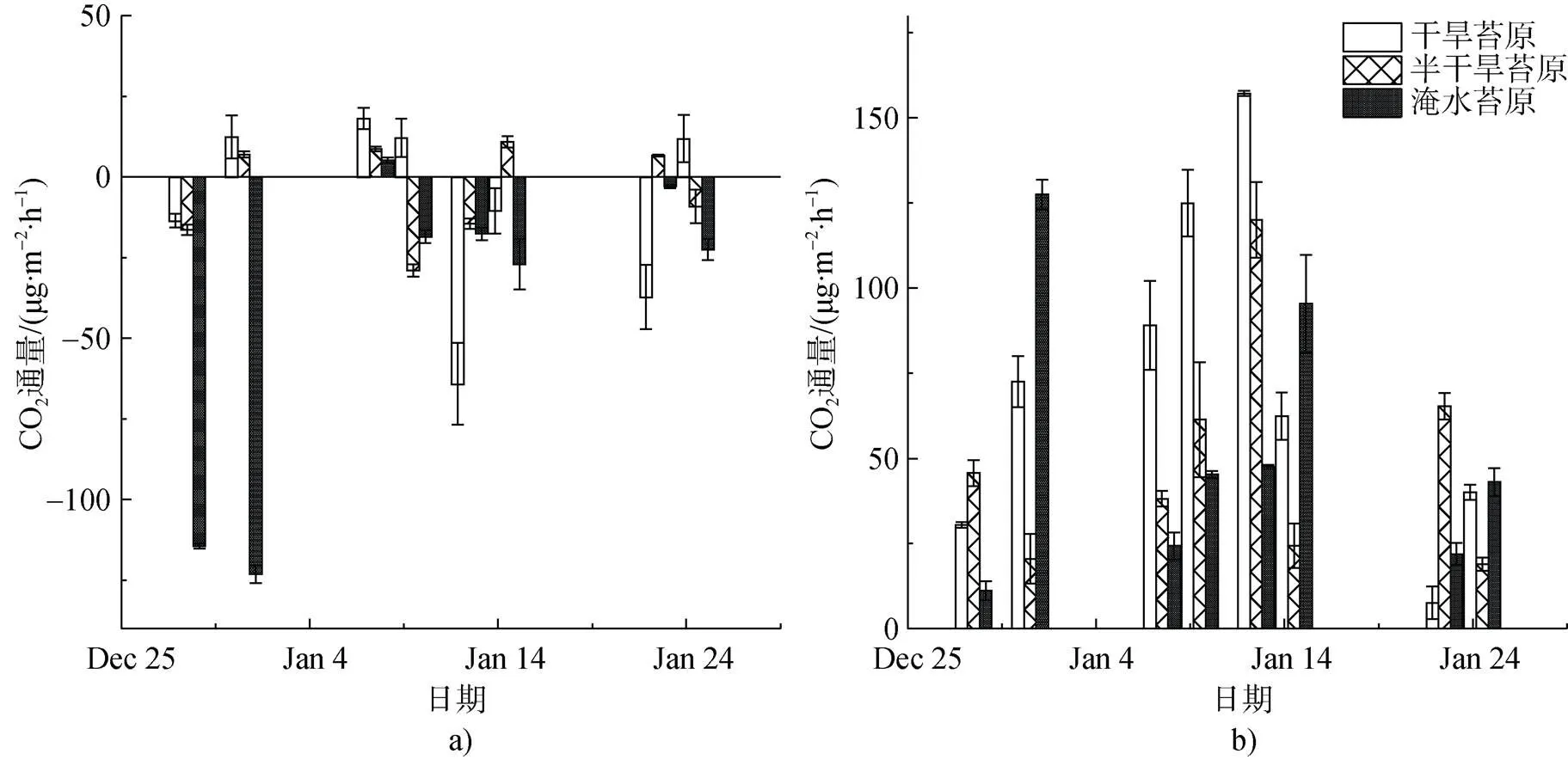
图3 在2016—2017年夏季观测期苔原沼泽CO2通量变化. a)光照条件下; b)黑暗条件下
Fig. 3. The mean CO2fluxes in the presence and total absence of sunlight during the summer of 2016—2017. a) the presence of sunlight; b) total absence of sunlight
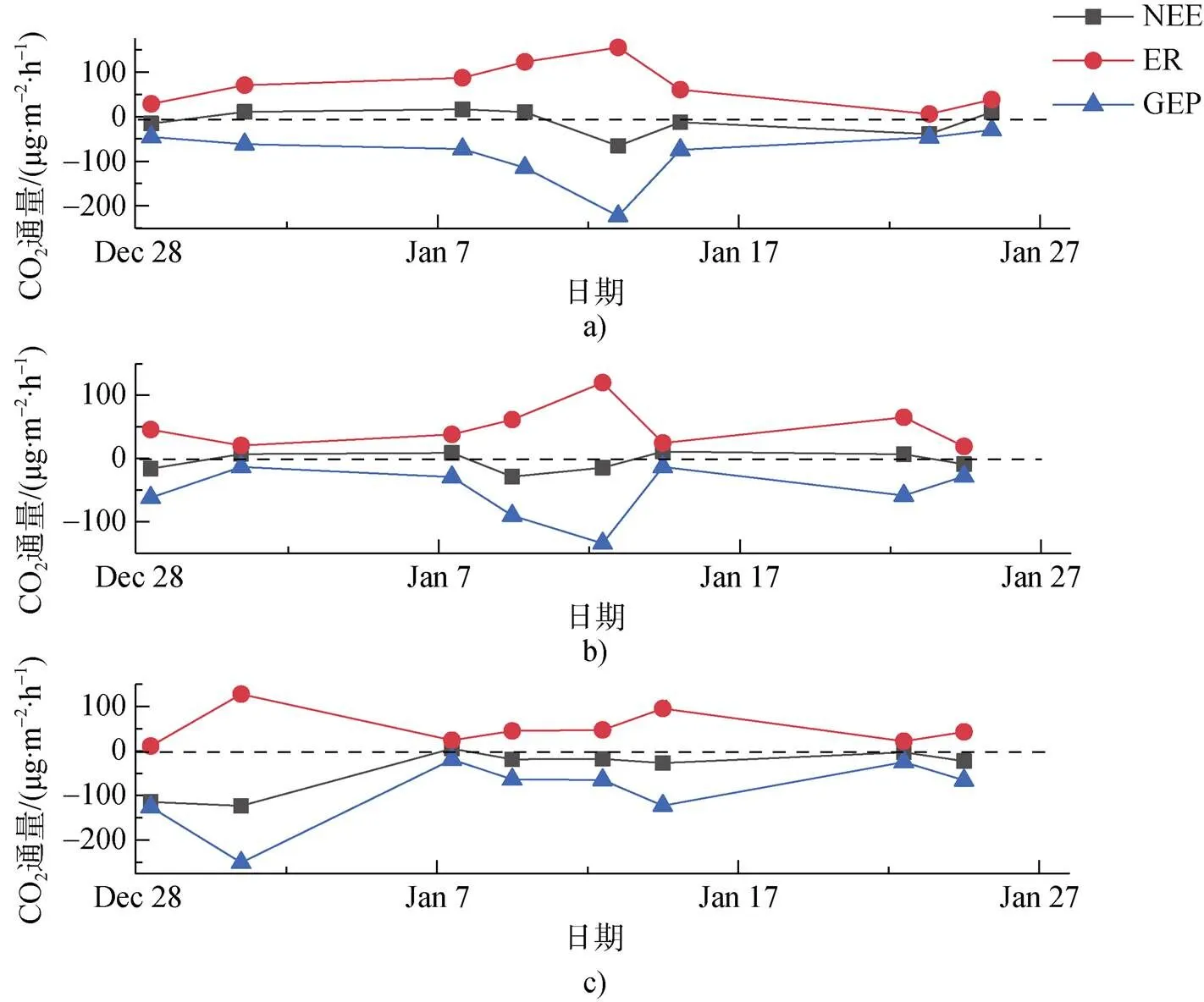
图4 在2016—2017年夏季观测期苔原沼泽CO2净交换量、生态系统呼吸与初级生产力变化趋势. a)干旱苔原区; b)半干旱苔原区; c)淹水苔原区
Fig.4. The variations of CO2net flux, ecosystem respiration and gross photosynthesis in 2016—2017 summer. a)dry site; b) mesic site; c) waterlogged site
2.4 苔原沼泽N2O通量
光照下干旱苔原、半干旱苔原和淹水苔原观测点N2O平均通量为负值(表2), 呈现出弱吸收, 在淹水苔原(WL)测得最高平均吸收通量(–2.6± 2.4) μg N2O·m–2·h–1。黑暗条件下所有观测区则呈现出N2O弱排放, 在干旱苔原(DB)测得最高平均排放通量(3.9±1.7) μg N2O·m–2·h–1。虽然观测期间黑暗下N2O平均通量表现为排放, 光照下表现为吸收, 但N2O通量整体上呈现出吸收与排放的快速转换(图5)。
土壤硝化、反硝化、硝态氮异化还原成铵作用(DNRA)以及化学反硝化等作用都能产生N2O。通常情况下, 土壤中N2O绝大多数来源于生物途径, 在好氧或半好氧条件下由硝化微生物作用产生, 在厌氧条件下则由反硝化细菌主导, 相对贡献取决于环境条件[57-58]。N2O是反硝化作用的中间产物, 反硝化细菌大多也具备将N2O还原为N2的能力, 是N2O转化吸收的主要过程[59-60]。光照直接影响苔藓植物生长和生理代谢, 增强植物根际物分泌作用, 间接改变土壤中反硝化细菌的丰度与活性, 增加N2O的吸收[61]。另外植物自身也可以产生释放N2O[62], 强烈的光照可以导致苔藓植物生长速度与相关硝酸还原酶的活性降低, 减弱N2O产生作用[63]。根据之前的研究, 极地苔原紫外辐射减少而N2O排放增强[17], 稻田生长季特别是持续淹水期, N2O还原转化加快, 由大气进入土壤的N2O也能被还原[59]。总体上观测区苔原生长期表现为大气N2O汇, 但吸收速率较低, 波动较大。
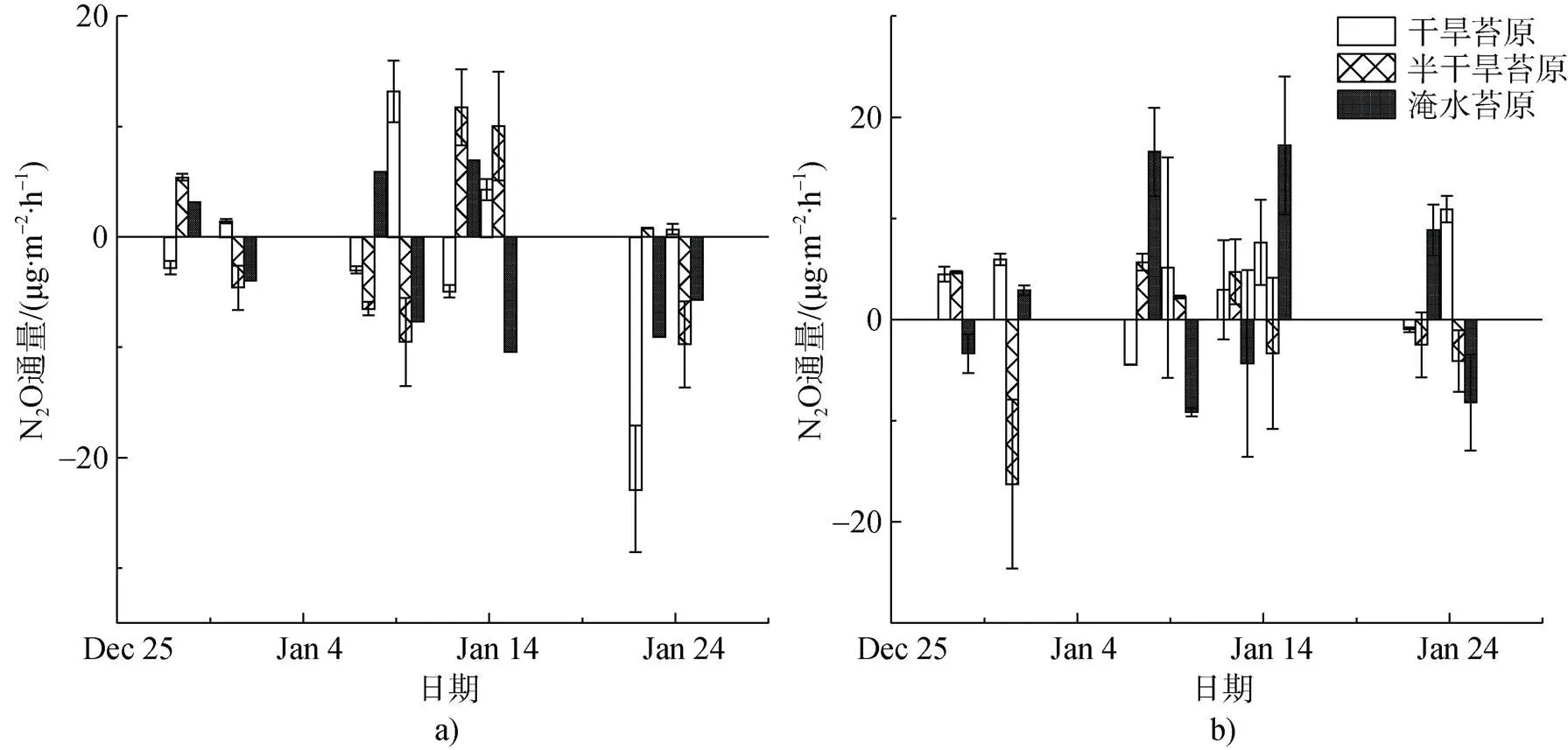
图5 在2016—2017年夏季观测期苔原沼泽N2O通量变化. a)光照条件下; b)黑暗条件下
Fig.5. The 2016—2017 summer mean fluxes of N2O in the presence or total absence of sunlight. a) the presence of sunlight; b) total absence of sunlight
2.5 苔原沼泽各种温室气体通量之间的关系
在干旱苔原, CH4、CO2和N2O三者的通量变化趋势差异较大, 不同观测时间点吸收或排放波动差异较大(图6a)。半干旱苔原区与淹水苔原1月上旬前吸收与排放变化趋势相似, 同一时间点都表现为吸收与排放。但1月上旬后表现为排放的相反规律(图6b, 6c)。三者之间的关系较复杂。之前的研究认为 CO2浓度升高会适当减缓CH4汇的作用, 甚至使苔原土壤由CH4汇变为源[48,64]。N素水平的变化会抑制土壤CH4氧化, 降低CH4吸收并增加N2O产生[15,31]。观测区域三种温室气体变化趋势差异较大, 在1月上旬CO2净交换量较高时, CH4与N2O通量波动较大。
3 结论
(1)总体上该区域内干旱苔原夏季表现为CH4汇, 半干旱和淹水苔原表现为CH4源。光照增强了半干旱和淹水苔原CH4的产生, 但在干旱苔原反而增加了吸收。
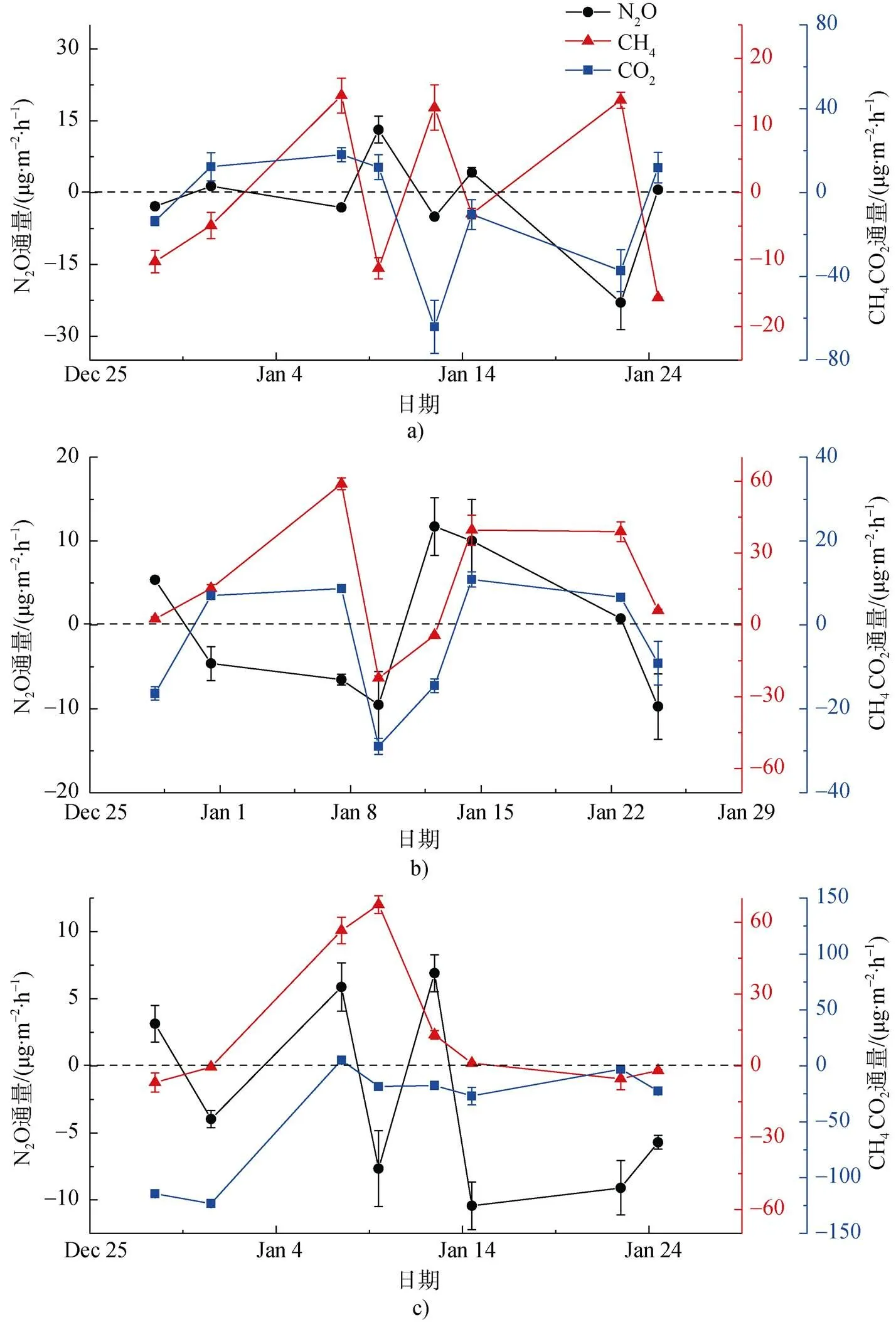
图6 在2016—2017年夏季观测期苔原沼泽CH4、CO2和N2O通量变化趋势. a)干旱苔原区; b)半干旱苔原区; c)淹水苔原区
Fig.6. The variations of CH4、CO2and N2O flux in 2016—2017 summer. a)dry site; b) mesic site; c) waterlogged site
(2)该区域夏季表现为CO2的汇, 最高ER和NEE分别出现在干旱和淹水苔原, ER对NEE的影响较大。
(3)夏季N2O通量呈现源汇的快速转换, 波动较大, 总体上光照条件下表现为N2O吸收, 在黑暗下表现为排放。
(4)该区域CO2、N2O和CH4通量随时间变化趋势差异较大, 与三种温室气体受不同的生物化学过程主导以及与各种环境因子之间的相互响应关系复杂有关。
致谢 感谢国家海洋局极地考察办公室和中国极地研究中心对该项研究野外科考工作的大力支持和帮助。
1 STOCKER T, Climate change 2013: the physical science basis: Working Group I contribution to the Fifth assessment report of the Intergovernmental Panel on Climate Change[M]. Cambridge: Cambridge University Press, 2014.
2 VAUGHAN D G, MARSHALL G J, CONNOLLEY W M, et al., Recent rapid regional climate warming on the Antarctic Peninsula[J]. Climatic Change, 2003. 60(3): 243-274.
3 TURNER J, LU H, WHITE I, et al. Absence of 21st century warming on Antarctic Peninsula consistent with natural variability[J]. Nature, 2016, 535(7612): 411-415.
4 SCREEN J A, SIMMONDS I. The central role of diminishing sea ice in recent Arctic temperature amplification[J]. Nature, 2010, 464(7293): 1334-1337.
5 ELBERLING B, CHRISTIANSEN H H, HANSEN B U. High nitrous oxide production from thawing permafrost[J]. Nature Geoscience, 2010, 3(5): 332-335.
6 DAY T A, RUHLAND C T, XIONG F S. Warming increases aboveground plant biomass and C stocks in vascular-plant-dominated Antarctic tundra[J]. Global Change Biology, 2008, 14(8): 1827-1843.
7 MARUSHCHAK M E, PITKÄMÄKI A, KOPONEN H, et al. Hot spots for nitrous oxide emissions found in different types of permafrost peatlands[J]. Global Change Biology, 2011, 17(8): 2601-2614.
8 ZHU R B, CHEN Q Q, DING W, et al. Impact of seabird activity on nitrous oxide and methane fluxes from High Arctic tundra in Svalbard, Norway[J]. Journal of Geophysical Research: Biogeosciences, 2012, 117(G4): 1-16.
9 BHULLAR G S, EDWARDS P J, OLDE VENTERINK H. Variation in the plant-mediated methane transport and its importance for methane emission from intact wetland peat mesocosms[J]. Journal of Plant Ecology, 2013, 6(4): 298-304.
10 KLAPSTEIN S J, TURETSKY M R, MCGUIRE A D, et al. Controls on methane released through ebullition in peatlands affected by permafrost degradation[J]. Journal of Geophysical Research: Biogeosciences, 2014, 119(3): 418-431.
11 MCEWING K R, FISHER J P, ZONA D. Environmental and vegetation controls on the spatial variability of CH4emission from wet-sedge and tussock tundra ecosystems in the Arctic[J]. Plant and Soil, 2015, 388(1/2): 37-52.
12 FRANCE J L, CAIN M, FISHER R E, et al. Measurements of δ13C in CH4and using particle dispersion modeling to characterize sources of Arctic methane within an air mass[J]. Journal of Geophysical Research: Atmospheres, 2016, 121(23): 14257-14270.
13 MARUSHCHAK M E, KIEPE I, BIASI C, et al. Carbon dioxide balance of subarctic tundra from plot to regional scales[J]. Biogeosciences, 2013, 10(1): 437-452.
14 SUN L G, ZHU R B, XIE Z Q, et al. Emissions of nitrous oxide and methane from Antarctic Tundra: role of penguin dropping deposition[J]. Atmospheric Environment, 2002, 36(31): 4977-4982.
15 ZHU R B, LIU Y S, XU H, et al. Marine animals significantly increase tundra N2O and CH4emissions in maritime Antarctica[J]. Journal of Geophysical Research: Biogeosciences, 2013, 118(4): 1773-1792.
16 ZHU R B, BAO T, WANG Q, et al. Summertime CO2fluxes and ecosystem respiration from marine animal colony tundra in maritime Antarctica[J]. Atmospheric Environment, 2014, 98: 190-201.
17 BAO T, ZHU R B, WANG P, et al. Potential effects of ultraviolet radiation reduction on tundra nitrous oxide and methane fluxes in maritime Antarctica[J]. Scientific Reports, 2018, 8(1): 3716.
18 孙立广, 谢周清, 赵俊琳, 等. 南极菲尔德斯半岛N2O浓度的监测[J]. 科学通报, 2000, 45(11): 1195-1199.
19 ZHU R B, LIU Y S, XU H, et al. Nitrous oxide emissions from sea animal colonies in the maritime Antarctic[J]. Geophysical Research Letters, 2008, 35(9): L09807.
20 孙立广, 朱仁斌, 谢周清, 等. 南极菲尔德斯半岛植被土壤N2O排放特征[J]. 环境科学, 2001, 22(4): 1-5.
21 PIRES C V, SCHAEFER C E R G, HASHIGUSHI A K, et al., Soil organic carbon and nitrogen pools drive soil C-CO2emissions from selected soils in Maritime Antarctica[J]. Science of the Total Environment, 2017, 596/597: 124-135.
22 ROYLES J, GRIFFITHS H. Invited review: climate change impacts in polar regions: lessons from Antarctic moss bank archives[J]. Global Change Biology, 2015, 21(3): 1041-1057.
23 THOMAZINI A, MENDONÇA E S, TEIXEIRA D B, et al. CO2and N2O emissions in a soil chronosequence at a glacier retreat zone in Maritime Antarctica[J]. Science of the Total Environment, 2015, 521/522: 336-345.
24 CANNONE N, BINELLI G, WORLAND M R, et al. CO2fluxes among different vegetation types during the growing season in Marguerite Bay (Antarctic Peninsula)[J]. Geoderma, 2012, 189: 595-605.
25 SHANHUN F L, ALMOND P C, CLOUGH T J, et al. Abiotic processes dominate CO2fluxes in Antarctic soils[J]. Soil Biology and Biochemistry, 2012, 53: 99-111.
26 CHRISTENSEN T R, EKBERG A, STRÖM L, et al. Factors controlling large scale variations in methane emissions from wetlands[J]. Geophysical Research Letters, 2003, 30(7):1-4.
27 LIU Y S, ZHANG W Y, ZHU R B, et al. Potential methane and nitrous oxide production and respiration rates from penguin and seal colony tundra soils during freezing-thawing cycles under different water contents in coastal Antarctica[J]. Advances in Polar Science, 2017, 28(1): 61-74.
28 WEHR R, MUNGER J W, MCMANUS J B, et al. Seasonality of temperate forest photosynthesis and daytime respiration[J]. Nature, 2016, 534(7609): 680-683.
29 BALDOCCHI D, CHU H S, REICHSTEIN M. Inter-annual variability of net and gross ecosystem carbon fluxes: a review[J]. Agricultural and Forest Meteorology, 2018, 249: 520-533.
30 ZHU R B, LIU Y S, XU H, et al. Carbon dioxide and methane fluxes in the littoral zones of two lakes, east Antarctica[J]. Atmospheric Environment, 2010, 44(3): 304-311.
31 ZHU R B, MA D W, XU H. Summertime N2O, CH4and CO2exchanges from a tundra marsh and an upland tundra in maritime Antarctica[J]. Atmospheric Environment, 2014, 83: 269-281.
32 LI F F, ZHU R B, BAO T, et al. Sunlight stimulates methane uptake and nitrous oxide emission from the High Arctic tundra[J]. Science of the Total Environment, 2016, 572: 1150-1160.
33 胡舜士. 南极菲尔德斯半岛南部植被类型、群落物种多样性及其保护[J]. 植物学报, 1997(10): 957-971.
34 孙立广, 朱仁斌, 谢周清, 等. 南极法尔兹半岛植被土壤CH4通量特征[J]. 环境科学学报, 2001, 21(3): 296-300.
35 孙立广, 朱仁斌, 谢周清, 等. 南极Fildes半岛CH4浓度监测[J]. 自然科学进展, 2001, 11(9): 995-998.
36 STRÖM L, CHRISTENSEN T R. Below ground carbon turnover and greenhouse gas exchanges in a sub-arctic wetland[J]. Soil Biology and Biochemistry, 2007, 39(7): 1689-1698.
37 WHALEN S C, REEBURGH W S. Consumption of atmospheric methane by tundra soils[J]. Nature, 1990, 346(6280): 160-162.
38 BOETIUS A, RAVENSCHLAG K, SCHUBERT C J, et al. A marine microbial consortium apparently mediating anaerobic oxidation of methane[J]. Nature, 2000, 407(6804): 623-626.
39 SEGARRA K E A, SCHUBOTZ F, SAMARKIN V, et al. High rates of anaerobic methane oxidation in freshwater wetlands reduce potential atmospheric methane emissions[J]. Nature Communications, 2015, 6: 7477.
40 VALENTINE D L. Biogeochemistry and microbial ecology of methane oxidation in anoxic environments: a review[J]. Antonie Van Leeuwenhoek, 2002, 81(1/2/3/4): 271-282.
41 KNITTEL K, BOETIUS A. Anaerobic oxidation of methane: progress with an unknown process[J]. Annual Review of Microbiology, 2009, 63(1): 311-334.
42 张坚超, 徐镱钦, 陆雅海. 陆地生态系统甲烷产生和氧化过程的微生物机理[J]. 生态学报, 2015, 35(20): 6592-6603.
43 唐千, 薛校风, 王惠, 等. 湖泊生态系统产甲烷与甲烷氧化微生物研究进展[J]. 湖泊科学, 2018, 30(3): 597-610.
44 CONRAD R. Contribution of hydrogen to methane production and control of hydrogen concentrations in methanogenic soils and sediments[J]. FEMS Microbiology Ecology, 1999, 28(3): 193-202.
45 LIU D Y, DING W X, YUAN J J, et al. Substrate and/or substrate-driven changes in the abundance of methanogenic Archaea cause seasonal variation of methane production potential in species-specific freshwater wetlands[J]. Applied Microbiology and Biotechnology, 2014, 98(10): 4711-4721.
46 CHANTON J P. The effect of gas transport on the isotope signature of methane in wetlands[J]. Organic Geochemistry, 2005, 36(5): 753-768.
47 REEBURGH W S, HIRSCH A I, SANSONE F J, et al. Carbon kinetic isotope effect accompanying microbial oxidation of methane in boreal forest soils[J]. Geochimica et Cosmochimica Acta, 1997, 61(22): 4761-4767.
48 朱仁斌, 孙立广, 谢周清, 等. 南极菲尔德斯半岛植被微区CO2浓度的监测[J]. 环境科学, 2001, 22(4): 6-10.
49 陈清清, 朱仁斌, 徐华. 北极新奥尔松地区夏季近地面CO2、CH4和N2O浓度的观测研究[J]. 极地研究, 2013, 25(2): 49-59.
50 GREEN T G A, SCHROETER B, KAPPEN L, et al. An assessment of the relationship between chlorophyll a fluorescence and CO2gas exchange from field measurements on a moss and lichen[J]. Planta, 1998, 206(4): 611-618.
51 吴玉环, 黄国宏, 高谦, 等. 苔藓植物对环境变化的响应及适应性研究进展[J]. 应用生态学报, 2001, 12(6): 943-946.
52 DAVIDSON E A, VERCHOT L V, CATTÂNIO J H, et al. Effects of soil water content on soil respiration in forests and cattle pastures of eastern Amazonia. Biogeochemistry, 2000. 48(1): 53-69.
53 LIU X Z, WAN S Q, SU B, et al. Response of soil CO2efflux to water manipulation in a tallgrass prairie ecosystem[J]. Plant and Soil, 2002, 240(2): 213-223.
54 OECHEL W C, VOURLITIS G L, HASTINGS S J, et al. Acclimation of ecosystem CO2exchange in the Alaskan Arctic in response to decadal climate warming[J]. Nature, 2000, 406(6799): 978-981.
55 VOURLITIS G L, OECHEL W C. Eddy covariance measurements of CO2and energy fluxes of an Alaskan tussock tundra ecosystem [J]. Ecology, 1999, 80(2): 686-701.
56 REICHSTEIN M, TENHUNEN J D, ROUPSARD O, et al. Ecosystem respiration in two Mediterranean evergreen Holm Oak forests: drought effects and decomposition dynamics[J]. Functional Ecology, 2002, 16(1): 27-39.
57 STEVENS R J, LAUGHLIN R J, BURNS L C, et al. Measuring the contributions of nitrification and denitrification to the flux of nitrous oxide from soil[J]. Soil Biology and Biochemistry, 1997, 29(2): 139-151.
58 KUENEN J, ROBERTSON L A. Combined nitrification-denitrification processes[J]. FEMS Microbiology Reviews, 1994, 15(2/3): 109-117.
59 OKEREKE G U. Growth yield of denitrifiers using nitrous oxide as a terminal electron acceptor[J]. World Journal of Microbiology & Biotechnology, 1993, 9(1): 59-62.
60 CAI Z, XING G, YAN X, et al., Methane and nitrous oxide emissions from rice paddy fields as affected by nitrogen fertilisers and water management[J]. Plant and Soil, 1997. 196(1):7-14.
61 JOHNSON D, CAMPBELL C D, LEE J A, et al. Arctic microorganisms respond more to elevated UV-B radiation than CO2[J]. Nature, 2002, 416(6876): 82-83.
62 HAKATA M, TAKAHASHI M, ZUMFT W, et al. Conversion of the nitrate nitrogen and nitrogen dioxide to nitrous oxides in plants[J]. Acta Biotechnologica, 2003, 23(23): 249-257.
63 KRYWULT M, SMYKLA J, WINCENCIAK A. The presence of nitrates and the impact of ultraviolet radiation as factors that determine nitrate reductase activity and nitrogen concentrations inDesv. around penguin rookeries on King George Island, maritime Antarctica[J]. Water, Air, & Soil Pollution, 2013, 224(5): 1563.
64 朱仁斌, 孙立广, 邢光熹, 等. 南极苔原近地面CO2、CH4、N2O浓度和通量的相互关系[J]. 中国科学技术大学学报, 2001. 31(5): 611-617.
VARIATION OF SUMMERTIME GREENHOUSE GAS FLUXES FROM TUNDRA MARSHES AND THEIR RESPONSE TO CLIMATE CHANGE IN MARITIME ANTARCTICA
Wang Pei1, Ye Wenjuan1, Zhu Renbin1, Xu Hua2
(1Polar Institute of Polar Environment, University of Science and Technology of China, Hefei 230026, China;2State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Science, Nanjing 210091, China)
During the austral summer of 2016—2017, CH4, CO2, and N2O fluxes and selected environmental variables were measured over tundra marshes on Ardley Island in maritime Antarctica. In the presence of sunlight, a net CH4flux of−5.4±4.3 μg·m−2·h−1was measured at the dry tundra site, while net CH4emissions were detected at the mesic and waterlogged sites. Under sunlight conditions, maximum N2O flux was −2.6±2.4 μg·m−2·h−1, and was measured at the waterlogged site; all sites showed net N2O consumption. In the total absence of sunlight, all sites showed net CH4and N2O emissions. Light and water enhance CH4consumption via aerobic oxidation and promote denitrification and the subsequent formation of N2O. Under sunlight conditions, all three sites acted as CO2sinks. The highest net CO2flux and photosynthetic flux occurred at the waterlogged site (−40.1±17.6 mg·m−2·h−1and −91.2±26.5 mg·m−2·h−1), while the highest ecosystem respiration rate occurred at the dry tundra site (73.1±17.6 μg·m−2·h−1). Favorable temperature and precipitation conditions during the Antarctic summer promote photosynthesis in tundra vegetation, resulting in increased CO2uptake by marshes. Relationship between time and fluxes of the three greenhouse gases is not statistically significant (>0.05). However, under the conditions of variable precipitation and temperature, fluctuations in N2O and CH4fluxes are similar to those in CO2. Results indicate that different light conditions, even those under the same sunlight intensity, have considerable influence on estimates of CH4and N2O fluxes. Relationships between the three greenhouse gases and between the gases and various environmental factors deserve further study.
Antarctic, tundra marsh, CO2fluxes, CH4fluxes, N2O fluxes
2019年4月收到来稿, 2019年6月收到修改稿
国家自然科学基金(41576181, 41776190)和中国科学院战略性先导科技专项(XDB40000000)资助
王培, 男, 1982年生。博士研究生, 主要从事环境地球化学方面研究。E-mail:wpei@mail.ustc.edu.cn
朱仁斌, E-mail: zhurb@ustc.edu.cn
10. 13679/j.jdyj.20190019

