外泌体膜蛋白功能研究进展*
郭玲慧,王 炜,蒋 露,任伟宏**,贺 娇,郭梦琦
(1. 河南中医药大学第一临床医学院 郑州 450000;2. 河南中医药大学第一附属医院检验科 郑州 450000)
外泌体中包含功能蛋白、mRNA、微小RNA(microRNA,miRNA)等多种具有生物活性的物质,且外泌体的膜结构上存在多种抗原和抗体分子,能产生多种生物学效应[1]。然而,细胞外囊泡(Extracellular vesicles,EVs)物种的异质性和非特异性、分离技术的多样性以及外泌体与其他囊泡在密度、大小、成分上的重合性,都使其难以确定分离到的囊泡是否为外泌体,这一问题的解决取决于外泌体标志物的筛选[2]。如经典的外泌体标志物有CD9、CD63、CD81 等,这些蛋白质主要定位于外泌体膜上[3]。除此之外,随着研究的不断深入,发现外泌体膜蛋白在外泌体生物合成、分泌及细胞与细胞间通讯等方面发挥重要作用,而摄取过程与外泌体膜蛋白与受体细胞相互作用有关[3,4]。现已有研究[2]表明,利用外泌体包装天然药物,提高天然药物在体内的生物利用度,并赋予天然药物的靶向性,而这些作用与外泌体膜蛋白密切相关。因此,需要对外泌体膜蛋白的种类及功能进行深入研究,提高外泌体在临床的应用价值。
1 外泌体简介
EVs是多种细胞主动向胞外分泌的脂质双层膜囊泡,根据其大小、生物学特征及形成过程,可分为外泌体、微泡和凋亡小体等[5]。外泌体是多泡小体(Multivesicular bodies, MVBs)与细胞膜融合后释放的管腔内囊泡(Intraluminal vesicles,ILVs),其直径为30-150 nm,在电镜下呈杯状结构[6]。外泌体起源于内体系统,细胞质膜向内凹陷形成初级内吞囊泡,多个初级内吞囊泡融合形成早期内体(Early endosomes,EEs),通过网格蛋白或小孔蛋白依赖或独立的途径包裹细胞内容物形成多个ILVs,进一步形成晚期内体(Late endosomes,LEs),也称 MVBs。然后,Rab27A 和Rab27B将MVBs引向细胞膜,在可溶性N-乙基马来酰亚胺敏感因子附着蛋白(SolubleN-ethylmaleimidesensitive factor attachment proteins,SNARE)的协助下促进MVBs与质膜融合,将ILVs释放到细胞外,即为外泌体[7]。
外泌体的内体起源也反映在其蛋白质组成中,包括凋亡连接相关基因2 相互作用蛋白X(Apoptosislinked gene 2-interacting protein X,Alix)、CD63 和肿瘤易感基因101 蛋白质(Tumour susceptibility gene 101,TSG101)。所有的外泌体均含有参与转运和融合的蛋白质(如Rab GTP 酶、Annexins 等)。其内容物中细胞骨架蛋白、黏附因子和四跨膜蛋白家族蛋白(如四跨膜蛋白CD63、CD81和CD82)也很丰富。
外泌体的内容物不仅表明了供体细胞的组成,而且反映了一种调节的分选机制。外泌体的膜表面及内部包括各种蛋白质(如受体、转录因子和细胞外基质蛋白等)、脂质和核酸,如mRNA、miRNA 和长链非编码RNA(Long non-coding RNA,lncRNA)。对外泌体蛋白质的组成分析发现,某些蛋白质起源于特定的细胞和组织,而某些蛋白质在外泌体中普遍存在。例如,B 淋巴细胞和树突状细胞(Dendritic cells,DCs)分泌的外泌体携带主要组织相容性复合物(Major histocompatibility complex,MHC)I 类和II 类蛋白,活化T 细胞的外泌体含有可诱导T 细胞凋亡的生物活性Fas 配体,一些肿瘤细胞分泌的外泌体携带与肿瘤发生和转移相关的黏附分子、金属蛋白酶和组织特异性蛋白[8]。而一系列融合和转运蛋白(如Rab2、Rab7、Flotillion和Annexin)、热休克蛋白(如HSP70和HSP90)、细胞骨架蛋白(包括肌动蛋白、肌球蛋白、微管蛋白)以及介导MVBs 形成的Alix 等蛋白质属于外泌体的非特异性蛋白质[7]。
外泌体可介导细胞间通讯,其将内含的多种物质,传递给受体细胞,引起受体细胞的表型和功能发生变化。如肿瘤细胞分泌的外泌体装载有多种内容物,将其转移至受体细胞,导致受体细胞的表型改变,从而促进肿瘤的进展[9]。近年来,外泌体作为纳米级囊泡装载药物用于疾病的靶向治疗也成为研究热点。有研究[10]表明,外泌体包裹姜黄素,可用于脑部疾病的治疗,并且能够提高姜黄素的生物利用度;姜黄素封装于外泌体递送,能够治疗炎性疾病,且无明显副作用。而外泌体递送功能的完成与膜蛋白有关。
2 外泌体膜蛋白分类
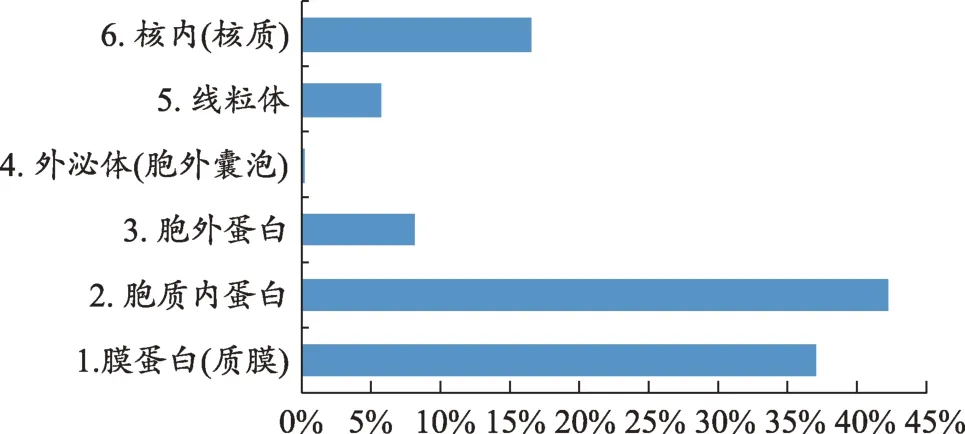
图1 外泌体蛋白质分类

图2 外泌体膜蛋白来源

图3 Gene ontology(Biological process)分类
前期外泌体蛋白质组学的研究为认识外泌体膜蛋白的种类奠定了基础,本文将蛋白质组学研究数据[11-15]进行汇总。将目前已知的外泌体蛋白质进行整理,根据Uniprot 数据库(https://www.uniprot.org/)的注释,本文对1858种存在于外泌体中的蛋白质进行分类(图1),外泌体中的蛋白质79.28%属于膜蛋白和胞质蛋白,且外泌体特有的蛋白质占总蛋白质的比例仅为0.22%。对622种外泌体膜蛋白进一步分析其来源(图2),可知外泌体膜蛋白多来源于细胞膜蛋白和细胞器膜蛋白(如内质网、高尔基体、线粒体等)。此外,对这些外泌体上的膜蛋白进行生物学过程(Biological process)进行分类(图3),得出外泌体膜蛋白常见的四种功能,其中参与转运功能的膜蛋白占42%、参与信号传导的膜蛋白占18%、参与抗原处理与呈递的膜蛋白占15%、参与胞吞与胞吐的膜蛋白占15%。由此可知外泌体膜蛋白最重要的功能是协助外泌体转运其内容物,其次是将信号传导至受体细胞,引起受体细胞的生理或病理的变化,其还参与免疫过程以及胞吞作用释放外泌体和受体细胞内化外泌体。
3 外泌体膜蛋白功能
3.1 转运功能
外泌体的转运功能是指外泌体可将其装载的蛋白质、脂质和核酸等生物活性分子转运至受体细胞。外泌体转运其内容物的功能已被证实,但参与协助完成该转运过程的外泌体膜蛋白尚不明确[16,17]。目前认为,外泌体转运功能与受体细胞摄取过程密切相关。
外泌体经典标志物CD9,位于外泌体膜上,参与细胞运动、粘附和融合[18]。因此推测CD9 可能介导受体细胞摄取外泌体,参与转运外泌体的内容物至受体细胞。此外,外泌体膜上的缝隙连接蛋白(Connexins,Cxs)可在外泌体膜和细胞膜之间形成六聚体半通道,将外泌体内的小分子物质(<1 kDa,例如第二信使、离子和代谢物等)递送到受体细胞[19,20]。
受体细胞在外泌体膜转运蛋白的作用下摄取外泌体,导致受体细胞中的蛋白质、脂质和核酸水平发生变化,进而使受体细胞的功能发生变化。例如,人原代角质形成细胞摄取来源于大疱性类天疱疮患者水疱液的外泌体后,外泌体诱导人原代角质形成细胞产生关键的炎性细胞因子和趋化因子,促进大疱性类天疱疮相关的皮肤局部自体炎症反应[21]。外泌体还可通过转运其内容物对病原体感染和抗感染的双向调节作用[22,23]。在免疫突触形成的过程中,CD63+外泌体将miRNA 从T 细胞单向转移至抗原呈递细胞(Antigen-presenting cells,APC),导致受体细胞中的基因表达发生变化[23]。尽管许多外泌体膜蛋白都可以在转运功能中发挥重要作用,但是具体的调节机制仍需进一步的探索。
3.2 信号传导
外泌体膜蛋白除在外泌体内容物转运至受体细胞,进行细胞间信息传递中发挥作用外,外泌体膜蛋白还可与受体细胞表面的受体蛋白相互作用,作为细胞外信号刺激物质,引起受体细胞一系列的变化,即信号传导功能。尽管已有文献[24-26]表明,外泌体参与细胞间信号传导,但是其对细胞信号传导途径的影响尚未完全阐明。
已有研究[27,28]发现外泌体膜蛋白可激活细胞内通路,影响受体细胞功能。例如,外泌体膜蛋白cAMP 1直接活化交换蛋白1(Exchange protein directly activated by cAMP 1,EPAC 1)通过磷酸二酯酶3B(phosphodies‐terase type-3B,PDE3B)与Rap 鸟嘌呤核苷酸交换因子3(Rap guanine nucleotide exchange factor 3,RAPGEF3)和磷酸肌醇-3 调节亚基6(Phosphoinositide-3-kinase regulatory subunit,PIK3R6)结合,将 PDE3B 组装在一个信号复合体中,在这个信号复合体激活PI3Kγ复合体,参与血管生成,EPAC 1 也可通过独立于Rho 介导的信号传导途径,在调节cAMP 诱导的内皮屏障功能的动态控制中起作用。外泌体膜蛋白黏蛋白-1(Mucin-1,MUC1)β亚基含有羧基末端结构域,其通过磷酸化和蛋白质-蛋白质相互作用参与细胞信号传导,可调节ERK(Extracelluar regulated protein kinases,ERK)、SRC 和NF-κB(Nuclear factor-kappa B,NF-κB)途径中的信号传导,且在活化的T 细胞中,其可直接或间接影响Ras/MAPK 途径(https://www.uniprot.org/uniprot/P15941)。
MVBs 形成期间的蛋白质组成是外泌体分选中的关键分子,外泌体从宿主细胞释放,外泌体上的信号配体与受体细胞上的受体相互作用,诱导下游信号级联,这一过程在癌症的发生发展中起关键作用。胰腺导管腺癌(Pancreatic ductal adenocarcinoma,PDAC)衍生的外泌体在Kuppffer 细胞中诱导转化生长因子-β(transforming growth factorβ,TGF-β)信号传导,导致肝星状细胞(Hepatic stellate cells,hStCs)的活化和细胞外基质重塑[29],但激活TGF-β信号的外泌体膜蛋白仍需进一步探究。
3.3 抗原的处理和呈递
外泌体通过抗原呈递作用参与到免疫调节,并且在不同的生理或病理条件下,会产生促进或抑制免疫应答的作用。外泌体膜中含有的共刺激分子,参与MHC Ⅰ类和Ⅱ类途径的抗原呈递,激活免疫系统[26]。例如,DCs分泌的外泌体膜表面含有MHC Ⅰ类和Ⅱ类分子,可以呈递肿瘤抗原[30];APC 分泌的外泌体膜上含有抗原呈递肽-MHC Ⅰ类复合物,与CD8+T细胞结合,激活T 细胞的增殖和分化,诱导机体产生免疫应答[23]。Burrello 等[31]研究发现肿瘤细胞和干细胞分泌的外泌体可携带免疫调节效应物(如转录因子、非编码RNA和细胞因子)抑制机体产生免疫应答。
此外,还有多种定位于外泌体膜上的蛋白质参与对抗原的处理和呈递。例如,组织相容性抗原Ⅰ类(HLA Ⅰ)、整合素αv和β5可通过MHC Ⅰ类参与抗原的处理呈递[32]。HLA Ⅱ类 DMα和β链可结合MHC Ⅱ类蛋白,并且可通过MHC Ⅱ类参与外源性抗原的处理和呈递。衔接子相关蛋白质复合物-2(adaptorrelated protein complex-2,AP-2)的多种亚基也可通过MHC Ⅱ类参与外源性抗原的处理与呈递。这些研究表明外泌体膜蛋白在抗原的处理和呈递中发挥重要作用。
外泌体除了参与抗原的处理和呈递外,还可充当维持人体稳态的调节剂。由于外泌体可以充当不同免疫细胞之间的信使这一事实,因此探究外泌体在免疫系统中的作用尤其重要。例如,来自间充质干细胞(Mesenchymal stem cell,MSC)的外泌体可激活 Toll 样受体的信号传导,增强白细胞介素-10(IL-10)表达,减弱炎症的程度[23]。转移性黑色素瘤可释放表面携带程序性死亡配体1(Programmed death ligand 1,PD-L1)的外泌体,含有上调表达PD-L1 的外泌体,可抑制CD8+T 细胞的功能,促进肿瘤生长[33]。总之,对外泌体膜蛋白的深入研究,有利于更好地了解外泌体在机体免疫系统中发挥的作用,以便更好地调控免疫系统。
3.4 胞吐和胞吞
囊泡的胞吐作用是调节许多生物事件的基本细胞过程,例如神经递质、激素和细胞因子的释放以及蛋白质和脂质向质膜的递送,用于细胞修复、生长、迁移和细胞信号传导的调节[34]。胞吞作用即指细胞膜接触大分子或颗粒状物质后,伸出伪足包围抗原形成小泡并吞入细胞内的转运过程,又称内化。外泌体作为囊泡的一种,其分泌和摄取与胞吐和胞吞过程紧密联系。
MVBs 与质膜的融合,是外泌体释放到胞外环境的必要环节。目前已知参与胞吐释放外泌体的38 种膜蛋白。Rab GTP 酶在外泌体产生中起重要作用,它们调节内体在细胞内运输(MVBs 起源)以及将囊泡运输到质膜并随后从细胞中释放[35-37]。此外,外泌体膜蛋白CD9 与胞吐作用产生外泌体密切相关,其能够促进外泌体的产生和释放[38-39]。
外泌体释放到细胞外环境后,随着血液循环,最终与配体结合,以内化等方式进入受体细胞。较小的外泌体可通过网格蛋白(Clathrin)介导的胞吞作用被受体细胞摄取,而较大的外泌体则采用其他的内化过程,如大胞饮和吞噬作用。在外泌体膜蛋白中,参与内吞作用的55种膜蛋白,其中参与网格蛋白介导的内吞作用的外泌体膜蛋白有9 种。AP-2 是一种网格蛋白介导胞吞作用的货物适配器,可帮助网格蛋白在质膜上积聚,AP-2 与结合RNA 的泛素 E3 连接酶(RNA-binding ubiquitin E3 ligase,MEX3C)相互作用引起网格蛋白介导的胞吞作用[40];网格蛋白轻链A(Clathrin light chain A,CLTA)和网格蛋白轻链B(Clathrin light chain B,CLTB)是包被内陷小窝和囊泡复合物的主要蛋白质组分,其可引起网格蛋白的积聚和包被小泡的形成,使外泌体被受体细胞摄取(https://www.uniprot.org/uniprot/P09496,https://www.uniprot.org/uniprot/P09497)。此外,作为吞噬标志物的CD47 蛋白和溶酶体相关膜蛋白-1(Lysosome-associated membrane glycoprotein 1,LAMP1)都定位于外泌体的膜蛋白,表明外泌体可通过吞噬作用被受体细胞摄取。
3.5 其他
外泌体膜蛋白除上述功能外,还参与细胞间黏附以及细胞间连接,例如桥粒芯蛋白1(Desmoglein-1,DSG 1)可参与细胞间连接的组装及通过质膜细胞黏附分子参与调节钙依赖的细胞间黏附作用[32,41]。CD9、CD47、CD166 和钙粘蛋白等可参与细胞间黏附,而这些蛋白质也定位于外泌体膜蛋白,推测其可能参与外泌体与受体细胞的黏附,使外泌体被受体细胞摄取。
此外,Kinsley 等[9]研究表明,源自骨髓或不同类型的癌细胞分泌的EVs 在动物模型中的特定器官中积聚。例如,骨髓细胞产生的EVs 在肾脏中积聚,促进损伤修复。然而,源自癌症的EVs 促进多种器官的转移,如来自黑色素瘤细胞分泌的EVs 优先在骨、肝、脾和肺中积聚,来自乳腺癌细胞分泌的EVs 优先在肝和肺中积聚,而来自胰腺癌细胞分泌的EVs 优先积聚在肝脏。外泌体作为EVs 中的一种,可推测其也可根据来源不同而靶向不同的组织。这种特异性识别大部分是由于外泌体膜上具有不同的蛋白质。同时,Lyden等研究表明[9,42],表达整合素α6β4的外泌体优先分布到肺部,表达整合素αvβ5的外泌体则优先分布到肝脏,敲除整合素α6β4和αvβ5的肿瘤细胞分泌的外泌体无法靶向到特定组织。因此,外泌体膜蛋白整合素具有靶向外泌体到特定受体细胞和组织的功能。有研究[43]报道,经过基因工程的改造,将吞噬过程中的关键蛋白CD47 表达至正常成纤维细胞样的间充质细胞,使其分泌的外泌体表达和携带的CD47 蛋白增多,能有效增强外泌体的靶向性。
总之,外泌体膜蛋白可介导外泌体与细胞的黏附及靶向功能,从而调节外泌体被受体细胞摄取的过程,引起受体细胞发生生理或病理的变化。
4 小结与展望
受体细胞识别、结合并摄取外泌体,从而将外泌体的内容物转运至受体细胞内发挥功能,这一过程与外泌体膜蛋白和受体细胞膜蛋白相互作用密切相关,但如何调控外泌体发挥生物学作用尚不十分清楚。外泌体膜上存在的四跨膜蛋白(如CD9、CD63 等)、整合素、黏蛋白等,使外泌体可以被受体细胞摄取;同时,外泌体膜上也存在多种MHC Ⅰ类和Ⅱ类组织相容性抗原,参与对抗原的处理和呈递。此外,外泌体膜上还存在许多功能尚不完全确定的膜蛋白,仍需深入研究。
虽然根据数据库的筛查结果,外泌体膜蛋白可以来源于高尔基体、内质网和线粒体等细胞器,但是也有文献报道外泌体膜蛋白通常不来源于内质网和线粒体等细胞器,这可能是由于现有的外泌体分离技术难以得到纯度较高的外泌体。因此,严格意义上,现有技术分离到的囊泡只能称为小细胞外囊泡。为获得纯度较高的外泌体,需尽可能多地发现外泌体特异性标志物,并不断改进现有的分离技术。
外泌体装载药物用于靶向治疗是当前的研究热点。天然药物分子量较大,渗透性较差,在人体内的生物利用度较低。例如,姜黄素在治疗癌症、阿尔茨海默病以及炎症方面都有良好的效果,但是由于其快速的新陈代谢和消除作用,无论给药途径如何,其在血清和组织中的含量均较低,且在水中的低溶解度会降低其在靶细胞内的有效作用[44]。目前的研究[45]证实,将药物封装于外泌体,外泌体可保护其内容物不被其他物质降解而提高其利用度。研究人员发现姜黄素封装于外泌体内,可提高其在血液中的浓度,使其具有更高的溶解度和稳定性。此外姜黄素刺激细胞产生的外泌体具有恢复连接蛋白和内皮细胞通透性的潜力[44]。
尽管人们对于外泌体膜蛋白的成分、种类及其在外泌体功能中的作用有了一定的了解,但是其在生理和病理条件下的复杂作用尚不完全清楚,需继续探索,因此,进一步了解外泌体膜蛋白的精确生理功能对于确定其在机体生理和病理条件下的调节作用具有重大意义。
——外泌体与老年慢性疾病相关性的研究进展

