熊蜂SMRTER蛋白多克隆抗体的制备
徐伟林 孙成
(中国农业科学院蜜蜂研究所,北京 100093)
熊蜂是重要的传粉昆虫,在促进农业生产及维护生态系统平衡等发面发挥重要作用[1,2]。熊蜂的地理分布范围非常广泛,从格林兰岛到亚马逊平原;它们的栖息地种类多样,从高山草甸到热带雨林[3]。到目前为止,人们不清楚是什么分子机制导致了熊蜂具有如此广泛的分布能力。对于这一问题的了解有助于更好地利用熊蜂进行授粉服务,也有利于采取恰当的措施对熊蜂进行保护。串联重复序列(tandem repeat)是基因组中高度变异的遗传元件。我们通过对两种基因组已经测序的熊蜂进行比较发现,串联重复序列的变异很可能为熊蜂的环境适应提供了良好的遗传变异素材[4]。我们的研究也鉴定出101个编码区含有串联重复序列的熊蜂基因,基因中串联重复序列的变异引起它们所编码蛋白质序列长度的变化。Smr基因就是这些基因之一。
Smr基因编码一个异常大的、由3604个氨基酸组成的SMRTER(SMRT-related and ecdysone receptor interacting factor)蛋白,是一种在真核细胞中表达并且在进化上高度保守的转录因子[5]。SMRTER[6]不仅对ecdysone通路有抑制作用,而且对卵泡细胞和翅膀的Notch通路也有抑制作用。Smr基因的突变会导致果蝇存在以下缺陷:翅膀和腿变形、产卵形态缺陷、生殖力下降[5]。
本研究旨在利用基因合成技术获得熊蜂Smr基因的编码区,并把其克隆进大肠杆菌表达载体。在IPTG的诱导下表达SMRTER重组蛋白,并对表达出的可溶性蛋白进行纯化。制备兔抗SMRTER多克隆抗体,并检验所制备的多克隆抗体的特异性。该研究为进一步研究Smr基因在熊蜂中的生物学功能奠定基础,也有利于研究该基因中串联重复序列所导致的蛋白质长度变化是否会影响该蛋白的生物学功能。
1 材料与方法
1.1 主要实验试剂
Ezfusion同源重组酶购自上海捷瑞生物工程有限公司,DNA回收试剂盒购自天根生化科技有限公司,质粒提取试剂盒品牌为Axygen,感受态细胞类型为TOP10,亲和层析柱料购自武汉汇研生物科技有限公司,酶标二抗品牌为Jackson,TMB购自北京索莱宝科技有限公司。
1.2 基因合成
通过基因合成的方式合成Smr基因的编码区,由多条引物序列合成,扩增引物序列信息见表1(由武汉金开瑞生物科技有限公司合成)。
1.3 基因扩增
PCR扩增反应体系为正反引物各1µl(10pmol),模板1µl(20~50ng),5µl 10* pfu buffer,pfu DNA聚合酶1µl(5U),补去离子水至50µl,PCR扩增反应条件见表2。
2 载体与目的基因的连接与转化
取Pet-b2m载体(该载体为武汉金开瑞生物科技有限公司改造)50ng,目的基因150ng,Ezfusion同源重组酶2µl,T4 DNA Ligase 1µl,补去离子水至20µl,在16℃条件下孵育1h进行连接。
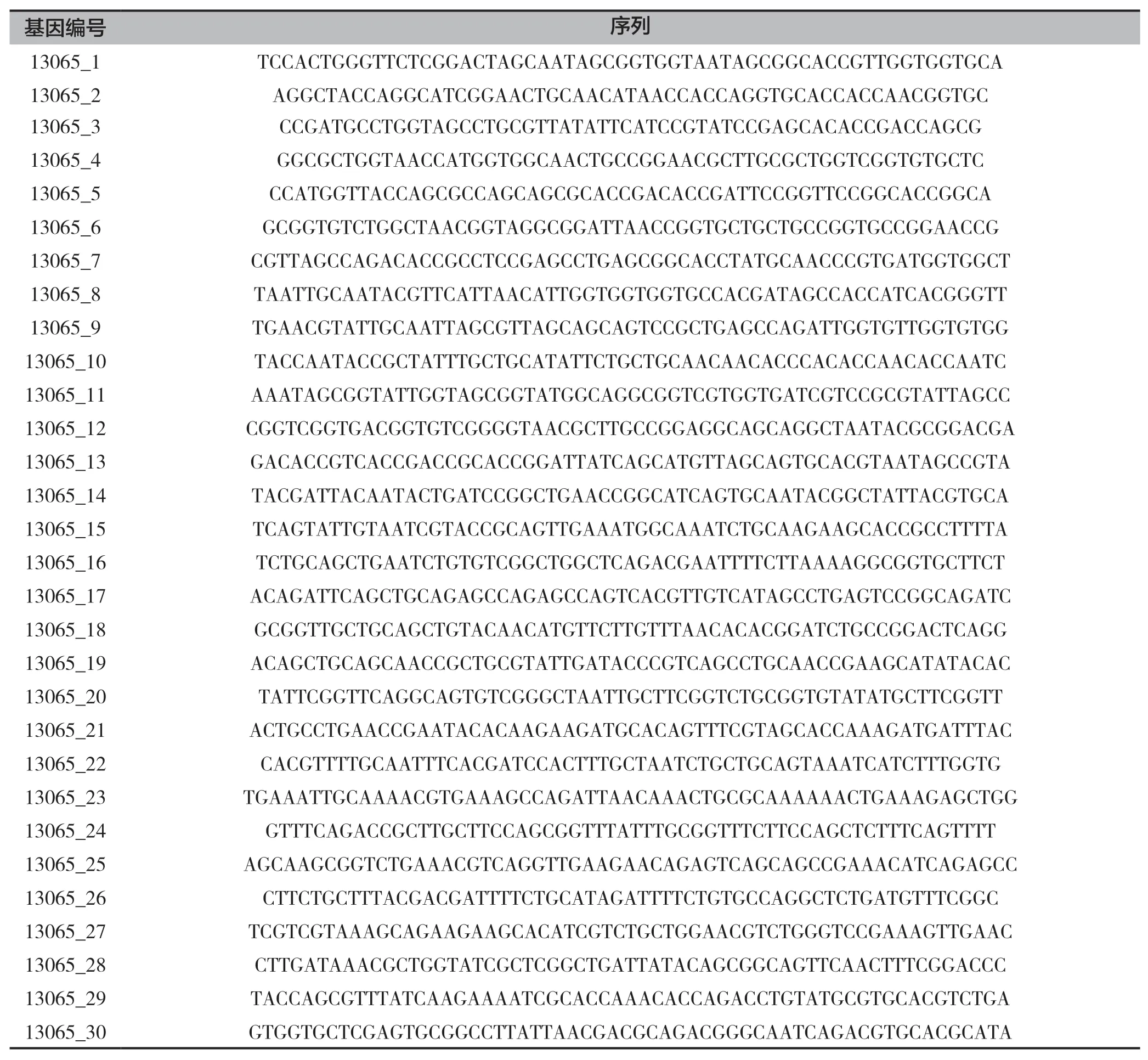
表1 引物序列信息
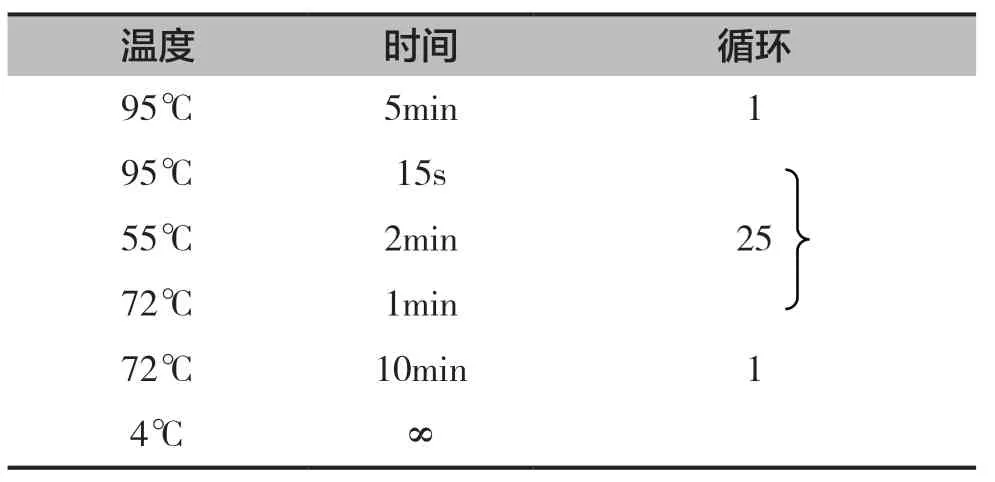
表2 基因扩增PCR反应条件
将载体与目的基因连接的产物加入到装有TOP10感受态细胞的管中(50µl感受态细胞需要25ng DNA),轻轻旋转几次混匀内容物,冰浴30min;将离心管混合物放入加温至42℃的循环水中,热激90s;快速将管转移到冰浴中,使细胞冷却1~2min;每管加入200µl SOC液体培养基,用水浴将培养基加温至37℃,然后将管转移到设置为37℃的摇床上,220rpm培养45min,使细胞复苏并表达质粒编码的抗性标记基因;将适当体积(每个90mm平板达200µl)已转化的感受态细胞转移到含有相应抗生素的LB培养基上;倒置平板,于37℃培养,12~16h后可出现菌斑。
2.1 菌落PCR验证
待平板上长出菌落,随机挑取若干个,进行菌落PCR验证,检测转化。
2.2 测序验证
阳性克隆由武汉金开瑞生物工程有限公司测序平台测序验证。
3 SMRTER蛋白的诱导表达及纯化
3.1 阳性克隆小量表达与鉴定
挑选含重组质粒的单菌落至3ml LB液体培养基(卡那抗性)中,37℃培养过夜后-20℃保种;分别挑选含重组质粒的单菌落至3ml LB液体培养基(卡那抗性)中,37℃震荡培养至OD600约0.6;取部分菌液作为对照组,余下菌液加入IPTG诱导剂(终浓度1mM),37℃震荡培养3h;分别取两组菌液0.15ml,12000×g离心2min,菌体沉淀以40µl 1×loading buffer重悬裂解,SDS-PAGE检测。
3.2 蛋白大量表达及破菌检测
取保存于-20℃的菌种100µl接种于100ml LB液体培养基(卡那抗性)中震荡培养过夜;取100ml菌液接种于2000ml LB液体培养基中,37℃扩大培养至OD600约0.6,降低培养温度到30℃;加入IPTG诱导剂至终浓度0.5mM,30℃继续震荡培养8h;8000rpm离心3min收集菌体,重悬于50ml预冷NTA-0缓冲液中,冰浴30min;超声破碎菌体,参数设置为功率200W、工作3s、暂停4s、时间25~30min;16000rpm 4℃离心50min,收集上清以及沉淀;取少量上清及沉淀进行SDS-PAGE检测,剩余上清及沉淀置于4℃备用。
3.3 包涵体蛋白纯化
沉淀以50ml NTA-0缓冲液重悬,加入DTT至终浓度1mM;超声促进杂蛋白溶解,参数设置为功率200W、工作3s、暂停3s、时间10min;10000rpm 4℃离心10min,去上清;重复以上三步至上清透明;沉淀以PBS重悬,超声,参数设置为功率200W、工作3s、暂停3s、时间5min;16000rpm 4℃离心10min,去上清;以3ml 6M盐酸胍重悬包涵体,加DTT至终浓度5mM;220rpm 37℃震荡3h至包涵体全部溶解;10000rpm 4℃离心10min,取上清。取蛋白溶液进行SDS-PAGE检测。
3.4 包涵体蛋白复性
以2倍体积的3M盐酸胍稀释蛋白溶液,在4℃环境下以注射器逐滴加入到200ml复性液(pH 8.0)中,转速调节至最大,搅拌24h;降低转速,搅拌24h;取蛋白溶液于透析袋中,以PEG20000浓缩体积至50~100ml;4℃ TE缓冲液透析过夜;取蛋白溶液,以PEG20000浓缩体积至2~4ml;4℃ TE缓冲液透析过夜。
3.5 复性蛋白纯化
上清蛋白溶液用0.22µm过滤器过滤备用;准备Ni-NTA柱;以1ml/min的流速上样上清蛋白溶液;以NTA-0缓冲液(pH 8.0)洗柱至流出液不含蛋白(G250检测液不变色);分别以20mM、60mM、200mM和500mM咪唑洗脱,分段收集洗脱液至G250检测液不变色;以3倍柱体积去离子水洗涤柱料,以20%乙醇封柱;对收集的洗脱液进行SDS-PAGE电泳检测。
4 SMRTER多克隆抗体的制备与纯化
将纯化的SMRTER蛋白混入弗氏佐剂免疫健康状态良好的实验兔,免疫程序:一免,抗原+完全弗佐+PBS,皮下注射,400ug(抗原)/只,反应时间2周;二免,抗原+完全弗佐+PBS,皮下注射,400ug(抗原)/只,反应时间2周;三免,抗原+完全弗佐+PBS,皮下注射,400ug(抗原)/只,反应时间2周(效价检测,见ELISA效价检测操作记录);四免,抗原+不完全弗佐+PBS,皮下,400ug(抗原)/只,反应时间1周(效价检测,见ELISA效价检测操作记录)。共免疫2只日本大耳白兔子:兔子编号分别为G872、G873;G872、G873兔子免疫原都为SMRTER重组蛋白,免疫次数共4次。
纯化:层析柱预处理,10倍柱床体积的去离子水冲洗3~5遍,流速1ml/min,10倍柱体积的0.02M PB+0.3M NaCl 冲洗3~5遍,流速1ml/min;样品上样,10ml抗血清/腹水,用0.02M PB稀释后,0.22um滤器过滤后上柱,调整流速为5~7s/滴;洗杂,0.02M PB冲洗至检测(G250不变蓝)无蛋白流出为止,流速2s/滴;抗体洗脱,0.1M PH=3.0甘氨酸以3~5s/滴过柱洗脱,收集洗脱物并用G250检测洗脱产物至不变蓝为止;PH值调节,饱和碳酸钠调节洗脱产物PH至中性;超滤浓缩,10kDa超滤管,超滤浓缩至1~3ml左右;透析,5L,0.01M PH=7.4 PBS透析过夜,第二天换液1次后再透析4~6h左右后跑SDS胶并测定抗体浓度后装入标记好EP管,可暂存于4℃备用或直接保存于-20℃;层析柱洗涤与贮存,去离子水冲洗层析柱,5倍柱床体积20%乙醇冲洗层析柱后,4℃封存。
5 多克隆抗体特异性检测
间接ELISA法,通过对抗体的梯度稀释,直观反映了抗体的效价和灵敏度。抗原包被:用包被液稀释抗原到2µg/ml,100µl/孔加入96孔酶标反应板中,4℃过夜包被;洗涤:次日弃掉孔内的液体,洗涤液洗3次;封闭:加200µl/孔封闭液,37℃温育2h;洗涤:用洗涤液洗 3 次;加待测样品(一抗):加入抗血清(取血4℃ 4000rmp 离心10min取上清),用稀释液将血清按1:2000、1:4000、1:8000、1:16000、1:32000、1:64000、1:128000......进行倍比稀释(空白血清同比稀释做阴性对照),每孔100µl,37℃孵育1h;洗涤:用洗涤液洗3次;加酶标抗抗体:加入HRP标记IgG二抗,100µl/孔,37℃孵育40min(羊抗小鼠-HRP 1:10000~1:5000,羊抗兔-HRP 1:10000~1:5000)。洗涤:用洗涤液洗5次后拍干;显色:加新鲜配制的底物溶液100µl/孔,37℃遮光放置5~20min;终止反应、比色:加50µl/孔终止液,颜色变黄;用酶标仪测定450nm处各孔的吸光值。
6 结果
6.1 表达载体的构建
将Smr基因的编码序列插入表达载体、转化细菌后,挑选具有抗生素抗性的阳性菌株进行质粒提取,并对质粒上目的基因插入区域进行了测序。测序结果表明:目的基因已经正确地插入到表达载体之中。测序结果如下:
agcaatagcggtggtaatagcggcaccgttggtggtgcacctggtggttatg ttgcagttccgatgcctggtagcctgcgttatattcatccgtatccgagcacaccgac cagcgcaagcgttccggcagttgccaccatggttaccagcgccagcagcgcacc gacaccgattccggttccggcaccggcagcagcaccggttaatccgcctaccgtta gccagacaccgcctccgagcctgagcggcacctatgcaacccgtgatggtggcta tcgtggcaccaccaccaatgttaatgaacgtattgcaattagcgttagcagcagtcc gctgagccagattggtgttggtgtgggtgttgttgcagcagaatatgcagcaaatagc ggtattggtagcggtatggcaggcggtcgtggtgatcgtccgcgtattagcctgctgc ctccggcaagcgttaccccgacaccgtcaccgaccgcaccggattatcagcatgtt agcagtgcacgtaatagccgtattgcactgatgccggttcagccggatcagtattgta atcgtaccgcagttgaaatggcaaatctgcaagaagcaccgccttttaagaaaattc gtctgagccagccgacacagattcagctgcagagccagagccagtcacgttgtca tagcctgagtccggcagatccgtgtgttaaacaagaacatgttgtacagctgcagca accgctgcgtattgatacccgtcagcctgcaaccgaagcatatacaccgcagacc gaagcaattagcccgacactgcctgaaccgaatacacaagaagatgcacagtttc gtagcaccaaagatgatttactgcagcagattagcaaagtggatcgtgaaattgcaa aacgtgaaagccagattaacaaactgcgcaaaaaactgaaagagctggaagaaa ccgcaaataaaccgctggaagcaagcggtctgaaacgtcaggttgaagaacagag tcagcagccgaaacatcagagcctggcacagaaaatctatgcagaaaatcgtcgta aagcagaagaagcacatcgtctgctggaacgtctgggtccgaaagttgaactgccg ctgtataatcagccgagcgataccagcgtttatcaagaaaatcgcaccaaacacca gacctgtatgcgtgcacgtctgattgcccgtctgcgtcgttaa
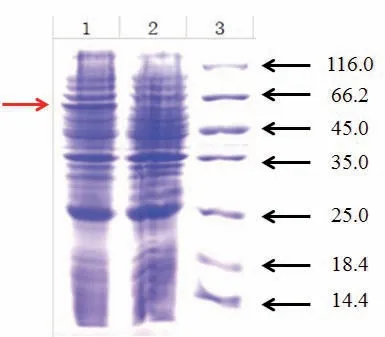
图1 目的基因小量表达后的SDS-PAGE电泳检测
6.2 Smr基因的小量表达
我们使用IPTG进行诱导,对Smr基因进行小量表达实验,以查看目的基因是否能够成功表达。结果显示:与没有加IPTG诱导剂的全细菌蛋白相比,加诱导剂的全菌蛋白经SDS-PAGE检测后,在目的大小(62kDa)处出现明显的目的蛋白条带(图1)。因此,我们所构建的表达载体能够使Smr基因成功表达。
6.3 Smr基因的大量表达
对大肠杆菌进行大量培养并加入IPTG诱导剂诱导表达。超声破碎菌体并离心后,分别取少量上清及沉淀进行SDS-PAGE检测。结果显示,该基因大量表达后,产生的目的蛋白(即SMRTER)主要以包涵体的形式存在(图2)。
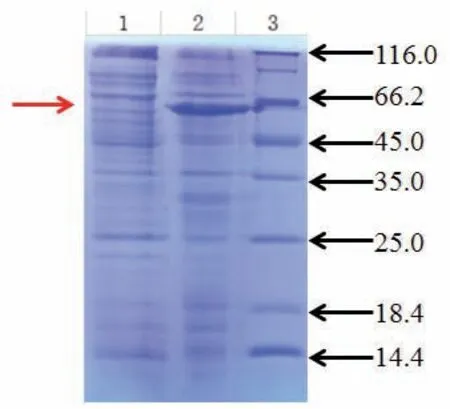
图2 目的基因大量表达后的SDS-PAGE电泳图
6.4 SMRTER包涵体蛋白的复性与纯化
我们对包涵体蛋白进行了复性,并使用Ni-NTA柱对复性的蛋白进行了纯化。取少量纯化后的蛋白洗脱液进行SDS-PAGE电泳检测,结果显示:通过对包涵体进行复性、纯化,我们得到了高质量的目的蛋白(图3)。
6.5 SMRTER蛋白多克隆抗体的制备及特异性检测
通过4次免疫家兔,我们获得了SMRTER蛋白的多克隆抗体;我们对抗体进行了收集与纯化,并使用如下两种方法对获得的多克隆抗体进行检测:
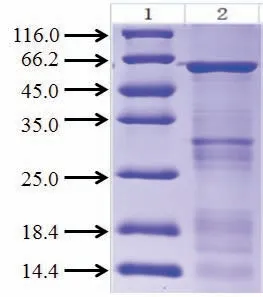
图3 目的蛋白复性纯化后的SDS-PAGE电泳检测
检测方法1:间接ELISA法。通过对抗体进行梯度稀释,直观反映了抗体的效价和灵敏度。当稀释比例为9.8ng/ml,酶标仪测定450nm处的吸光值检测为0.1915,结果符合预期(图4)。
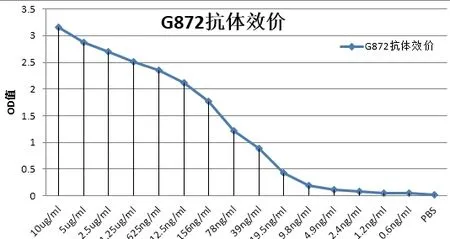
图4 SMRTER蛋白的多克隆抗体的效价检测结果
检测方法2:Western blotting(WB)杂交印记法。重组抗原的WB检测中,在约62kDa处有特异性识别,条带相对单一,这表明我们得到了特异性的抗体(图5)。
7 讨论
本研究利用基因合成技术获得熊蜂Smr基因的编码序列,并将其克隆进细菌表达载体;在0.5mmol/l IPTG诱导下表达了SMRTER重组蛋白,并对表达出的蛋白进行了纯化;成功制备了兔抗SMRTER多克隆抗体,并且制备的SMRTER多克隆抗体具有很好的效价和特异性。
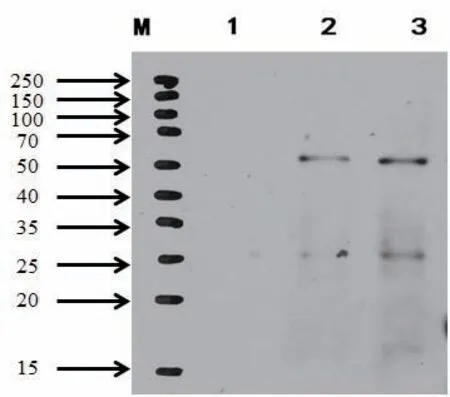
图5 SMRTER蛋白的多克隆抗体的WB杂交检测结果
本研究所制备的SMRTER多克隆抗体为研究Smr基因在熊蜂中的生物学功能奠定了基础。另外,由于该基因中串联重复序列的变异导致熊蜂种间该基因所编码蛋白质序列的长度发生变异,因而本研究所制备的抗体也有利于研究串联重复序列所产生的突变对蛋白质功能的影响。

