辣椒种子拮抗青枯病菌内生细菌的分离、鉴定
牟玉梅 范高领 邢丹


摘 要: 为了探究抗青枯病辣椒品种种子中拮抗青枯病菌内生细菌的种群组成及其在青枯病防治中可能发挥的生态学功能,从抗青枯病辣椒品种种子中分离、筛选出拮抗青枯病菌的内生细菌,对其进行抑菌广谱性分析,测定其对青枯病的生防效果。结果表明,从抗青枯病辣椒品种种子中分离出14株内生细菌,通过平板对峙,筛选出6株拮抗青枯病菌的内生细菌,初步鉴定它们分别为假单胞菌(Pseudomonas)、苍白杆菌(Ochrobactrum)和微杆菌(Microbacterium)。对6株内生细菌进行抑菌广谱性研究,所有内生细菌均至少对1种病原真菌有拮抗作用;将6株内生细菌的菌悬液分别对辣椒种子进行浸种处理后育苗,辣椒苗抗青枯病能力显著提升。辣椒种子中拮抗青枯病菌的内生细菌具有多样性,用其菌悬液处理辣椒种子后,植株对青枯病具有较好的抗病能力,为开展辣椒青枯病微生物防治提供了理论依据及菌种资源。
关键词: 辣椒; 种子; 内生细菌; 拮抗作用; 生物防治
中图分类号:S641.3 文献标志码:A 文章编号:1673-2871(2020)02-042-06
Isolation and identification of endophytic bacteria against bacterial wilt in pepper seeds
MOU Yumei, FAN Gaoling, XING Dan
(Pepper Research Institute, Guizhou Academy of Agricultural Sciences, Guizhou 550006, Guiyang, China)
Abstract: This experiment is to investigate the population composition of antagonistic endophytic bacteria and its potential ecological function in the prevention and treatment of green dead pepper varieties. To isolate and screen the endophytic bacteria that antagonize the green dead bacteria from the seeds of pepper varieties with anti-green dead disease, and to analyze their antimicrobial spectrum, to determine their effect on the prevention of green dead disease. Fourteen strains of endophytic bacteria were isolated from the seeds of capsicum varieties resistant to bacterial wilt. Six strains of endophytic bacteria were screened out through plate confrontation. They were identified as Pseudomonas, Pallidobacterium and Microbacterium. Six strains of endophytic bacteria were studied for broad-spectrum bacteriostasis. All endophytic bacteria had antagonistic effect on at least one kind of pathogenic fungi. Six strains of endophytic bacteria were soaked in pepper seeds and then cultured. The ability of pepper seedlings to resist bacterial wilt was significantly improved. The endophytic bacteria that antagonize green pepper bacteria in pepper seeds are diverse. After treating pepper seeds with their suspension, the plants have a good effect on green dead disease, and provide theoretical basis and bacterial resources for the prevention and treatment of pepper green dead disease.
Key words: Pepper; Seeds; Endophytic bacteria; Antagonistic effect; Biological control.
辣椒是我國种植面积最大的蔬菜作物[1]。辣椒青枯病是我国各辣椒主产区普遍发生的一种毁灭性土传病害,防治难度较大[2]。采用常规方法选育抗病品种,存在选育周期长、抗性单一的缺点;采用分子育种技术,其过程非常复杂,且在辣椒育种中成功应用的还不多[3];采用化学药剂又涉及到食品安全性和环境安全性安全评价问题。内生菌生物防治可以较好地解决上述问题[4],不仅可以促进作物生长、增产增收,还可以提高植物抗病性、改善品质以及改良土壤。国内外科研人员针对辣椒青枯病生物防治做了不少研究,筛选了很多新的防控辣椒青枯病的生防菌,但还没有发现一个成功应用于大批量生产和推广且能较好防治辣椒青枯病的生防菌。
內生菌是一类生活在植物体内且对植物无明显不利影响的微生物的总称[5]。植物携带丰富的内生菌资源,这些微生物对植物的生长发育、代谢过程和抗逆抗病等性状产生重要影响。种子作为植物物种延续的重要繁殖器官,是植物内生菌垂直传播的重要方式。种子内生菌与植物经过长期、稳定的进化选择,相比于从其他植物器官中分离的内生菌更易长期定殖生存,也更易演化出与宿主互惠互利的代谢途径[6]。种子中的内生菌防效具有较为稳定、持久的优点,可作为拮抗菌剂的菌种资源,具有很好的应用前景。
因此,笔者以抗青枯病辣椒品种的种子为材料,从中分离筛选出对辣椒青枯病菌有较强拮抗作用的内生菌株,并鉴定其分类地位,开展抑菌广谱性研究,以期丰富现有的生防菌种资源,为辣椒种子内生细菌及其生物防治的研究提供一定的理论基础。
1 材料与方法
1.1 材料
优质地方辣椒种质资源18份(由贵州省辣椒研究所在多年连作重茬的辣椒地自然诱发筛选出的具有较好综合抗病性的辣椒种质)。青枯病菌为贵州省农业科学院辣椒研究所保存的茄科雷尔氏菌株EP1(登录号:CP015116.1)。培养基为NA固体培养基、NA液体培养基、固体LB培养基。
1.2 方法
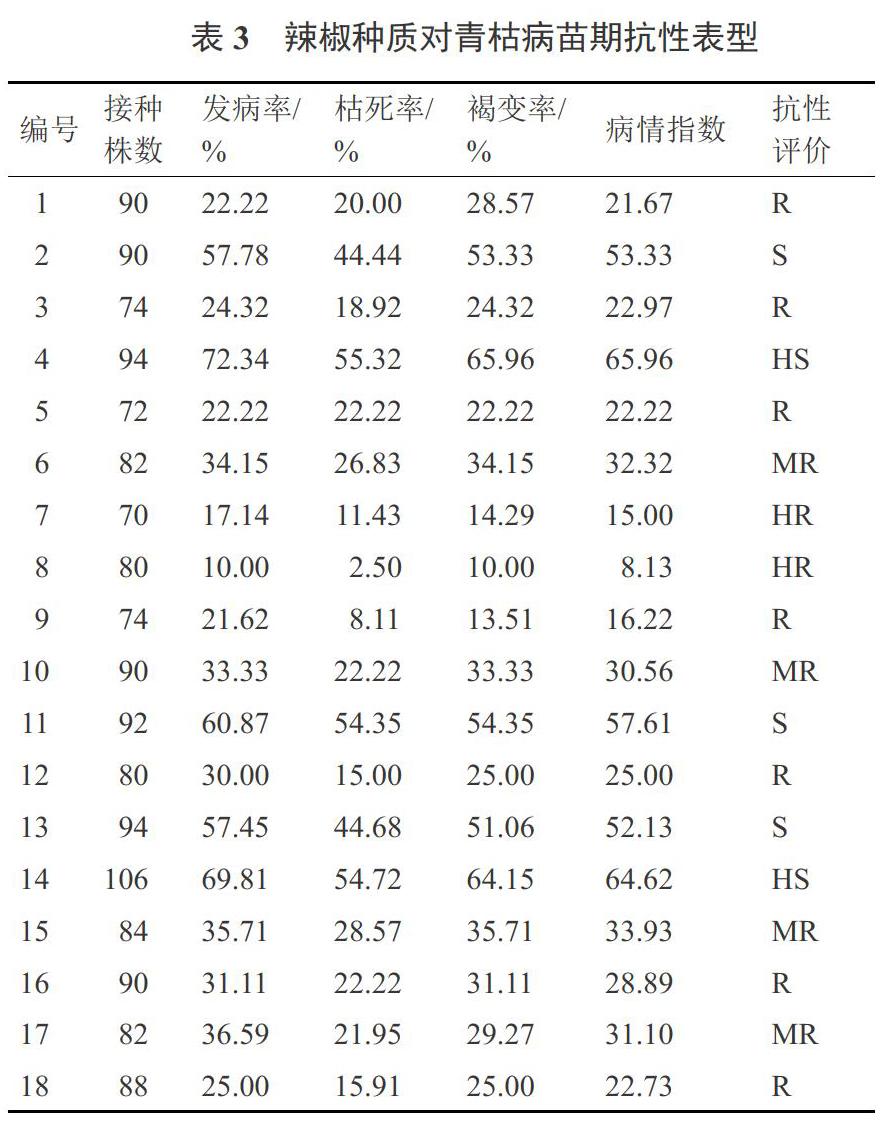
1.2.1 辣椒抗青枯病品种筛选鉴定 对18份地方优质辣椒种质资源进行苗期青枯病抗性表型鉴定,进一步确认材料抗性水平(2016年10月,在贵州省辣椒研究所贵阳试验基地进行)。将供试材料采用160穴漂浮育苗盘进行育苗,每个品种育苗160株,待幼苗长至5~6片真叶时,选择健壮的植株移栽至10 cm×10 cm的塑料杯内(数量在70~106株之间),完全随机排列,置于(26±2) ℃人工气候室继续生长,正常肥水管理,待长到7~8片叶期采用伤根灌根接种法接种青枯病菌,进一步筛选高抗辣椒青枯病品种。
青枯病病情调查方法:接种后每天调査和记录辣椒植株的发病情况,待病情稳定后按病情分级标准统计发病情况,计算发病率和病情指数,参试各种质对青枯病的抗性表型最终评价以第30天的发病率和病情为准。青枯病病情分级标准参照刘富中[7]、党峰峰[8]等对青枯病的分级标准(表1~2)。发病率/%=发病株数/接种株数×l00,病情指数(DI)/%=∑[(病级×该病级株数)/(最髙病级×接种株数)]×l00。
1.2.2 辣椒种子内生细菌的分离、纯化、保存 种子消毒:将辣椒种子在70%酒精中浸泡5 min,0.1%升汞消毒40 s,然后转入到体积分数2.5%的次氯酸钠溶液中浸泡5 min,最后用无菌水冲洗3次,将最后一次冲洗用的无菌水涂布分离培养基营养琼脂平板,置于30 ℃培养3 d,验证表面消毒情况。
内生细菌分离、纯化、保存:将彻底消毒后的种子置于无菌研钵中,加入质量分数0.85%的NaCl溶液充分研磨后,吸取1 mL上清液进行梯度稀释、营养琼脂平板涂布,30 ℃培养箱内培养2 d,挑取不同形态、颜色、大小的菌落划线纯化3次,直到平板上菌落的颜色、大小和形态完全一致,然后将纯化后的菌株保存在含有20%甘油的菌种保藏管中,-80 ℃冻存。
1.2.3 内生细菌对青枯病菌的抑制作用测定 采用纸蝶法测定内生细菌对青枯病菌的抑制作用,筛选对青枯病菌具有拮抗作用的内生细菌。吸取1 mL浓度为5×l08 cfu·mL-1的青枯病菌悬浮液放入灭菌培养皿中,将45 ℃ NA培养基倒入培养皿中与菌液摇匀,待冷却后对称放置2张5 mm灭菌滤纸片,距离培养皿中心距离约为25 mm,每张滤纸片上滴入内生细菌5 μL,每处理重复3皿,以无菌水为对照,置于28~30 ℃恒温箱中培养48 h,观察抑菌效果。拮抗作用强弱以“+”表示。“+++”表示拮抗活性很强,抑菌带宽度大于8.0 mm;“++”表示拮抗活性中等强度,抑菌带宽度在3.0~8.0 mm之间;“+”表示拮抗活性弱或无活性,抑菌带宽度小于3.0 mm,或者无抑菌带,病菌正常生长,且可覆盖内生细菌。
1.2.4 拮抗青枯病菌内生细菌的鉴定 对青枯病菌具有拮抗作用的内生细菌进行形态学和分子生物学鉴定。
形态学鉴定:在固体LB培养基上划线接种待鉴定菌株,28 ℃恒温培养24 h,记录菌落的颜色、形状、透明度以及表面边缘隆起程度等性状,对细菌进行革兰氏染色和形态观察,对种属进行初步鉴定。
分子生物学鉴定:对菌株16S rDNA 序列进行测定。使用细菌基因提取试剂盒进行基因组DNA提取。以提取的待鉴定菌株DNA为模板,以细菌的16S引物序列27f /1492R进行内生细菌的16S rDNA扩增。PCR以30 μL的体系进行,体系如下:H2O 17.8 μL,Buffer 3 μL,dNTP 2 μL,Primer1 3 μL,Primer2 3 μL,DNA模板1 μL,酶0.2 μL。PCR反应条件为:95 ℃预变性3 min,循环1次;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,循环35次;最后72 ℃延伸10 min。用1%的琼脂糖凝胶电泳检测PCR扩增结果,利用凝胶成像系统观察PCR扩增结果。将辣椒种子内生细菌PCR扩增结果送往北京六合华大基因科技有限公司武汉分公司进行分子鉴定,将菌株的测序结果与GenBank数据库中的序列进行比对。
1.2.5 拮抗青枯病菌内生细菌的抑菌广谱性研究 对已筛选出的拮抗内生细菌采用平板对峙生长法,测定其对辣椒炭疽病、疫病、立枯病病菌的拮抗作用。
将内生菌株划线活化培养后,挑取单菌落接种于20 mL LB培养液中,置于30 ℃摇床中200 r·min-1振荡培养过夜;辣椒立枯、炭疽、疫病病原菌接种到PDA培养基平板上,于28 ℃恒温条件下培养,待菌丝长满整个培养皿后,制成5 mm的菌饼备用。
在直径9 cm的PDA平板中央接入直径5 mm的病原菌菌饼,视病原真菌生长速度选择合适时期接种分离到的细菌(炭疽和立枯丝核菌与细菌同时接种,疫霉待菌丝扩增1 cm后再接种待测细菌)。在距中央25 mm处对称放置2张5 mm灭菌滤纸片,每张滤纸片上滴入活化培养的分离菌株菌液5 μL,28 ℃左右继续黑暗培养,设不接种分离菌株的处理为对照,每个菌株重复处理3皿,待对照皿中真菌菌丝即将长满皿时测量抑菌圈大小,计算抑菌率。抑菌率/%=(1-处理菌落直径)/对照菌落直径×100[9]。
1.2.6 內生细菌对辣椒青枯病生物防治效果的测定 将辣椒种子置于浓度为109 cfu·mL-1内生细菌菌悬液中浸泡4 h,无菌水冲洗3次后进行漂浮育苗,待幼苗长至5~6片真叶,从育苗盘中选取健壮植株,拔出洗净根部,分别浸泡在对应的菌株菌悬液中20 min,以LB培养液替代菌悬液浸泡作为对照,每处理6~8株,3次重复。采用伤根灌根接种法接种青枯病菌,观察记录发病情况,计算相对防效。相对防效(BE)/%=[(CK的病情指数-试验处理的病情指数)/CK病情指数]×100。
1.3 数据分析
利用软件DPS 7.05进行方差分析,利用Excel 2007进行常规数据及表格处理。
2 结果与分析
2.1 抗青枯病辣椒种子样品的筛选
通过苗期青枯病抗性鉴定,从抗性表现良好的18份辣椒种质资源中,筛选出对青枯病抗性最好、最稳定的辣椒种质资源2份(试验序号为7号、8号),将其种子作为本次试验的样品材料(表3)。
2.2 辣椒种子内生细菌的分离纯化
将上述抗性最佳的2份抗青枯病辣椒种子经外表消毒杀菌后,混合研磨成浆,在培养基中进行培养、分离、纯化,获得14株内生细菌(编号为gz1~gz14)。
2.3 拮抗青枯病菌内生细菌的筛选
将获取的14株内生细菌与青枯病菌进行平板对峙,6株内生细菌(gz1、gz6、gz7、gz11、gz13、gz14)对青枯病菌有拮抗作用(表4)。其中,菌株gz6、gz7、gz11、gz13对辣椒青枯病菌的抑菌圈直径>25 mm,抑菌带宽度>8 mm,表现拮抗活性很强,抑菌作用强度为“+++”;菌株gz13对辣椒青枯病菌的抑菌圈直径达到42.22 mm,抑菌带宽度达到15.60 mm,对辣椒青枯病菌表现出很强的拮抗活性(图1)。
2.4 拮抗青枯病菌内生细菌的鉴定
对筛选出的对青枯病菌具有拮抗作用的6株内生细菌,进行形态学和分子生物学方法鉴定。
形态学鉴定:gz1菌落呈圆形、光滑、微凸、边缘整齐、湿润、菌落颜色为无色、革兰氏染色结果为阴性、菌体呈杆状。gz6菌落边缘光滑、凸起、呈脓液状、菌落颜色为浅灰绿色、革兰氏染色结果为阴性、菌体呈球杆状。gz7菌落边缘光滑、微凸、呈脓液状、菌落颜色为绿色、革兰氏染色结果为阴性、菌体呈杆状或长丝状(图1-A)。gz11菌落多呈圆形、边缘光滑整齐、微凸、湿润、菌落颜色为无色、革兰氏染色结果为阴性、菌体呈杆状或丝状。gz13菌落表面光滑、半透明、边缘整齐、有光泽、菌落颜色为淡黄色、革兰氏染色结果为阳性、细胞呈球状或细长、不规则的杆状(图1-B)。gz14菌落边缘光滑、微凸、呈脓液状、菌落颜色为浅绿色、革兰氏染色结果为阴性、菌体呈球杆状。
分子生物学鉴定:6株内生细菌的16S rDNA PCR产物均在750 bp左右,条带清晰。将6株内生细菌的16S rDNA 序列与GenBank数据库中的序列进行比对,找到了同源性高的相似菌株序列,结果为:3株属于或与黏液型铜绿假单胞菌最相似(属于变形菌门,γ-变形菌纲,假单胞菌目,假单胞菌科,假单胞菌属);2株属于或与苍白杆菌最相似(属于变形菌门,α-变形菌纲,根瘤菌目,布鲁氏菌科,苍白杆菌属);1株属于或与微杆菌最相似(属于放线菌门,微杆菌科,微杆菌属)(表5)。
结合形态学和16S rDNA 序列同源性分析,将菌株gz6、gz7、gz14鉴定为黏液型铜绿假单胞菌(Pseudomonas aeruginosa),菌株gz1、gz11鉴定为苍白杆菌(Ochrobactrum),菌株gz13鉴定为微杆菌(Microbacterium)。
2.5 内生细菌抑菌广谱性测定
由表6可知,6株内生细菌均至少对其中一种病原真菌有拮抗作用,其中:有3株内生细菌(gz6、gz7、gz14)对3种植物病原真菌均有拮抗作用,有2株内生细菌(gz11、gz13)对2种植物病原菌有抑制作用,有1株内生细菌(gz1)只对1种植物病原菌有抑制作用。总体而言,大部分内生细菌对立枯丝核病菌、辣椒炭疽病菌拮抗作用强。gz6、gz7、gz14对辣椒疫霉菌、立枯丝核病菌、炭疽病菌均有较好抑制作用,且对辣椒青枯病菌也有很明显的抑制作用,具有广谱抑菌性,可作为有应用前景的生物资源加以研究。
2.6 内生细菌对辣椒青枯病的生防效果
对6株内生细菌进行辣椒青枯病的温室控病试验(表7),结果表明,均具有不同程度的生防效果。6株内生细菌菌株处理后的辣椒植株发病率、病情指数均低于对照。接种28 d时仍有5株株菌具有较明显的相对防效,其中,相对防效大于60%的有3株,分别是gz7、gz11、gz14;相对防效介于30%~60%的有2株,从大到小依次为gz13、gz6。且有5株株菌能使辣椒推迟发病。
将内生细菌对青枯病菌的抑菌带宽与它们对辣椒青枯病的温室控病效果相比较,从图2可以看出,随着抑菌带宽度的增加,相对防病效果并没有完全呈现增加趋势,可能是因为种子浸种后部分内生菌株的定殖效果不好,或者菌株生长环境的变化,导致其不能正常发挥抑菌功效,因此,在应用这些菌株前,仍然需要进行大量的验证试验。
3 讨论与结论
在已有拮抗青枯病菌内生细菌的筛选及其对青枯病生物防治的研究报道中,拮抗内生细菌大部分是从植株根、茎、叶等部位分离的,从种子中分离内生细菌的研究较少,且分离的对青枯病菌具有抗性和生物防效的内生细菌多为芽孢杆菌。如刘杰凤等[10]从番茄、辣椒和茄子3种茄科果蔬中筛选出的14株对青枯病菌有强拮抗性的内生细菌,分属为芽孢杆菌属、埃希氏菌属、克雷伯氏菌属、土壤单胞菌属、欧文氏菌属、短小杆菌属,其中芽孢杆菌为优势种群,而且芽孢杆菌属菌株对青枯病菌的拮抗作用最强。蔡长平[11]从多年连作重茬的辣椒地健康植株根系中分离的1株内生拮抗细菌PEB-99,对辣椒青枯雷尔氏菌、辣椒疫霉菌、辣椒炭疽病菌、辣椒镰刀枯萎病菌都有显著抑制效果,属于贝莱斯芽孢杆菌。江欢欢等[12]从辣椒根际土壤中分离筛选出1株对青枯病菌具有较强拮抗作用的菌株4S,鉴定为枯草芽孢杆菌。孔凡玉等[13]在福建、广东、贵州等地感染青枯病的烟株根部及番茄根部分离出的对青枯病具有拮抗作用的内生细菌,3个属于芽孢杆菌属,2个属于假单胞杆菌。
筆者从抗青枯病辣椒种子中分离出14株内生细菌,其中6株内生细菌对青枯病菌有较好的拮抗作用。结合形态学和16S rDNA序列同源性分析,对6株内生细菌进行鉴定,发现3株属于黏液型铜绿假单胞菌,2株属于苍白杆菌,1株属于微杆菌。6株菌株均具有生防效果,其中菌株gz7、gz11、gz14对辣椒青枯病的生防效果最佳,具有防治疫病、炭疽病、立枯病等多种病害的潜力,是一种潜在的、有效的生防菌株,但未对其进行田间生物防效试验,需要在后续研究中继续完成。试验还发现随着抑菌带宽度的增加,内生细菌对辣椒青枯病的控病效果并没有完全呈现增加趋势,可能是因为种子浸种后部分内生菌株的定殖效果不好,或者菌株生长环境的变化,导致其不能正常发挥抑菌功效,因此在应用这些菌株前,仍需进行大量的验证试验。
笔者从抗青枯病辣椒品种种子中筛选出拮抗青枯病菌的内生细菌6株,并对其进行抑菌广谱性和辣椒育苗期生防能力研究,为辣椒青枯病生物防治探索了新的途径、筛选了功能菌种、提供了理论依据。尤其6株拮抗内生细菌均从种子中获得,种子作为植物物种延续的重要繁殖器官,从中分离的内生菌更易长期定殖生存,也更易演化出与宿主互惠互利的代谢途径[6],在辣椒生产中应用更为简便,防效更为稳定、持久,有助于从种子源头处开展生物防治。
参考文献
[1] 马艳青,张西露.湖南辣椒产业现状及发展思考[J].湖南农业科学,2009(12):94-97.
[2] 黄志农,文吉辉,符伟.湖南辣椒生产概况与病虫害绿色防控[J].辣椒杂志,2011,9(4):43-47.
[3] 曹坳程.毁灭性土传病害综合治理技术体系的构建与创新[J].基层农技推广,2016(11):108.
[4] 张海利,陈永兵,徐坚.番茄青枯病生物防治研究进展[J].农业科技通讯,2008(8):98-101.
[5] 王志伟,纪燕玲,陈永敢.植物内生菌研究及其科学意义[J].微生物学通报,2015,42(2):349-363.
[6] 焦蓉,刘剑金,杨焕文,等.抑制烟草黑胫病菌和促烟草幼苗生长内生菌的分离与鉴定[J].云南农业大学学报(自然科学),2018,33(6):1037-1045.
[7] 刘富中,连勇,冯东昕,等.茄子种质资源抗青枯病的鉴定与评价[J].植物遗传资源学报,2005,6(4):381-385.
[8] 党峰峰,雷玉芬,官德义,等.辣椒种质资源抗青枯病的鉴定与评价[J].植物科学学报,2013,31(4):378-384.
[9] 郎剑锋,杨蕊,赵荣艳.对玉米茎基腐病菌有拮抗活性木霉菌株的筛选[J].安徽农业科学,2010,38(5):2419-2420.
[10] 刘杰凤,韩寒冰,张进凤,等.茄类内生菌的分离及拮抗细菌的筛选[J].安徽农业科学,2009,37(3):1160-1162.
[11] 蔡长平,黄军,曾艳,等.一株辣椒内生拮抗细菌的筛选及初步鉴定[J].湖南农业科学,2018,(7):1-4.
[12] 江欢欢,程凯,杨兴明,等.辣椒青枯病拮抗菌的筛选及其生物防治效应[J].土壤学报,2010,47(6):1225-1231.
[13] 孔凡玉,赵廷昌,张成省,等.防治烟草青枯病生防菌筛选及田间防治试验研究[C]//中国植物保护学会会员代表大会暨学术年会,2005.

