一锅法合成新型羟基环戊烯酮化合物
陈卫达,马永敏,2*
(1.浙江中医药大学 药学院,浙江 杭州 311400;2.台州学院 高等研究院,浙江 台州 318000)
环戊烯酮化合物具有多种生物活性,如抗肿瘤、抗糖尿病、杀虫和杀菌等[1-4]。环戊烯酮化合物具有光化学性质,可用于标记材料[5]。取代环戊烯酮化合物广泛应用于精细香料、化妆品、洗漱用品等领域[6]。此外,由于环戊烯酮化合物的中含有α,β-不饱和羰基结构,也是一类非常重要的环状化合物合成子[7-14]。
合成环戊烯酮的方法主要有:Pauson-Khand反应[15-16],Nazarove环化反应[17]和Rautenstrauch反应[18]。这类方法存在反应时间长、反应条件苛刻、反应物毒性大、产率低、副产物多等问题。
α-二酮和丙酮衍生物的羟醛缩合反应是一种高效的合成方法,Mousavi课题组对该方法进行了详细研究[19-21],效果较好,但原料α-二酮需要提前合成[22-23]。2011年,江焕峰课题组[24]报道了DABCO催化下,二苯乙酮被空气氧化为α-二酮,并与邻苯二胺一锅法合成喹噁啉化合物的方法。2017年,任志刚课题组[25]报道了两性离子Cu(II)催化下,二苯乙酮先被氧化成α-二酮,再与邻苯二胺在一锅内合成喹噁啉化合物的方法。
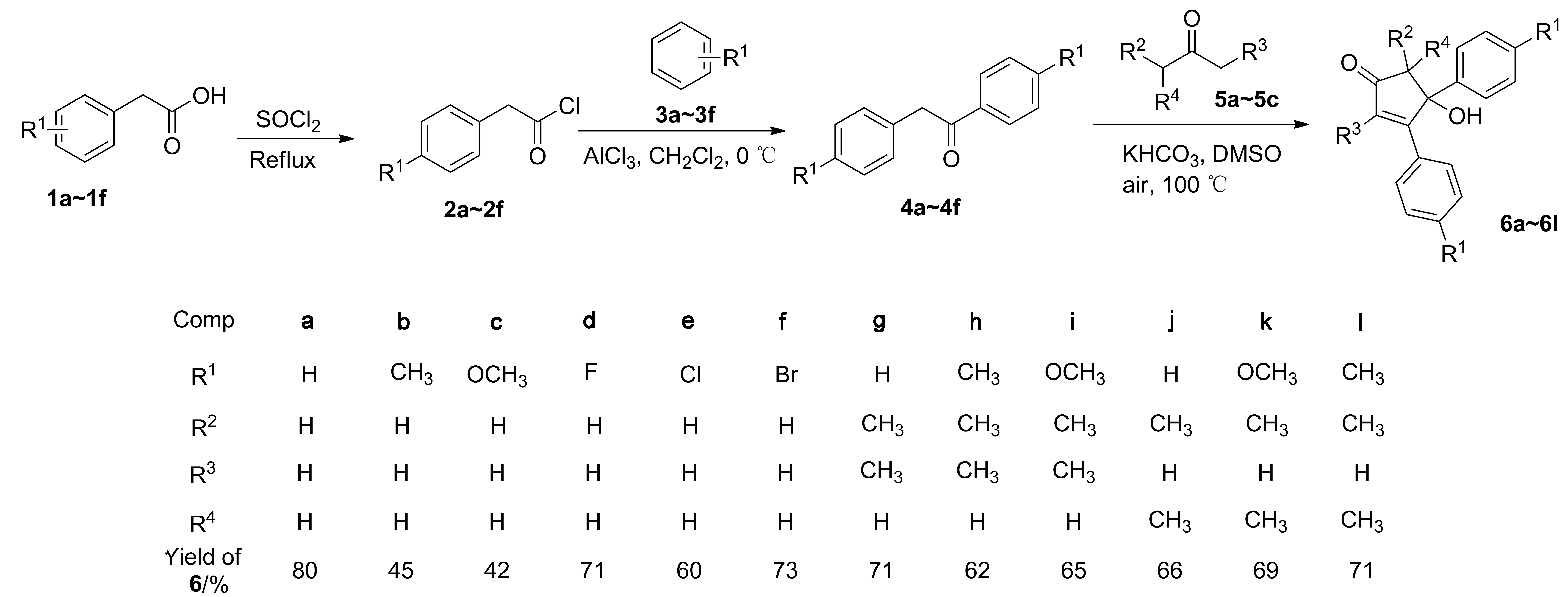
Scheme 1
在此基础上,本文先以苯乙酸和苯为起始原料,经过酰化和傅-克酰基化反应合成二芳基乙酮化合物(4a~4f);再以二芳基乙酮化合物与取代丙酮(5a~5c)为原料,DMSO为溶剂、KHCO3为碱、100 ℃下,经二芳基乙酮氧化、羟醛缩合一锅法合成了12个羟基环戊烯酮化合物(6a~6l,Scheme 1),其中6d,6h和6i为新化合物,其结构经1H NMR,13C NMR和HR-MS(ESI)表征。
1 实验部分
1.1 仪器与试剂
M-565型全自动熔点仪;Bruker ARX-400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);6540 UHD Q-TOF LC/MS型高分辨质谱仪。
所用试剂均为分析纯。
1.2 合成
(1) 二芳基乙酮4a~4f的合成[26-31](以4a为例)
在100 mL圆底烧瓶中加入苯乙酸(1a)1.36 g(10 mmol)和氯化亚砜2.36 g(20 mmol),回流反应3 h。冷却至室温,减压蒸除过量氯化亚砜,粗品中加入苯(3a)1.01 g(13 mmol)和二氯甲烷20 mL,降温至0 ℃,分批加入无水AlCl31.73 g(13 mmol),加毕,搅拌下于室温反应至酰氯(2a)完全反应(TLC检测)。加入冰水,用二氯甲烷(3×50 mL)萃取,合并有机层,依次用饱和食盐水(50 mL)洗涤,无水硫酸钠干燥,过滤,滤液浓缩,残余物经硅胶柱层析[洗脱剂:V(石油醚)/V(乙酸乙酯)=10/1]纯化得白色固体4a,收率95%,m.p.56~57 ℃;1H NMR(400 MHz,CDCl3)δ:8.10~6.99(m,10H),4.28(s,2H)。
用类似的方法合成4b~4f。
4b:淡黄色固体,收率85%,m.p.101~102 ℃;1H NMR(400 MHz,CDCl3)δ:8.00(d,J=8.1 Hz,2H),7.34(d,J=8.4 Hz,2H),7.27~7.20(m,4H),4.31(s,2H),2.49(s,3H),2.41(s,3H)。
4c:白色固体,收率75%,m.p.110~111 ℃;1H NMR(400 MHz,CDCl3)δ:8.03~7.93(m,2H),7.23~7.12(m,2H),6.97~6.88(m,2H),6.88~6.78(m,2H),4.17(s,2H),3.85(d,J=1.4 Hz,3H),3.77(d,J=0.8 Hz,3H)。
4d:白色固体,收率83%,m.p.96~97 ℃;1H NMR(400 MHz,CDCl3)δ:8.08~7.97(m,2H),7.25~7.18(m,2H),7.17~7.09(m,2H),7.06~6.98(m,2H),4.24(s,2H)。
4e:白色固体,收率78%,m.p.113~114 ℃;1H NMR(400 MHz,CDCl3)δ:7.97~7.88(m,2H),7.48~7.39(m,2H),7.35~7.27(m,2H),7.21~7.14(m,2H),4.23(s,2H)。
4f:白色固体,收率91%,m.p.137~138 ℃;1H NMR(400 MHz,CDCl3)δ:7.83(d,J=8.6 Hz,2H),7.62~7.57(m,2H),7.44(dd,J=8.4 Hz,6.0 Hz,3H),7.13~7.07(m,3H),4.19(s,2H)。
(2)6a~6l的合成(以6a为例)
在50 mL圆底烧瓶中加入二苯乙酮(4a)0.20 g(1 mmol),丙酮(5a)0.17 g(3 mmol),KHCO30.3 g(3 mmol)和DMSO 3 mL,于100 ℃反应24 h(TLC监测)。冷却至室温,加H2O 15 mL,用乙酸乙酯(3×8 mL)萃取,合并有机层,依次用饱和食盐水(3×10 mL)洗涤,无水硫酸钠干燥,过滤,滤液浓缩,残余物经硅胶柱层析[洗脱剂:V(石油醚)/V(乙酸乙酯)=3/1]纯化得淡黄色固体6a[20],收率80%,m.p.148~149 ℃;1H NMR(400 MHz,DMSO-d6)δ:7.79 ~7.70(m,2H),7.42~7.37(m,2H),7.34~7.25(m,5H),7.22~7.16(m,1H),6.92(s,1H),6.55(s,1H),2.92(d,J=18.3 Hz,1H),2.65(d,J=18.2 Hz,1H);13C NMR(100 MHz,DMSO-d6)δ:205.2,174.2,145.9,132.4,130.8,129.8,128.9,128.7,128.7,127.2,124.6,80.6,56.9;HR-MS(ESI)m/z:Calcd for C17H14O2Na{[M+Na]+}273.0886,found 273.0882。
用类似的方法合成6b~6l。
6b[21]:白色固体,收率45%,m.p.150~160 ℃;1H NMR(400 MHz,CDCl3)δ:7.43(d,J=8.4 Hz,1H),7.31(d,J=8.2 Hz,1H),7.12(d,J=8.0 Hz,1H),7.08(d,J=7.9 Hz,1H),6.60(s,1H),2.96(d,J=18.7 Hz,1H),2.83(d,J=18.5 Hz,1H),2.31(s,3H),2.29(s,3H);13C NMR(100 MHz,CDCl3)δ:205.4,174.3,141.5,141.4,134.0,129.5,129.5,129.3,128.6,127.9,124.1,81.5,56.7,21.5,21.1;HR-MS(ESI)m/z:Calcd for C19H18O2Na{[M+Na]+}301.1199,found 301.1195。
6c[21]:黄色固体,收率42%,m.p.220~221 ℃;1H NMR(400 MHz,DMSO-d6)δ:7.72~7.62(m,2H),7.25~7.16(m,2H),6.83~6.75(m,4H),6.72(s,1H),6.36(s,1H),3.67(s,3H),3.63(s,3H),2.81(d,J=18.2 Hz,1H),2.50(d,J=18.2 Hz,1H);13C NMR(100 MHz,DMSO-d6)δ:204.9,174.0,161.3,158.3,138.2,131.9,126.4,125.8,124.7,114.19,114.17,80.3,57.0,55.7,55.4;HR-MS(ESI)m/z:Calcd for C19H18O4Na{[M+Na]+}333.1097,found 333.1095。
6d:黄色固体,收率71%,m.p.176~177 ℃;1H NMR(400 MHz,CDCl3)δ:7.61~7.52(m,2H),7.44~7.34(m,2H),7.09~6.91(m,4H),6.64(d,J=3.3 Hz,1H),2.99(d,J=18.7 Hz,1H),2.89(dd,J=18.6,2.2 Hz,1H);13C NMR(100 MHz,CDCl3)δ:204.3,172.5,165.4,163.3,162.8,160.8,139.48,139.45,131.5,131.4,128.73,128.71,127.4,127.3,126.1,126.0,116.1,115.93,115.90,115.7,81.3,56.6;HR-MS(ESI)m/z:Calcd for C17H12O2F2Na{[M+Na]+}309.0698,found 309.0699。
6e[19]:白色固体,收率60%,m.p.229~230 ℃;1H NMR(400 MHz,DMSO-d6)δ:7.82~7.70(m,2H),7.45~7.31(m,6H),6.97(s,1H),6.74(s,1H),2.92(d,J=18.5 Hz,1H),2.68(d,J=18.4 Hz,1H);13C NMR(100 MHz,DMSO-d6)δ:204.9,172.2,144.6,135.7,131.9,131.5,131.1,129.5,129.0,128.9,126.7,80.3,56.4;HR-MS(ESI)m/z:Calcd for C17H12O2Cl2Na{[M+Na]+}341.0107,found 341.0105。
6f[19]:黄色固体,收率73%,m.p.240~241 ℃;1H NMR(400 MHz,DMSO-d6)δ:7.63~7.58(m,2H),7.48~7.42(m,4H),7.28~7.24(m,2H),6.90(s,1H),6.67(s,1H),2.84(d,J=18.4 Hz,1H),2.61(d,J=18.4 Hz,1H);13C NMR(100 MHz,DMSO-d6)δ:204.9,172.3,145.1,131.9,131.8,131.7,131.5,129.5,127.1,124.7,120.5,80.3,56.3;HR-MS(ESI)m/z:Calcd for C17H12O2Br2Na{[M+Na]+}428.9096,found 428.9095。
6g[20]:白色固体,收率71%,m.p.129~130 ℃;1H NMR(400 MHz,DMSO-d6)δ:7.53~7.46(m,2H),7.36~7.16(m,7H),7.13~7.05(m,1H),5.84(s,1H),2.52(q,J=7.4 Hz,1H),1.88(s,3H),1.03(d,J=7.3 Hz,3H);13C NMR(100 MHz,DMSO-d6)δ:209.2,166.8,145.3,136.7,134.8,129.5,128.9,128.34,128.30,126.7,125.7,81.9,55.8,10.3,9.1;HR-MS(ESI)m/z:Calcd for C19H18O2Na{[M+Na]+}301.1199,found 301.1195。
6h:白色固体,收率62%,m.p.105~107 ℃;1H NMR(400 MHz,DMSO-d6)δ:7.41(d,J=8.2 Hz,2H),7.17(d,J=8.2 Hz,2H),7.08(d,J=8.0 Hz,2H),7.00(d,J=8.0 Hz,2H),5.74(s,1H),2.44(q,J=7.3 Hz,1H),2.22(s,3H),2.18(s,3H),1.88(s,3H),1.00(d,J=7.3 Hz,3H);13C NMR(100 MHz,DMSO-d6)δ:209.2,166.9,142.5,138.4,136.0,135.5,132.0,129.6,128.94,128.93,125.5,81.8,55.9,21.3,21.0,10.3,9.1;HR-MS(ESI)m/z:Calcd for C21H22O2Na{[M+Na]+}329.1512,found 329.1512。
6i:白色固体,收率65%,m.p.143~145 ℃;1H NMR(400 MHz,DMSO-d6)δ:7.43(d,J=9.0 Hz,2H),7.13(d,J=8.8 Hz,2H),6.78(d,J=8.9 Hz,2H),6.69(d,J=8.9 Hz,2H),5.65(s,1H),3.64(s,3H),3.59(s,3H),2.36(q,J=7.3 Hz,1H),1.83(s,3H),0.93(d,J=7.3 Hz,3H);13C NMR(100 MHz,DMSO-d6)δ:209.1,166.5,159.7,157.9,137.6,135.1,131.4,127.0,126.7,113.8,113.7,81.6,55.9,55.5,55.3,10.5,9.1;HR-MS(ESI)m/z:Calcd for C21H22O4Na{[M+Na]+}361.1410,found 361.1412。
6j[20]:白色固体,收率66%,m.p.181~182 ℃;1H NMR(400 MHz,DMSO-d6)δ:7.75~7.66(m,2H),7.41~7.16(m,6H),6.93(s,1H),6.20(s,1H),1.16(s,3H),0.42(s,3H);13C NMR(100 MHz,DMSO-d6)δ:210.3,171.0,143.6,132.7,130.7,130.0,128.7,128.5,127.3,126.6,125.8,85.7,55.3,24.4,21.6;HR-MS(ESI)m/z:Calcd for C19H18O2Na{[M+Na]+}301.1199,found 301.1198。
6k[21]:白色固体,收率69%,m.p.144~145 ℃;1H NMR(400 MHz,DMSO-d6)δ:7.76(d,J=9.0 Hz,4H),6.93(d,J=9.0 Hz,4H),6.83(s,1H),6.12(s,1H),3.79(s,3H),3.76(s,3H),1.19(s,3H),0.47(s,3H);13C NMR(100 MHz,DMSO-d6)δ:210.2,170.9,161.3,158.3,135.8,132.0,127.0,125.1,124.2,114.2,113.7,85.4,55.7,55.4,55.1,24.4,21.7;HR-MS(ESI)m/z:Calcd for C21H22O4Na{[M+Na]+}361.1410,found 361.1412。
6l[21]:白色固体,收率71%,m.p.147~148 ℃;1H NMR(400 MHz,DMSO-d6)δ:7.56(d,J=8.0 Hz,4H),7.05(d,J=8.0 Hz,4H),6.77(s,1H),6.03(s,1H),2.19(s,3H),2.17(s,3H),1.08(s,3H),0.35(s,3H);13C NMR(100 MHz,DMSO-d6)δ:210.3,171.2,140.8,140.6,136.2,130.1,129.9,129.3,129.0,125.8,125.5,85.9,55.1,24.3,21.7,21.4,21.0;HR-MS(ESI)m/z:Calcd for C21H22O2Na{[M+Na]+}329.1512,found 329.1515。
2 结果与讨论
2.1 反应条件优化
为优化化合物6a~6l的合成条件,以6a的合成为模型,考察溶剂、反应温度、碱、碱的用量及反应时间对6a收率的影响,结果见表1。

表1 6a合成条件的优化Table 1 Optimization of reaction conditions for synthesizing 6a
Scheme 2

Scheme 3
由表1可见,No.1~6为溶剂对6a收率的影响,结果表明:当DMSO作溶剂时,收率最高(42%,No.2);No.2,7~10为温度对6a收率的影响,温度为100 ℃时,收率最高(58%,No.9),继续升高反应温度,收率未提高(58%,No.10);No.9,11~14为碱对6a收率的影响,结果表明KHCO3作碱时,收率最高(68%,No.13);No.13,15~20为碱的用量对6a收率的影响,当碱的用量为3当量时,收率最高(75%,No.19),增加碱的用量,收率未提高(75%,No.20);No.19,21~24为反应时间对6a收率的影响,反应24 h,收率最高(80%,No.23),延长反应时间,收率不再升高(79%,No.24);
综上所述,合成6a的最佳反应条件为:DMSO作溶剂,KHCO3作碱(3 eq.),于100 ℃反应24 h。
2.2 底物拓展
在最佳反应条件下进行了底物拓展,如Scheme 1所示。我们对对称的二芳基乙酮化合物进行了研究,发现不论是含有给电子基团(CH3,OCH3)的二芳基乙酮还是含有吸电子基团(F,Cl,Br)的二芳基乙酮都能与丙酮以中等至良好的产率获得目标化合物6b~6f(42%~73%)。其中含吸电子的基团的二芳基乙酮所得到的目标化合物的收率明显高于含给电子基团的二芳基乙酮。接着我们又对取代丙酮系列的产物进行了拓展,3-戊酮(5b)和甲基异丙基酮(5c)都能与不同取代基的二芳基乙酮以良好的产率得到预期的羟基环戊烯酮化合物6g~6l(62%~71%),说明该反应具有很好的底物适用性。
2.3 分步实验
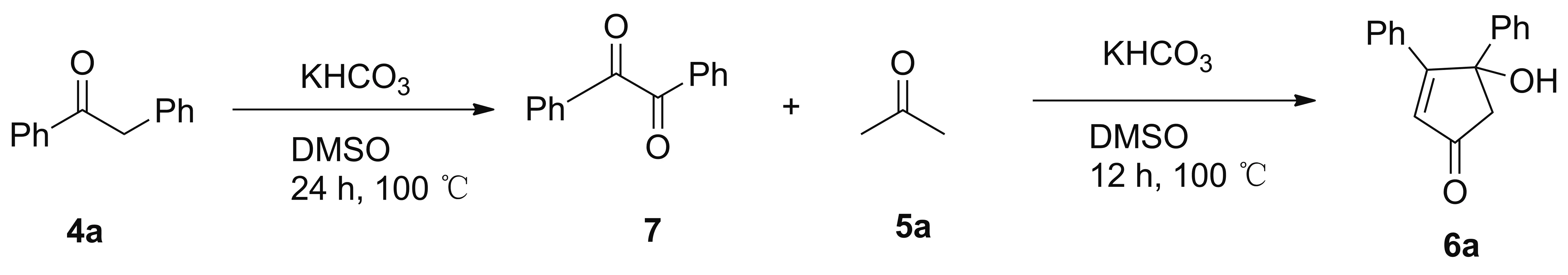
首先以二苯基乙酮4a为原料,DMSO为溶剂,KHCO3为碱,100 ℃反应24 h,得到α-二酮中间体黄色固体7[24],收率90%,m.p.94~95 ℃;1H NMR(400 MHz,DMSO-d6)δ:8.02(d,J=8.0 Hz,4H),7.70(t,J=8.0 Hz,2H),7.55(t,J=8.0 Hz,4 H);再以7和丙酮5a为原料,DMSO为溶剂,KHCO3为碱,100℃反应12 h,得到羟基环戊烯酮6a,收率80%,两步总收率72%(Scheme 2),低于一锅法收率。
2.4 反应机理
根据以上实验结果,我们提出了一个可能的反应机理(Scheme 3)。首先二苯乙酮4a在KHCO3和DMSO的作用下被氧化成α-二酮中间体7,随后丙酮5a在KHCO3的作用下生成双碳负离子中间体8,双碳负离子中间体8进攻二苯乙酮的羰基碳发生羟醛缩合得到中间体9,再脱去一分子水得到产物6a。
以二芳基乙酮和取代丙酮为原料,经二芳基乙酮的氧化和羟醛缩合两个过程一锅法合成了羟基环戊烯酮化合物。该方法具有原料易得、反应步骤短、条件温和和转化率高等优点。

