放疗诱导远端效应的免疫相关机制研究进展
金丽娅,凤志慧
(山东大学公共卫生学院劳动卫生与环境卫生系,山东济南 250012)
放射治疗是临床上应用广泛且高效的癌症治疗方法。电离辐射的靶向作用可直接造成DNA 损伤,有效杀灭局部肿瘤细胞[1]。局部放疗同时可引发全身抗肿瘤反应,即远端效应(abscopal effect),主要表现为局部照射后远处肿瘤的消退[2]。近年来,放疗诱导的远端效应受到了肿瘤学家和癌症研究者的广泛关注,且随着免疫治疗策略的不断发展和应用,这种效应在放疗联合免疫疗法治疗癌症的过程中越来越重要。研究表明,远端效应主要由免疫系统介导,放疗联合免疫治疗可增强全身抗肿瘤免疫反应,提高远端效应的发生率[2-4]。本文重点讨论介导远端效应发生的免疫相关机制。
1 远端效应概况
在肿瘤学中,远端效应主要指局部放疗触发全身抗肿瘤作用,诱导远处非靶向肿瘤消退[5]。目前,广义远端效应是指局部放疗后,在距照射区一定距离的非照射区产生的全身性效应,包括转移瘤效应和正常组织损伤2种形式。前者指肿瘤局部照射后导致远处肿瘤的消退。在临床中,肝细胞癌、乳腺癌、甲状腺癌、淋巴瘤、宫颈癌和黑色素瘤等其他转移性实体肿瘤类型均可发生远端效应。但单独放疗引起的远端效应较为罕见,且大部分远端效应主要发生在肾细胞癌、黑色素瘤和淋巴瘤等免疫原性肿瘤中[6-7]。值得一提的是,转移瘤多在放疗后几个月消退,这表明肿瘤消退不是单一事件的结果,而是在一段时间内接受持续不断的攻击所致。目前认为这种作用主要是通过免疫介导的不同细胞杀伤机制清除肿瘤的结果[8]。此外,正常组织损伤包括诱导正常组织中的基因不稳定性、细胞死亡和致癌转化[9]。对正常组织毒性机制研究表明,免疫反应尤其是炎症反应在电离辐射暴露诱导的早期和晚期副作用中起关键作用[10]。
2 远端效应机制——抗肿瘤免疫反应
虽然目前还不完全清楚远端效应背后的生物学机制,但越来越多的研究表明,免疫系统是调节远端效应的主要决定因素,放射治疗引起的免疫激活是远端效应发生的主要机制[11-14]。肿瘤在体内发生发展具有免疫逃逸的能力,而放疗可通过增强机体对肿瘤细胞的免疫识别,激活免疫系统,对局部甚至远端的肿瘤细胞产生作用。简单来说,电离辐射可导致肿瘤细胞释放“危险信号”,如新的肿瘤抗原。这些信号被抗原呈递细胞(如树突状细胞)摄取。抗原呈递细胞与肿瘤抗原相互作用,迁移到淋巴结,向T细胞提供抗原。经多种信号作用,最终激活肿瘤抗原特异性T细胞。肿瘤抗原特异性T细胞能在全身循环,进入肿瘤(包括原发肿瘤和未照射的转移瘤),发挥杀伤肿瘤细胞的作用[2,9]。
2.1 肿瘤相关抗原释放与损伤相关分子模式暴露启动远端效应
近期有学者提出,远端效应是由同时发生的2 种变化引起全身抗肿瘤免疫反应所介导,即受照肿瘤细胞中肿瘤相关抗原释放和损伤相关分子模式(damage-associated molecular patterns,DAMP)暴露[15]。当肿瘤受到辐射时,肿瘤细胞受到压力或损伤可导致新抗原的释放,称为肿瘤相关抗原。大量肿瘤相关抗原及其多样性可刺激体内产生肿瘤特异性免疫反应,肿瘤相关抗原被抗原呈递细胞吞噬,呈递到CD8+T 细胞,进而启动CD8+T 细胞,促进原发肿瘤细胞和转移性肿瘤细胞的清除[14]。近年来,人们提出一种细胞死亡类型——免疫原性细胞死亡。放疗、某些化学药物和光动力治疗等均可引起肿瘤细胞的免疫原性细胞死亡,诱导细胞膜表面释放一系列免疫信号分子,称为DAMP[16]。这些包括内质网钙网蛋白、ATP、热休克蛋白(heat shock protein,HSP)和高迁移率族蛋白B1(high mobility group box 1,HMGB1)在内的DAMP 能激活抗原呈递细胞,诱导细胞毒性T 淋巴细胞(cytotoxic T lymphocyte,CTL)启动适应性免疫反应[5,17]。其中,钙网蛋白是一种Ca2+结合蛋白,凋亡前细胞表面钙网蛋白暴露后作为强有力的吞噬信号募集并刺激树突状细胞成熟,对抗肿瘤免疫至关重要。同时,钙网蛋白被释放到周围环境中,与巨噬细胞相互作用,诱导巨噬细胞活化,促进促炎因子释放[16]。肿瘤发生免疫原性细胞死亡能促进ATP 的暴露和释放,通过与嘌呤受体P2Y2 结合可招募单核细胞,或通过结合P2X7 作为促炎分子诱导炎症因子白细胞介素1β(interleukin-1β,IL-1β)释放[18]。HSP70和HSP90在免疫原性细胞死亡过程中迁移到细胞膜上,与树突状细胞上各自对应受体CD40 和CD91 相互作用。其中,HSP70 与CD40 受体相互作用促进CD8+T 细胞活化,而HSP90联合GP96与CD91受体相互作用促进肿瘤抗原交叉表达至T 细胞[16]。HMGB1 是一种核蛋白,主要在坏死时从细胞核释放,触发炎症[19]。HMGB1 与Toll 样受体2(Toll-like receptor-2,TLR2)和TLR4 结合,可作为促炎介质刺激单核细胞产生肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、IL-1、IL-6和IL-8等炎症因子。此外,HMGB1还可促进树突状细胞成熟,阻止其中的肿瘤抗原降解,协助抗原表达,进而改善肿瘤抗原的呈递[20-21]。虽然DAMP通过各种机制发挥其作用,但他们的功能结果是相同的,即激活抗原呈递细胞,介导全身抗肿瘤免疫反应的一个关键步骤。如上所述,电离辐射诱导原位肿瘤细胞发生免疫原性细胞死亡,细胞膜表面释放DAMP,在DAMP 的作用下,抗原呈递细胞(如树突状细胞)被募集和激活,成熟的树突状细胞对肿瘤细胞释放的肿瘤相关抗原进行摄取和处理并迁移至肿瘤引流淋巴结,在淋巴结中通过主要组织相容性复合体(major histocompatibility complex,MHC)与T 细胞受体结合向T 细胞传递特异性肿瘤抗原信号;与此同时,T 细胞,特别是CD8+T细胞,被多种信号激活(如共刺激分子CD28和CD80)并开始增殖,活化的CD8+T 细胞离开淋巴结,浸润肿瘤,包括原发肿瘤和未照射的转移瘤,识别和攻击肿瘤细胞,导致远端效应发生(图1)。除效应T 细胞外,活化的记忆T 细胞及免疫球蛋白也可循环攻击远端肿瘤,产生长期全身抗肿瘤免疫反应,抑制肿瘤复发[22]。
2.2 细胞因子与趋化因子调节远端效应
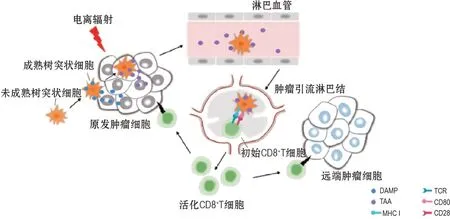
图1 远端效应发生的免疫机制.DAMP:损伤相关分子模式;TCR:T细胞受体;TAA:肿瘤相关抗原;MHCⅠ:主要组织相容性复合体Ⅰ.
放射治疗诱导宿主细胞释放的细胞因子与趋化因子可调节抗肿瘤免疫反应[23],进而调节远端效应的发生。放疗引起组织损伤等释放的部分炎症因子以及趋化因子可帮助将白细胞聚集到肿瘤微环境中,有助于产生适应性免疫反应。更重要的是,该作用不仅在局部发生,同时可诱导全身抗肿瘤免疫反应,进而干扰非靶向肿瘤部位的生长,促进远端效应发生,且该作用可能持续较长一段时间[8]。多项研究表明,肿瘤局部照射可引起循环细胞因子水平的改变[24-25]。放疗引起肿瘤细胞免疫原性死亡,释放的DAMP即可通过不同途径促进炎症因子的释放。临床研究发现,头颈部肿瘤患者接受局部放疗1个月后血清中TNF-α水平显著升高[26],TNF-α 可促进局部乃至全身细胞毒性免疫细胞的活性[27]。辐射也可影响γ 干扰素水平,γ 干扰素可有效的激活巨噬细胞、自然杀伤细胞和中性粒细胞的吞噬活动,促进主要MHC-Ⅰ和MHC-Ⅱ分子合成,提高肿瘤抗原表达[28]。此外,促进机体免疫反应的还有Ⅰ型干扰素、IL-1β和IL-18等细胞因子[2],均可通过不同途径激活体内抗肿瘤免疫反应。趋化因子是一类趋化免疫细胞定向迁移的细胞因子,也可在放疗后分泌增加。例如,CXC趋化因子配体10 在放疗后分泌增加,与单核细胞、自然杀伤细胞和T细胞相互作用,趋化其至肿瘤发生部位,杀伤肿瘤细胞。此外,放疗还可刺激肿瘤细胞释放CXC趋化因子配体16,增加CD8+T对肿瘤组织的浸润[29]。值得一提的是,放疗诱导炎性介质等的分泌促进全身抗肿瘤免疫反应,引起原位及远端肿瘤的消退,同时也可能对正常组织产生毒性作用,引起与免疫相关的不良事件,包括皮肤、胃肠、肝和内分泌系统的炎症事件等[10]。
然而,除放疗诱导的部分细胞因子与趋化因子可激活体内抗肿瘤免疫反应,介导远端效应外,同时也会产生对抗肿瘤免疫反应具有抑制作用的因子,影响免疫清除和免疫耐受之间的微妙平衡。
2.3 免疫逃逸限制远端效应
实际上,单纯放疗引起的远端效应是较为罕见的,这表明在人体内即使是激活肿瘤抗原特异性T细胞也难以维持有效的全身抗肿瘤反应。抗肿瘤免疫的诱导是一个多步骤的过程,每一步都由正、负信号调控[30]。放疗也可诱导机体产生免疫抑制。程序性死亡蛋白1(programmed cell death-1 protein,PD-1)是重要的免疫抑制分子,在免疫逃逸中发挥重要作用。放疗后,其配体程序性死亡蛋白配体1(programmed cell death ligand-1,PDL-1)在肿瘤细胞中表达上调,与在T细胞、树突状细胞和自然杀伤细胞的质膜上表达的PD-1连接,促进T细胞凋亡,导致活化的T细胞被清除[31]。此外,在T细胞上表达的表面受体,CTL 相关抗原4(CTL associated antigen-4,CTLA-4)与CD28 竞争结合抗原呈递细胞上的B7 家族配体CD80 和CD86,抑制T细胞的增殖活化[32]。放疗可诱导肿瘤细胞释放促进免疫反应的细胞因子,与此同时也会引起免疫抑制细胞因子释放,如转化生长因子β(transforming growth factor-β,TGF-β),可通过降低树突状细胞的抗原提呈能力以及抑制效应T细胞的激活来抑制免疫应答[33]。以及集落刺激因子1(colony stimulating factor 1,CSF-1)、IL-6、IL-10 和CXC 趋化因子配体12 等,均具有相应的免疫抑制功能,有助于肿瘤细胞的增殖和侵袭,从而表现出促肿瘤发生的作用[2]。肿瘤相关巨噬细胞一般分为经典活化的抗肿瘤巨噬细胞M1 和选择性活化的促肿瘤巨噬细胞M2[34]。M1 型巨噬细胞活化可诱导IL-12 和TNF-α等促炎细胞因子的释放,发挥杀伤肿瘤细胞的作用。而M2 型巨噬细胞作为抗免疫原性细胞,表达IL-10,TGF-β 等抗炎细胞因子,抑制效应T 细胞的功能,促进肿瘤进展[35]。事实上,大多数肿瘤相关巨噬细胞是促进肿瘤进展的M2 型巨噬细胞[2]。骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSC)、未成熟树突状细胞也可能抑制T细胞功能[14]。以及具有调节功能的CD4+T 细胞(regulatory T cells,Treg),Treg 细胞是一种特殊类型的CD4+T细胞,在维持肿瘤免疫耐受中发挥重要作用。Treg细胞可分泌免疫抑制细胞因子如TGFβ和IL-10,损害树突状细胞的抗原递呈功能及抑制效应T细胞的激活。此外,Treg细胞还可促进肿瘤血管生成,增强MDSC 发挥免疫抑制功能,最终导致肿瘤进展[2]。肿瘤细胞的免疫逃逸抑制全身抗肿瘤免疫反应激活,抵抗免疫系统对远端肿瘤细胞的清除,抑制远端效应的发生发展。
2.4 巨噬细胞参与远端效应
值得一提的是,巨噬细胞除参与适应性免疫反应外,本身也可对肿瘤细胞产生直接杀伤作用。有学者提出,凋亡的肿瘤细胞可触发巨噬细胞发挥抗肿瘤作用,活化的巨噬细胞可特异性地识别肿瘤细胞,浸润肿瘤进而破坏肿瘤细胞[36]。ENE等[37]在抗PDL-1抗体直接激活巨噬细胞有助于放射诱导胶质母细胞瘤产生远端效应这一研究中提出,抗PDL-1抗体可能使浸润的巨噬细胞极化进入抗肿瘤状态,从而导致非辐射区中的肿瘤细胞被消灭。并提出在没有T 细胞浸润的情况下,巨噬细胞的直接活化与远端效应有关。因此,巨噬细胞可能在一系列作用下极化为抗肿瘤巨噬细胞,对肿瘤细胞产生直接杀伤作用参与远端效应的发生。关于巨噬细胞参与远端效应的机制有待进一步研究。
3 放疗联合免疫疗法诱导远端效应
临床病例报告显示,单纯放疗诱导的远端效应总体发生率较低,提示单纯放疗可能不足以克服恶性肿瘤的免疫耐受,而免疫激活可能有一个很高的阈值,才能表现出临床相关的反应。免疫治疗可降低宿主对肿瘤的免疫耐受。随着免疫治疗策略的不断发展和应用,研究表明,放疗联合免疫治疗有可能增强机体抗肿瘤免疫应答,提高远端效应的发生率[14,38]。
DEMARIA 等[12]对患有同基因型乳腺癌的67NR 小鼠进行放射治疗,发现单纯放疗仅导致照射肿瘤生长延迟,而放疗与可促进树突细胞增殖的生长因子Flt3 配体联合治疗,可使未照射肿瘤发生显著的增长延迟。DEWAN等[39]在乳腺癌和结肠癌小鼠模型中均发现,采用分割放疗联合抗CTLA-4抗体免疫治疗时,可诱导明显的远端效应。免疫检查点分子PD-1和它的配体PDL-1是肿瘤免疫疗法的焦点之一。ENE 等[37]在建立的小鼠神经胶质瘤模型中发现,抗PDL-1 免疫治疗可通过典型的T 细胞激活和直接巨噬细胞激活增强辐射诱导的远端效应。除动物模型外,已有大量临床研究显示,放疗与靶向免疫调节剂和免疫阻断剂等的联合作用可诱导患者机体产生远端效应。ABDO等[2]总结了2005-2013 年15 项临床试验中放射治疗与免疫疗法、癌症疫苗等联合使用产生的远端效应,均获得阳性结果。LIU 等[40]在近期的研究中表示,晚期或复发性肝内胆管癌患者对放化疗敏感性有限,且多处病变并存,预后较差。立体定向放疗联合PD-1阻断对原发病灶和淋巴转移灶均有较好控制。如前所述,CTLA-4可抑制免疫反应。CTLA-4抑制剂易普利姆玛(Ipilimumab)与放射治疗联合应用已被美国食品和药物管理局批准用于转移性黑色素瘤的治疗。多项回顾性研究表明,该联合治疗策略可诱导转移性黑色素瘤发生远端效应,并延长患者的中位生存期[2]。粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)是促进树突状细胞成熟的有效因子。GOLDEN 等[41]研究表明,放疗联合GM-CSF治疗包括非小细胞肺癌、乳腺癌和胸腺癌在内的转移性实体瘤,观察终点为转移瘤最长直径至少减少30%;其次是患者的安全性和存活率,最终约30%的患者产生了远端效应。
原位疫苗接种是一种新型癌症免疫疗法,即将免疫调节剂局部注入到肿瘤中增强肿瘤特异性抗原表达,进而启动或刺激免疫反应产生全身抗肿瘤免疫[22]。原位疫苗接种与远端效应发生密切相关。在一项多中心临床试验中,对29例惰性淋巴瘤患者单一肿瘤部位进行低剂量放疗并注射TLR9激动剂SD-101,发现24 例患者未放疗部位的肿瘤缩小[42]。目前,原位疫苗接种免疫治疗的重点研究方向之一即是开发最佳方法,以成功克服肿瘤介导的局部免疫抑制,并产生有效的全身抗肿瘤免疫反应,抑制转移瘤的发生发展,诱导远端效应。
4 结语
随着对远端效应越来越深入和广泛的研究,放疗已不仅仅作为简单的局部肿瘤的治疗方式而存在。免疫系统作用机制的研究进展使我们能研究免疫在放疗诱导远端效应中的意义。且随着免疫疗法的发展,放疗与免疫疗法的结合使放疗诱导的远端效应更具有临床意义。然而,这种联合治疗仍存在许多挑战。如需确定放疗的最佳剂量与分割方式以更有效地激活抗肿瘤免疫反应,产生远端效应。以及确定免疫治疗和放射治疗的最佳时间和顺序。有研究指出,两者的治疗顺序可能对免疫系统的作用产生影响,需进一步的研究来了解和利用这些机制。不可忽略的是,远端效应的产生机制是复杂的,除引起转移瘤消退外,对正常组织的损伤也不可忽视。经联合治疗的患者可能发生不良反应,在一些研究中已报道了3级或更高的毒性,因此寻找有效的方法来降低风险是十分重要和紧迫的。总而言之,放射治疗与免疫治疗相结合以增强远端效应,有望得到广泛应用,从而改善患者预后和挽救更多生命。

