免疫营养与中医药在消化道肿瘤综合治疗中的辅助作用与应用前景
魏超新, 霍春勇, 刘国彦
魏超新, 霍春勇, 刘国彦, 厦门大学附属中山医院胃肠外科 福建省厦门市 361000
核心提要: 免疫营养和中医药在消化道肿瘤(digestive tract tumor, DT)患者接受手术、放化疗等抗肿瘤治疗过程中都起到了调节免疫功能、改善营养状况、改善生存质量的作用.也有研究表明免疫营养素和中药提取成分可调节免疫系统, 起到抗肿瘤的作用.因此二者在DT综合治疗中有着重要的地位和应用前景.
0 引言
根据最新发布的中国恶性肿瘤流行病学数据: 发病率最高的前五位肿瘤中, 消化道肿瘤(digestive tract tumor,DT)占3位, 分别是胃癌、结直肠癌、肝癌; 死亡率最高的前五位肿瘤中, DT占4位, 分别是肝癌、胃癌、食管癌、结直肠癌[1].DT已严重威胁到我国人民健康水平.近年来, 治疗DT的方法也取得了巨大的突破.人们已认识到现有的各种治疗手段都有其一定的特点和局限性,因此多学科协作的肿瘤综合治疗的概念应运而生, 经过几十年发展已成为当今肿瘤治疗的一个科学、合理的新型模式[2].随着营养治疗广泛用于临床及医疗新技术的发展, 免疫营养在DT综合治疗中发挥的作用越来越受到人们的重视[3].在我国, 中医治疗肿瘤的整体观念和辩证论治的理念, 以及中药成分在调整机体免疫功能, 维持机体整体性功能稳定等在DT的综合治疗中有着得天独厚的优势.本文将对DT综合治疗发展现状、免疫营养和中医药在DT综合治疗中所起到的辅助作用以及应用前景等方面作一综述.
1 DT综合治疗的概念
传统的DT治疗措施包括手术和放化疗, 治疗方式比较单一, 在消灭肿瘤细胞的同时也对机体造成巨大的打击, 如免疫抑制、营养不良等.机体的免疫抑制和营养不良导致的肿瘤复发和转移是治疗DT失败的主要原因, 另外肿瘤局部治疗的不彻底也是复发的重要原因[4].鉴于过去单一治疗恶性肿瘤的局限性, 上个世纪六七十年代我国专家提出肿瘤综合治疗的概念.根据病人的具体情况, 如机体情况、病理类型、浸润范围(病理分期)和发展趋势, 合理地、有计划地应用现有的治疗手段的最佳组合, 以期较大幅度地提高治愈率、延长生存期、提高生活质量.目前DT的综合治疗措施包括手术治疗、放化疗、介入治疗、生物治疗、中医中药治疗等,手术和放化疗仍然是目前公认具有肯定疗效的治疗手段.综合治疗不是几种治疗措施的简单叠加, 而是各个学科互相补充, 取长补短, 以最适当的经济费用取得最好的治疗效果[5].肿瘤综合治疗根据患者的全身情况和肿瘤的具体特征, 制定的综合治疗模式不仅仅是注重取得杀灭肿瘤细胞、缩小肿瘤体积的近期疗效, 更注意保护病人的免疫功能和机体的正气, 进行辩证论治, 才不会导致抗肿瘤治疗过后患者免疫系统功能下降, 机体整体性功能失调等状况, 从而提高患者预后与生活质量[6].
2 免疫营养在DT综合治疗中的作用
免疫营养是指应用一些特定的、能改善肿瘤患者营养状况及调节机体免疫和炎症反应的营养物质, 从而减少感染及非感染并发症、缩短住院时间、提高治疗效果[7].这符合了肿瘤综合治疗中“保护患者的免疫功能和机体正气, 以及注重抗肿瘤远期疗效”的内涵.目前研究较多的免疫营养素包括精氨酸(arginine,Arg); 谷氨酰胺(glutamine, Gln); ω-3多不饱和脂肪酸(ω-3 Polyunsaturated fatty acids, ω-3PUFA); 核苷酸; 维生素类主要包括维生素C、维生素D以及维生素E等; 微量元素包括锌、硒等; 以及具有免疫调节功能的肠道益生菌[8].近年来免疫营养在DT综合治疗中发挥的作用越来越受到人们的重视.
1992年Daly等[9]最早研究了含Arg、ω-3PUFA及核苷酸的免疫营养配方对上DT患者术后恢复的影响.应用免疫营养治疗的患者术后感染以及非感染并发症的发生率降低, 淋巴细胞有丝分裂加快.此后关于免疫营养治疗的研究涉及肿瘤患者的手术、放化疗等多个治疗过程.
2.1 免疫营养在DT患者术后快速康复中的优势作用 快速康复外科(fast-track surgery, FTS)由丹麦哥本哈根的Henrik Kehlet教授[10]于1997年提出.FTS是在围手术期采取一系列的综合措施, 减轻应激反应, 减少术后并发症, 缩短康复时间.已有研究表明, 术前给予肠内免疫营养支持, 可显著改善结肠癌患者预后.赵东峰等[11]对60例结肠癌患者术前7 d开始分别进行肠内免疫营养、标准肠内营养以及肠外营养支持, 结果显示: 肠内免疫营养组的血清营养指标、术后并发症发生率及康复状况均优于其他两组(P<0.05).花园园[12]对80例胰腺癌患者进行术后早期肠内免疫营养支持, 发现早期肠内免疫营养支持组的营养状况、免疫功能较早期肠内常规营养支持组好, 胃肠道功能恢复时间较对照组快(P<0.001).2012年Marimuthu等[13]纳入了26项随机对照试验, 共2497名胃肠道手术患者的荟萃分析, 证明了围手术期免疫营养支持能显著减少择期手术患者术后发生感染和伤口并发症的几率, 缩短住院时间.加速康复外科围术期营养支持中国专家共识(2019版)[14]认为, 免疫营养可以改善DT患者的营养状况, 有利于提高机体免疫力、控制急性炎性反应、保护肠黏膜屏障功能, 降低并发症发生率.这些都表明免疫营养在FTS中发挥巨大的优势作用.
2.2 免疫营养在DT患者放化疗中的作用 大部分的DT患者在整个治疗期间需要放疗和(或)化疗, 然而放化疗在消灭肿瘤细胞的同时也会导致免疫抑制、营养不良以及一系列的毒副作用, 影响患者的治疗耐受性.免疫营养在放化疗中起着“保驾护航”的作用, 提高患者接受抗肿瘤治疗的耐受性.有研究表明[15], 免疫营养能通过调节免疫细胞表型和基因表达, 增强其免疫功能; 同时免疫营养使机体更容易适应放化疗诱导的全身炎症反应和氧化应激.2014年发表的一项关于对71例食管癌患者行同步放化疗期间应用免疫营养治疗的RCT[16]显示, 免疫营养的治疗组与标准营养支持的对照组相比,治疗组C-反应蛋白(P= 0.001)、肿瘤坏死因子(tumor necrosis factor, TNF)(P= 0.014)升高不如对照组明显.CD3、CD4、CD8、白细胞计数、多形核细胞和淋巴细胞计数均高于对照组(P<0.05).表明免疫营养可减轻放、化疗引起的炎症反应, 维持机体免疫功能.Miyata等[17]也对61例食管癌新辅助化疗患者在化疗过程中随机给予的ω-3PUFA增强的免疫营养支持和标准营养支持, 其中治疗组(ω-3PUFA增强的免疫营养支持)口腔炎发生率明显低于对照组(P<0.018).治疗组的腹泻发生率相对低于对照组(P<0.068).治疗组的天冬氨酸转氨酶和丙氨酸转氨酶水平的升高明显低于对照组.可见ω-3PUFA增强的免疫营养支持可降低化疗引起的黏膜毒性反应, 如口腔炎和腹泻, 并在化疗期间起到保肝作用.此外台湾胃肠病学会2018年发布的一篇关于食管癌营养治疗的共同声明[18]中也指出, 肠内免疫营养可以降低食管癌患者化疗引起的黏膜炎的严重程度, 维持同步放化疗期间的免疫功能和营养状况.1995年Daly等[19]的研究小组还发现, 在上DT患者出院的放、化疗期间继续应用添加Arg和ω-3PUFA的空肠营养能提高患者对放、化疗的耐受性和治疗效果, 降低放化疗引起的再住院率.欧洲肠外肠内营养学会指南[20]认为当肿瘤患者存在系统性炎症时, 全身蛋白质合成代谢极为困难时, 应推荐免疫营养支持; 对于无法治愈的肿瘤患者, 伴有体重降低和营养摄入不足时, 应用“免疫增强型”肠外营养可能有益.可见在接受放、化疗的患者中予以免疫营养支持对患者的疗效是有益的.
2.3 免疫营养的作用机制 (1)提供营养底物, 改善营养状况: 免疫营养首先是营养支持, 提供机体代谢所需能量物质, 改善营养状况[7]; (2)保护肠黏膜屏障功能: Gln及Arg作为营养物质可修复肠上皮, 保护肠黏膜免疫屏障作用; 另外肠道益生菌可维持肠道正常菌群平衡, 拮抗有害病菌, 都起到维持胃肠道黏膜屏障功能的作用, 防止肠道细菌和毒素易位, 引起肠源性感染[21]; (3)增强免疫细胞防御功能: Arg、Gln、ω-3PUFA、核苷酸、维生素、锌、硒等可促进淋巴细胞增殖、分化及细胞因子的产生, 促进巨噬细胞等的杀伤作用, 增强免疫系统的防御作用[22]; (4)直接抗肿瘤作用: ω-3PUFA、硒等可通过抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制肿瘤新生血管形成从而发挥抗肿瘤作用[23]; (5)抗氧化作用:Gln能促进谷胱甘肽的合成, 抑制氧自由基诱导的细胞毒性, 维持免疫细胞的杀伤活性; 维生素和微量元素都可参与机体抗氧化作用, 起到免疫调节作用; (6)调节局部与全身炎症反应: ω-3PUFA可通过抑制T淋巴细胞和脾细胞对有丝分裂原的反应, 抑制树突状细胞基因的表达, 抑制细胞因子的表达, 如白介素(interleukin, IL)-1、IL-6、TNF-α等细胞因子.并通过调节跨膜受体介导的信号转导或核受体介导信号转导途径发挥抗炎作用[24].
免疫营养目前已逐渐应用于DT的综合治疗中.免疫营养的提高免疫力、改善营养状况和抗肿瘤的特性,极大地丰富DT综合治疗的内涵 .虽然免疫营养的疗效尚存在争议, 但我们仍然可以看到其在DT综合治疗中所展现的独特作用及广阔的应用前景.
3 中医药在DT患者综合治疗中的应用
在我国, 中医药治疗肿瘤已有数千年的历史, 积累了丰富的经验.中医学强调“辩证论治”, 注重保护患者内环境的平衡, 提高免疫力, 维持机体正气.在改善患者生活质量方面有着较好的作用, 这与肿瘤综合治疗的理念不谋而合.另外中医药在与手术、放化疗等西医治疗过程的配合可起到减毒增效的作用, 在改善症状、治疗并发症、预防肿瘤复发等方面均有作用.
3.1 中医药在术后康复中的作用 中医认为, 腹部外科术后因创伤、失血、麻醉、机体气血运行无力, 胃肠功能失调, 清气不升, 浊气不降, 阻于中焦, 腑气难通.黎国锋等[25]对69例行胃癌根治术患者进行分组, 对照组予以胃肠道手术围手术期常规治疗(术前灌肠、禁食、禁饮, 术后胃肠减压并根据胃肠功能恢复逐步恢复流食、半流食、普食).观察组在此常规治疗基础上术后第1天开始予以针灸, 并以制半夏、苏子、大腹皮、厚朴制成敷料, 避开缝合伤口持续敷于脐部, 结果显示, 观察组的肠鸣音恢复时间和首次肛门排气时间均短于对照组, 差异具有统计学意义(P<0.05).观察组进流质的时间亦短,与对照组对比, 差异具有统计学意义(P<0.05).住院天数对比, 观察组明显短于对照组, 差异具有统计学意义(P<0.05).表明中医干预可促进腹部术后胃肠功能的恢复.另有文献表明中医食疗可调节炎症应激、调节免疫促进DT术后的康复[26].
3.2 中医药在放、化疗过程中的作用 中医药对放、化疗的减毒作用以“辩证论治”为理论基础, 以现代实验研究结果为依据, 针对放、化疗所致的骨髓抑制、免疫抑制、肝肾功能损害、消化道反应等副作用, 以“扶正培本”为主, 辅以补益气血、养肝益肾、健脾和胃等法进行辩证施治, 起到了明显的疗效[27].周冠强等[28]用实验证明了参麦注射液对60Co照射所致的小鼠外周血白细胞和骨髓有核细胞数减少的治疗有效.王燕虎[29]应用香砂六君子汤加减治疗化疗后胃肠道反应患者70例, 结果显示治疗组胃肠道反应改善明显优对照组(P<0.01),治疗组生活质量改善明显优于对照组(P<0.01).骨髓抑制是放化疗最常见的并发症之一, 往往造成患者不能足量完成放化疗, 或者导致患者严重的感染而病死, 严重影响了抗肿瘤治疗的耐受性和疗效.王国方[30]用益气生血汤防治恶性肿瘤化疗后骨髓抑制, 对照组采用常规治疗, 治疗组在常规治疗上加益气生血汤, 结果化疗后治疗组的白细胞、红细胞、血小板均高于对照组(P<0.01), 治疗组使用粒细胞集落刺激因子的剂量显著低于对照组(P<0.01).另外, 化疗期间肝肾损害也是影响疗效的一大阻碍.王凌凌等[31]将异甘草酸镁与还原型谷胱甘肽对化疗后肝损伤的治疗效果进行对比, 结果显示异甘草酸镁治疗化疗后肝损伤有效率高达93.94%, 显著高于还原性谷胱甘肽的治疗有效率(P<0.05), 提示异甘草酸镁对化疗后肝损伤治疗效果显著, 并且优于还原性谷胱甘肽.
3.3 中医药在晚期恶病质的DT患者姑息治疗中的作用 晚期的DT患者常因肿瘤消耗、内分泌代谢紊乱、营养摄取障碍、伤害性抗肿瘤治疗等因素造成恶病质[32].对于晚期严重恶病质的DT患者, 临床多采用姑息性治疗手段.中医药在DT患者姑息性治疗中有着得天独厚的优势.中医的特点是整体调理, 辩证论治, 减轻晚期患者的各种症状, 增强免疫功能, 抑制或延缓肿瘤的生长, 而提高患者的生活质量和生存期[33].中医学认为晚期恶病质临床特征符合中医“虚证”表现, 扶正制剂能够扶助衰竭患者的正气, 增强对抗肿瘤的能力, 治疗应着重从“虚”入手, 以补益、扶正为主.刘子凤等[34]对39例DT恶病质患者, 采用参芪扶正注射液(每250 mL中含党参、黄芪各10 g)及营养支持治疗, 治疗后DT恶病质组较治疗前食欲改善、体重指数及卡氏评分均有所增加(P<0.05), 差异均有统计学意义.恶性腹水是晚期DT患者常见的并发症, 多由肿瘤进展或肿瘤转移癌引起, 是病情恶化或预后不良的标志.周凌阳等[35]对晚期胃癌腹水患者采用腹腔抽液后注入顺铂、利多卡因和地塞米松40例(对照组1), 腹腔抽液注药后口服中药治疗40例(对照组2), 腹腔腹腔抽液注药后口服中药加中药外敷40例(观察组), 结果观察组在腹水消退、肿瘤标志物水平下降及生活质量改善方面均明显优于两对照组(P<0.05).对照组2疗效优于对照组1(P<0.05).表明中药内服外敷联合腹腔灌注化疗药具有更明显疗效.癌性疼痛是中晚期肿瘤患者最常见、最痛苦的症状之一, 严重影响患者的生活质量, 中药治疗癌痛有副作用小、无成瘾性等优点.近年来,关于中医药治疗癌痛的试验和临床研究,取得一定的进展[36].
3.4 中医药治疗DT的机制 中医药在抗肿瘤机制上与现时代医学的肿瘤生物治疗有异曲同工之处.现已证实, 许多中药里的有效成份可起到生物调节应答、细胞毒、抗突变、诱导肿瘤细胞分化和凋亡、抑制血管生长等作用[37].有研究表明黄芪和猪苓多糖可激活巨噬细胞, 促进淋巴细胞转化, 诱导细胞因子生成, 刺激自然杀伤细胞增殖并提高其活性, 激活补体系统[38].许多中药或复方具有抗突变作用, 如: 甘草甜素、当归等中药能阻断二乙基亚硝胺所致大鼠的肝癌前病变.此外六味地黄丸、黄芪、白术、仙茅、枸杞子、天冬等均有抗突变作用[39].诱导肿瘤细胞凋亡是当今肿瘤治疗研究的热点, 有报道[40]小柴胡汤可作用于肝癌细胞引起细胞凋亡.另有实验发现[41]甘草甜素具有增强肝癌细胞自噬活性, 诱导细胞自噬性死亡的能力, 具备极大的临床应用潜力.肿瘤的生长与肿瘤血管生成关系密切, 抑制肿瘤血管形成是重要的抗肿瘤途径之一.何芳等[42]用实验证明了人参皂苷Rg3具有抑制肝癌组织内微血管生成的功能.这些治疗原理都与现代医学中生物治疗相似, 这为我们研发肿瘤生物治疗药物提供了丰富的原材料.
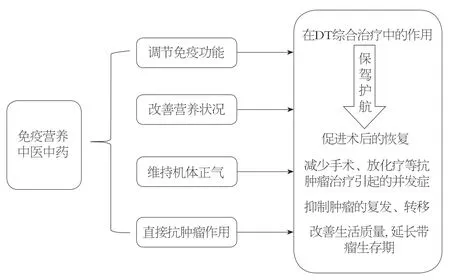
图1 免疫营养与中医药在消化道肿瘤综合治疗中的作用.
4 中医药与免疫营养在DT综合治疗中的前景展望
目前西医在DT患者的防治中仍然处于主导地位, 但手术、放疗、化疗等抗肿瘤方法对机体所造成的不良影响尚无有效的预防措施.即使手术成功切除肿瘤, 许多患者也无法耐受术后的放、化疗, 影响患者生活质量.中医强调与现代医学治疗技术和手段有机结合, 注重机体整体性和系统性的调理, 恢复机体因抗肿瘤治疗过程中所致的整体性功能失调, 降低放、化疗的毒副作用,减少肿瘤的转移和复发, 改善晚期患者生活质量, 延长带瘤生存期[43].另外, 现已有许多中药提取的多糖成分已被证明具有类似于肿瘤生物治疗原理的作用, 如调解免疫、诱导生成抗肿瘤细胞因子、影响肿瘤细胞生化代谢过程等, 从而达到抗肿瘤的作用[44].免疫营养与中医药在DT综合治疗中的具有相似的作用, 免疫营养能改善肿瘤患者营养状况及调节机体免疫和炎症反应, 提高患者接受抗肿瘤治疗后的生活质量, 减少并发症(图1).同时许多免疫营养素与中医药成分一样也可起到抗肿瘤的作用.免疫营养与中医药在DT综合治疗中展现出独特作用, 但其作用机制的复杂性和询证医学证据尚不充分, 使其充满争议.但我们不应该因为争议而忽略了二者在综合治疗中所展现的广阔应用前景.
5 结论
综上所述, 免疫营养与中医药治疗在目前DT综合治疗中都处于一个辅助的地位, 改善DT患者免疫功能、营养状况, 提高了抗肿瘤治疗的耐受性和疗效, 起到“保驾护航”的作用.今后我们的工作应着重围绕免疫营养素和中药提取的多糖成分的作用机制研究以及开展完善的临床试验, 为不同患者提供个体化治疗.相信随着免疫营养和中医药治疗肿瘤的研究不断深入, 必定会促进DT综合治疗的发展, 免疫营养与中医药治疗DT也必定会大放异彩.

