AP/HTPB推进剂表面凝聚相区域燃烧模型 ①
王英男,徐博言,王 革,李冬冬,陈林君
(1.哈尔滨工程大学 航天与建筑工程学院,哈尔滨 150001; 2.北京航空航天大学 能源与动力工程学院,北京 100191)
0 引言
AP/HTPB复合推进剂被广泛用于固体火箭发动机中,但其燃烧过程仍然存在许多问题未解决,如燃速调节问题、无烟/少烟问题、推进剂配方的验证和评估问题等。国外学者对推进剂凝聚相区的化学反应机理研究,也经历了从简单到复杂的历程[1-2],但并未得到详细严密的反应机理。目前,描述AP/HTPB复合推进剂的燃烧模型有Beckstead等[3]提出并被广泛使用的BDP多火焰模型,这一模型通过电镜观测指出,推进剂在任意压强下燃烧时表面均有薄层熔化液,并在熔化液内进行凝聚相反应。Jeppson等[4]在这一模型的假设基础上,采用一维三相模型对推进剂表面燃烧时温度分布,以及燃速-压力关系进行了研究,并得出了凝聚相区的化学反应步骤,但该研究是将气相与凝聚相区域作为一个整体,因而只能得到宏观的温度分布情况,对于凝聚相这一微小区域内的具体反应过程并不清晰。
本文基于Jeppson等[4]的一维三相燃烧模型,探究AP/HTPB固体推进剂凝聚相区的化学反应规律,分析凝聚相区的温度分布、组分分布、不同反应机理的适用性和差异性以及反应相关参数变化对凝聚相区燃烧过程的影响,以弥补已有研究对这一狭小区域的缺失,为解决燃速调节和配方设计问题提供一定的理论支持。
1 物理化学模型和计算方法
1.1 物理化学模型
AP/HTPB推进剂表面凝聚相燃烧模型一般分为物理模型和化学模型两方面,且大多是关于推进剂颗粒大小的二维复杂微观模型,所需的描述方程多、计算量大。为了能够较快得出凝聚相区的温度及组分分布、找出凝聚相区反应的控制因素,本文根据图1所示的一维三相模型,选取其中凝聚相区域进行计算。

图1 Jeppson提出的推进剂燃烧三相模型[4]
由图1可知,推进剂燃烧表面分为3个区域,固相区(预热并可能发生分解)、气液两相区(同时存在蒸发及分解的凝聚相区域)和气相火焰区(发生化学反应的区域)。在固相区内,推进剂被稳态燃烧中传导来的热量预热,温度从初温上升至熔化温度,熔化为液相进入凝聚相区;凝聚相区主要由熔化后的AP和HTPB,以及凝聚相反应产生的气相产物构成。距离固相区越远,化学反应进行越完全,生成的气相产物越多,当凝聚相区域的气泡体积百分数上升至某个限定值后,即认为进入气相区。
化学模型方面,Mike Hawkins计算了不同配方下AP/HTPB推进剂的燃速,并将所采用的凝聚相区内的化学反应都当作一步反应处理。其中,AP含量为80%时,反应机理为
HTPB(l)+41AP(l)→8C4H6+4CO+35H2O+
20HCN+30H2+22CO2+27ClOH+4C2H2+
21NH3+14HClO4
此外,Jeppson也提出了描述AP/HTPB凝聚相反应的8步反应机理:
(1)HTPB1200(l)→HTPB580(l)+3C(s)+H2
(2)HTPB580(l)→10C4H6+C2H3+CH3
(3)HTPB580(l)+15AP(l)→20CO+10HCN+
13CH4+32H2O+8ClO+7Cl+5N
(4)HTPB580(l)+20HClO4→8CO+24CO2+
24H2O+20HCl+5C2H2+CH4+2H2
(5)AP(l)→NH3+HClO4
(6)AP(l)→H2O+O2+HCl+HNO
(7)AP(l)→H2O+Cl+NO2
(8)AP(l)→ClO3+NH3+OH
由于AP/HTPB推进剂表面燃烧过程十分复杂,因此需要对物理化学模型做一些必要的简化,本文所作假设如下:
(1)推进剂不同组分熔化温度为定值;
(2)单个组分的热导率视作常数;
(3)液相物质移动速度与燃面推移速度相等;
(4)化学反应为基元反应;
(5)液相组分与气泡中气相组分温度相等;
(6)推进剂中AP与HTPB预混充分,不考虑其颗粒大小;
(7)仅考虑液液反应和液气反应。
1.2 计算方法
一般认为AP/HTPB推进剂固相区域不发生反应,该区域的求解在凝聚相区之后,其计算结果并不影响模型的其他部分。固相推进剂熔化时,组分会蒸发或分解成气相和液相组分,气相组分在该区域中形成气泡,从而形成一个多气泡的两相区,该区域即为凝聚相区。其中,气泡含量用空化比φ(即气相物质的体积分数)来表示。由于这一区域太薄,或直到其他区域计算完成才能够得到其边界条件,因此许多推进剂燃烧模型忽略了该区域。
在凝聚相区任一位置x,在微元长度dx内,能量变化可通过一维导热微分方程表示为
(1)
(2)
(3)
(4)

于是,可导出温度与各凝聚相反应生成物生成率的关系式为
(5)
(6)

凝聚相区内的气液两相物质总体质量守恒为
(7)
(8)

根据阿累尼乌斯方程,反应速率常数ka可表示为
(9)
式中A为指前因子;T为温度;β为温度指数;Ea为反应的活化能;R为通用气体常数。
根据文献[4]假设,反应中有“液相-液相”反应及“液相-气相”反应。对于液相反应:
fF+gG→prodicts
(10)
由质量作用定律可得
(11)
式中X为液相物质的质量分数;f和g分别为反应物F和G在反应中的化学计量数。
在“固相-凝聚相”这一相变位置设置初始边界条件T(0)=Tmelt,Tmelt为熔化温度;φ=0作为固相区与凝聚相区的界面划分条件。同时,根据导热微分方程,可得:
(12)

在凝聚相区域内,液相组分反应生成气相物质,距离“固相-凝聚相”表面越远,反应越完全,空化比φ(气相物质的体积分数)就越大。当空化比φ达到95%时,便认为进入气相区域,即φ=0.95为凝聚相区与气相区的判定条件。本文所采用的初始条件及边界处判定条件如表1所示。

表1 初始条件及边界条件设定
2 计算结果与讨论
2.1 网格无关性验证结果
假设推进剂初温为300 K,熔化温度为450 K,初始质量流量为1.09 kg/s,初始压强0.97 MPa,凝聚相区进入气相区的空化比上限为0.95,AP/HTPB初始含量比例为0.8/0.2。在温度梯度较大区域采用网格自适应进行局部加密,从而更准确捕捉凝聚相区与气相区的交界面位置。分别选择网格节点数为1200、1800、2400进行网格无关性验证,得到三种情况下的温度分布、空化比分布以及AP质量分数分布如图2所示。
由图2可看出,不同网格节点数下的温度分布、空化比分布及AP质量分数分布曲线相差极小。因此,可判定计算结果与网格节点数无关。
2.2 一步反应和多步反应的比较分析
假设Mike Hawkins所提出的1步反应机理为机理A,Jeppson M B提出的8步反应机理为机理B,通过计算可得两种反应机理下推进剂稳态燃烧时凝聚相区的温度分布以及两种初始组分质量分数的变化情况如图3所示。
图3和图4的横轴为凝聚相区内某位置与固相区的距离,图4(a)和图4(b)分别为凝聚相区中反应物AP和HTPB的绝对质量分数变化情况。气相产物生成速率和凝聚相区厚度受不同反应机理影响,由图3可看出,机理A相比机理B计算得到的凝聚相区厚度更大,说明采用机理A反应生成气相产物的速率更缓慢,导致空化比在距离固相表面更远的位置才达到上限。而在一维空间上,两种机理计算得到的温度分布几乎相同,这是由于推进剂分解产生的物质会向气相区移动,且化学反应主要集中在远离凝聚相区的气相区,因此凝聚相区中温度分布受气相区中传递过来的温度影响较大。由图3可看出,温度随着凝聚相区厚度增加,逐渐靠近气相区而逐渐升高,但从中也发现不同反应机理下温度分布相差极小。

(a)温度分布

(b)空化比分布

(c)AP质量分数分布

图3 不同机理下温度分布对比

(a)AP绝对质量分数分布

(b)HTPB绝对质量分数分布
由图4可看出,采用机理A时,两种推进剂组分在液相中的变化趋势相同,AP的绝对质量分数从初始的0.8下降至0.04左右,HTPB的绝对质量分数从初始的0.2下降至0.01左右,反应前后二者的绝对质量分数之比相同,说明采用该反应机理,两种推进剂组分作为反应物被消耗的速率是等比例的。而当采用机理B时,两种液相组分的质量分数变化较大,AP的质量分数从0.8下降至接近于0,HTPB从0.2下降至0.047左右,且AP消耗时HTPB质量分数变化较小。由此可知,在该机理下,AP作为反应物的消耗速率较快,HTPB的消耗速率较慢,从而导致它们的质量分数之比偏离了原有配方中的比例。分别采用两种机理计算得到的凝聚相区末端产物中气相组分的质量分数如表2所示。

表2 不同反应机理下凝聚相区中气相组分的含量
由表2可知,不同生成物的含量相差很大,说明反应机理对预测反应生成的气相组分含量影响明显。从最终气相物质总质量分数来看,机理A计算得到凝聚相区终点处还有大约23%的液相组分(AP和HTPB);而由机理B计算得到凝聚相区终点处液相组分几乎消耗完全。结合图4液相组分的质量分数变化情况,不难得出,采用机理A时各组分几乎等比例消耗,但在凝聚相区反应不完全,有相当一部分还需要到气相区中继续反应消耗;而在机理B中,AP与HTPB在凝聚相区消耗趋于完全,但并未按照配方比例消耗,其中HTPB有剩余。由以上可知,两种反应机理的模拟计算结果有较大差异,说明这两种现有的反应机理的准确性仍有待验证。
2.3 多步反应过程分析
根据采用机理B计算得到的组分分布对凝聚相区的化学反应过程进行分析,选取凝聚相区中几种有代表性的气相生成物质量分数变化曲线见图5。
由图5可知,在机理B下,各组分含量在几个固定位置发生明显变化,如1、5、10.5、11.5 μm处。且由机理B可知,每种组分所在的反应,通过分析可得到这些位置由哪些反应占据主导。
在1 μm处质量分数发生变化的组分有H2O、NH3、HClO4、NO2、ClO3和H2。由NH3(c)和HClO4(d)质量分数变化可知,反应(5)在此处占主导作用;同理,由NO2(h)和ClO3(i)质量分数变化得知,反应(7)和(8)在此处占主导作用;而H2O(b)的质量分数变化可能受反应(3)、(4)、(6)中的一个或多个影响,但CO(e)和HCN(f)的质量分数曲线在此处无变化,因此可判断与反应(3)、(4)关系不大,故H2O(b)含量变化只可能由反应(6)引起;此外,H2(a)在此处质量分数也发生变化,根据反应的先后顺序可知,反应(1)必然先发生,因此为反应(1)的影响。总结以上各个组分的质量分数变化可得,在距离固相区较近位置(1 μm)由反应(1)、(5)~(8)主导。
在5 μm处质量分数发生变化的有H2O、CO和HCN。首先,可根据HCN(f)质量分数发生变化判断反应(3)一定起重要作用。将HCN与CO(e)的变化情况对比,可发现曲线走势基本相同,可知反应(4)对该区域影响不大。最后,观察与反应(6)相关的O2(g)发现,在此处其质量分数无明显变化,可认为反应(6)在此处无显著影响。因此,在凝聚相区中前部区域(5 μm处),可认为反应(3)占主导地位,产物也大多由该反应生成。
在10.5 μm处斜率发生变化的有H2O、CO、HCN、C4H6和H2。前三者与反应(3)相关且质量分数均先增加后减少,其中HCN(f)只存在于反应(3)中,H2O(b)和CO(e)在该位置质量分数变化趋势一致,因而可判断反应(6)影响较小。C4H6(j)只与反应(2)相关,在该区域其含量大幅增加,根据前文分析,H2(a)的变化必然由反应(4)引起。因此,可认为10.5 μm处由反应(2)、(4)主导。
在11.5 μm处,由NH3(c)和HClO4(d)质量分数下降,且两者在所有反应中均无消耗,可判断由于反应(2)、(4)产物的大幅增加。相对而言,NH3质量分数减小。结合图4(a)可知,AP在该位置消耗完全,反应(5)完全消失,其生成物NH3、HClO4含量下降,而H2、C4H6含量继续大幅上升。因此,可认为在靠近气相区(11.5 μm处)继续由反应(2)、(4)主导,汇总以上各区域主要反应见表3。

(a)H2的质量分数 (b)H2O的质量分数 (c)NH3的质量分数

(d)HClO4的质量分数 (e)CO的质量分数 (f)HCN的质量分数

(g)O2的质量分数 (h)NO2的质量分数

(i)ClO3的质量分数 (j)C4H6的质量分数

表3 凝聚相区不同位置处的主导反应
从宏观上看,(1)、(5)~(8)分别为HTPB分解反应、AP分解反应及AP直接分解为凝聚相区最终产物的反应,这些反应发生在凝聚相区与固相区相近的位置,且发生较早。(2)~(4)反应分别为HTPB分解产物的分解反应、HTPB分解产物与AP反应、HTPB分解产物与AP分解产物反应,主要发生在距固相区表面较远的位置。因此,认为反应发生时间较晚。
综上得到了AP/HTPB推进剂燃烧时凝聚相区各组分的演化过程为,AP及HTPB首先发生分解反应,其中AP分解为NH3和HClO4,并有部分AP直接分解为凝聚相区最终产物;随后,HTPB的分解产物(HTPB580)与AP发生重要反应,直接生成凝聚相区最终产物CO等;AP反应消耗完全后,剩余的HTPB分解产物(HTPB580)自我分解,并与HClO4反应生成最终产物CH4等。值得注意的是,在某一区域内由某个反应主导并不意味着其他反应完全消失,非主导反应仍可能以相对较小的速率继续发生。
2.4 凝聚相区燃烧相关参数分析
考虑实际需求,为了更全面研究AP/HTPB推进剂表面凝聚相燃烧的规律,基于Matthew W Tanner的凝聚相反应机理(机理A),通过调整反应初始条件和相关参数来寻找规律。
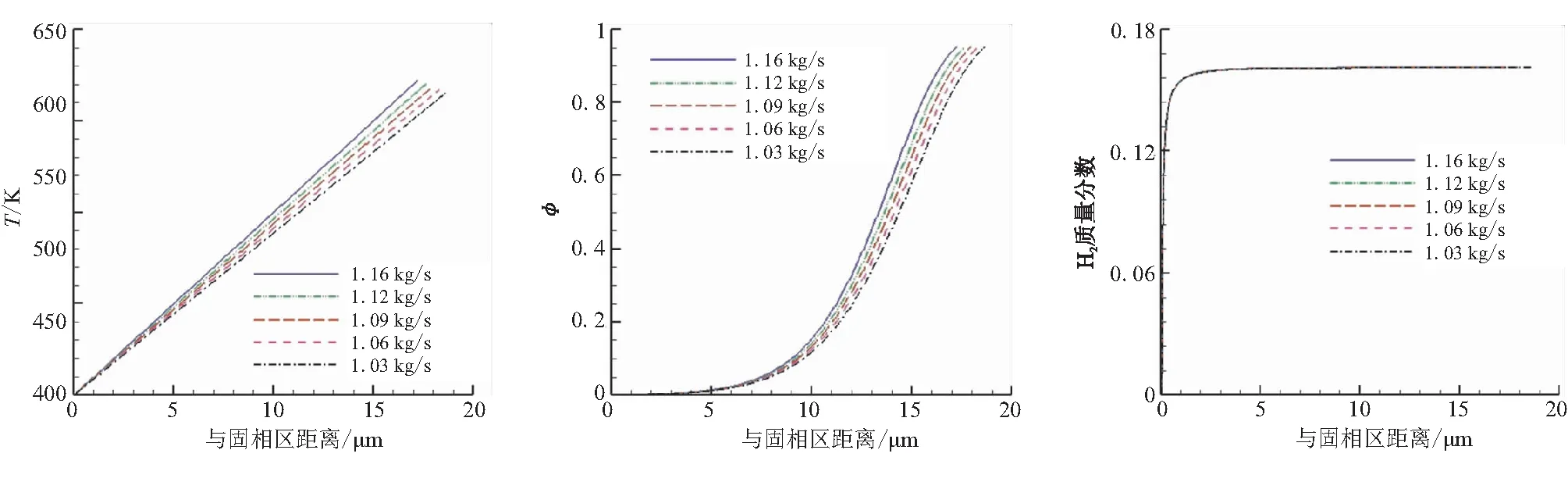
(a)不同质量流量下的温度分布 (b)不同质量流量下的空化比分布 (c)不同质量流量下H2的质量分数变化
由图6(a)可看出,随着质量流量增大,凝聚相区温度梯度变大,厚度减小。温度梯度增大是由于在不同质量流量情况下,温度梯度较大时,凝聚相区域内距离“固相-凝聚相”界面相同距离处的温度就会越高,反应速率常数ka变大,反应速率加快,进而导致凝聚相区厚度减小。
由图6(b)、(c)可知,质量流量改变对空化比分布及以H2为代表的生成物组分的质量分数无明显影响,因此只能得到凝聚相区厚度减小这一结论,与由图6(a)得出的结论相同。
接着分析压强对凝聚相区燃烧过程的影响。推进剂燃烧时,压强变化会影响气体组分浓度,进而对反应速率产生较大影响,对气相化学反应影响显著。在凝聚相区中可看作发生一个可逆的、由液相组分生成气相组分的如下反应。
HTPB(l)+41AP(l)8C4H6+4CO+35H2O+20HCN+30H2+22CO2+27ClOH+4C2H2+
21NH3+14HClO4
可通过改变压强,观察其对凝聚相区燃烧过程的影响。由于缺乏压强对推进剂燃烧影响大小的量级概念,参考Tanner W在研究AP、GAP和HMX推进剂燃速时,将压强范围设置为1~1000 atm。于是,将压强分别设置为1、10、100、1000 atm,从而得到了不同压强下空化比分布曲线以及H2和H2O的质量分数变化曲线如图7所示。通过对比得到不同压强下凝聚相区的厚度如表4所示。

(a)空化比分布 (b)H2质量分数分布 (c)H2O质量分数分布
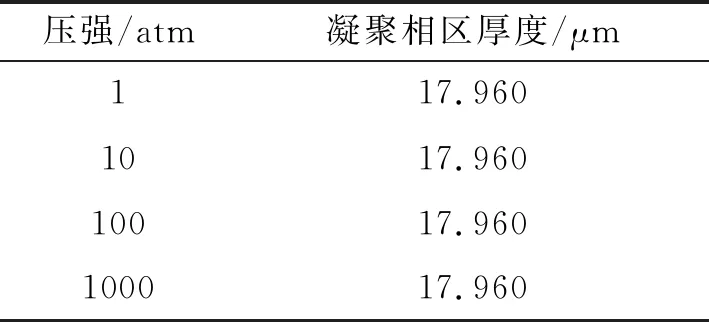
表4 不同压强条件下凝聚相区厚度
由图7可看出,不同压强条件下空化比的一维空间分布几乎重合,两种生成物组分的质量分数分布也看不出明显区别。由表4可了解到,在、10、100、1000 atm四种压强条件下,凝聚相区的厚度几乎不变。由此可知,逆反应速率变化对整个凝聚相区计算结果的影响极小,在该反应中逆反应可不予考虑。
最后研究Al粉含量对燃烧过程的影响。在反应机理中并未含有Al,一般来说由于温度不足,Al的相关反应主要发生在距离凝聚相区较远的气相区,Al在凝聚相区内只吸收热量,发生物理变化。通过计算观察不同含量Al粉对凝聚相区温度、比热容等参数的影响,得到了Al粉质量分数分别为0和0.05时凝聚相区温度分布及比热容分布如图8所示。

(a)温度分布对比 (b)定压比热容分布对比
图8不同Al粉含量的计算结果对比
Fig.8Comparison of the calculation results of different Al mass fractions
由图8(a)可了解到Al粉的加入将凝聚相区厚度提高了一个数量级,且温度梯度较不含Al粉时降低,凝聚相区末端温度更高。其中,凝聚相区厚度的大幅增加主要归因于Al粉的加入降低了反应物的质量分数,而衡量凝聚相区厚度的关键物理量——空化比φ源于气体的生成量。由式(11)知,气体生成率与质量分数成指数关系,质量分数作为底数,导致气体生成率降低了一个量级,进而导致空化比上升缓慢,凝聚相区厚度增大。
根据式(17)可知,温度梯度的减小是由于热导率和比热容的变化所导致。对于热导率λ,加入Al粉无疑会使其增大;而对于比定压热容cp,由于一般情况下液相物质的热导率远大于气相热导率,因此可将液相热导率视为总热导率。由图8(b)可知,添加Al粉使得推进剂比热容有所降低,热导率的升高和比热容的降低便导致了图8(a)中温度梯度降低。
3 结论
(1)Hawkins的一步反应机理和Jeppson的8步反应机理均预测凝聚相区的温度分布趋于线性。
(2)在凝聚相区与气相区交界面处,两种机理对各组分含量的预测区别较大。Hawkins的一步反应机理预测AP和HTPB在该位置还剩余约23%未反应,但在凝聚相区中二者几乎等比例消耗;而Jeppson的8步反应机理预测AP和HTPB在该位置反应完全,但两者不是等比例消耗,其中HTPB有残余。
(3)通过分析Jeppson 8步反应机理的计算结果,可将推进剂在凝聚相区域的化学反应过程大致分为三个阶段:首先,发生AP及HTPB自身的分解反应,生成凝聚相区最终产物NH3以及HTPB580等;随后,AP与HTPB580之间的反应开始占据主导,反应生成凝聚相区最终产物CO等;最后,剩余的HTPB580发生分解,并与AP的分解产物HClO4反应生成最终产物CH4等。
(4)通过参数化分析发现,凝聚相区质量流量增加会引起凝聚相区温度梯度上升,反应速率加快,凝聚相区厚度变薄,且该区域凝聚相物质反应的平衡常数很大,逆反应速率非常小,因而逆反应对该区域影响非常小;在AP/HTPB推进剂中加入Al粉会使液相物质的平均比热容降低,使AP/HTPB质量分数下降,进而导致反应速率大幅下降,凝聚相区域明显变厚。

