神经电生理监测结合神经导航技术切除脑干胶质瘤效果观察
郑永
脑干胶质瘤(brainstem glioma,BSG)是发病率最高的脑干肿瘤,占颅内肿瘤发病人数的1.4%~2.4%,占同期脑干占位性病变的一半以上[1]。BSG的治疗方法主要以手术治疗和放化疗为主。传统手术通常以磁共振成像(MRI)数据辅助神经导航或者应用传统显微技术切除肿瘤,难以满足临床需求[2]。随着神经电生理监测及神经导航技术的发展,越来越多的BSG患者采用神经导航技术切除瘤体,但脑漂移、瘤内减压及脑组织水肿仍不可避免的对神经导航术中的准确性产生影响,且该技术对患者术后的日常生活功能、术后并发症等方面的影响尚未可知[3]。本研究采用临床对照研究的方式,比较传统颅脑显微技术与神经电生理监测结合神经导航技术对BSG切除术后日常生活功能及并发症等方面的影响,报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月至2017年12月解放军总医院第三医学中心收治的118例BSG患者,纳入标准:① 年龄40~60岁;② 经MRI检测属于局限性BSG;③ 卡氏(Karnofsky,KPS)评分≥60分,预计生存期>3个月;④ 术后分子病理诊断为IDH-1突变型;⑤ 对本研究知情同意并签定同意书。排除标准:① 精神异常及无法正常沟通者;② 继发性颅内肿瘤者;③ 存在远处转移病灶;④ 研究期间中断治疗或失访者。本组118例BSG患者中68例采用神经电生理监测结合神经导航技术(研究组),50例采用传统颅脑显微技术(对照组),两组患者的性别、年龄、术前KPS评分、肿瘤最大直径、肿瘤部位、Ki-67<5%的比例差异均无统计学意义(P>0.05),具有可比性(表1)。本研究经医院伦理委员会审议通过,符合赫尔辛基宣言。
表1 研究组与对照组的临床资料比较

临床资料对照组(n=50)研究组(n=68)χ2/t值P值 性别(男/女,例)32/1842/260.0620.804 年龄(岁,x±s)44.3±5.444.5±5.60.2330.816 术前KPS评分(分,x±s)64.32±14.0664.29±14.320.0110.991 肿瘤最大直径(mm,x±s)33.28±2.1333.32±2.160.1000.921 肿瘤部位 [例(%)]0.0890.956 中脑9(18.0)8(11.8) 桥脑30(60.0)40(58.8) 延髓11(22.0)20(29.4)Ki-67<5% [例(%)]49(98.0)66(97.1)<0.0011.000
1.2 手术方法
1.2.1 对照组 将患者术前行MRI检查所显示的肿瘤位置数据导入神经导航Medtronic S7系统,制定多模态融合三维示意图,明确患者病灶位置及病灶周围功能区的结构。采用传统手术入路方式,即正中入路、枕下乙状窦后入路、颞下入路、远外侧入路等针对手术部位予以传统显微技术切除肿瘤。
1.2.2 研究组 把MRI及弥散张量成像(DTI)数据导入神经导航计划工作站,进行颅脑三维图像分析及重建工作,对肿瘤的形态和部位进行勾画,明确患者BSG的部位及大小,展示纤维束形态、完整性及纤维束与患者肿瘤的位置关系。术中麻醉后采用Mayfield头架固定患者头部,然后安装Brainlab参考球架,运用导航棒和Z-touch激光双重注册方式注册,将导航信息整合于手术显微镜中。患者手术入路方式选择与对照组一致。在应用神经导航技术过程中进行神经电生理监测(Cadwell Cascade),其电流控制在5~10 mA,自低电流开始逐渐升高电流,以引发患者肢体动作为依据,一般在6 mA为宜,刺激双极间距离为5 mm。分别于肿瘤切除过程中、术中打开骨瓣时加以应用。在肿瘤切除时进行大脑皮层下电刺激,及时予以脑棉片保护及激素冲击。在打开骨瓣后,停止吸入肌松药等麻醉药物,降低患者应用麻醉药物造成的电生理监护的干扰。主要监测指标为脑干听觉诱发电位(brainstem auditory evoked potential,BAEP)、体感诱发电位(somatosensory evoked potential,SEP)、运动诱发电位(motorevoked potential,MEP)、肌电图(electromyography,EMG),以释放脑脊液后切除肿瘤前的记录为基线资料。神经导航技术手术过程中,利用导航探针找寻肿瘤部位及距离脑干皮质最薄弱处,切除肿瘤过程中注意避让重要的纤维束和功能区,以进针的深度判断切除程度及范围,减少对正常脑干组织细胞的损伤。
两组患者手术后均采用伽玛刀同步放疗及化疗方案治疗,术后应用卡莫司汀注射液(天津金耀药业有限公司,国药准字H12020992),用法用量参照说明书。
1.3 随访
于术后次日复查患者头颅MRI,确定肿瘤切除程度,并复查DTI以确定术后白质纤维素的位置。于术后6个月复查确定患者术后临床疗效,随访24个月确定患者术后生存时间。
1.4 观察指标
1.4.1 手术情况指标 采集患者手术时间(患者自麻醉开始至手术结束时间)、术后住院时间(患者自手术结束至术后正常出院时间)、术后生存时间(患者自手术结束至随访结束或死亡的生存时间)、术后并发症及死亡情况。
1.4.2 临床疗效指标 观察患者的肿瘤切除程度,统计完全切除、次全切除、部分切除患者数,并依据高级别胶质瘤的治疗反应评价标准(RANO标准)进行评价,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)4个层面[4],见表2。
表2 RANO标准

项目CRPRSDPD 新增病灶未见未见未见可见 皮质激素应用无需稳定或减少稳定或减少- 临床表现稳定或改善稳定或改善稳定或改善恶化 T1+增强未见缩小≥50%缩小25%~50%增加≥25% T2/FLAIR稳定或减小稳定或减小稳定或减小增加 判断标准所需条件以上全部以上全部以上全部以上任意一项
CR:完全缓解;PR:部分缓解;SD:稳定;PD:进展
1.4.3 日常生活及生存质量恢复情况 于术前及术后6个月对患者的日常生活活动(activity of daily living,ADL)进行评分,<20分为生活完全依赖,20~39分为需要较大协助生活,40~60分为需要部分协助生活,>60分为基本生活自理,分数越高生活能力越好;同期评估患者KPS评分,得分越高说明患者健康状况、生存质量越好。
1.5 统计学方法
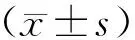
2 结果
2.1 两组患者手术相关情况比较
研究组的手术时间和术后住院时间短于对照组,术后无进展生存期长于对照组,差异有统计学意义(P<0.05),见表3。


组别n手术时间(min)术后住院时间(d)无进展生存期(月) 对照组50338.26±76.2319.26±5.769.73±5.28 研究组68282.16±56.2312.14±5.2612.38±4.19 t值4.6036.9783.039 P值<0.001<0.0010.003
2.2 两组患者肿瘤切除程度及临床疗效比较
研究组的肿瘤切除程度及临床疗效显著优于对照组,差异有统计学意义(P<0.05);两组患者的病死率差异无统计学意义(P>0.05),见表4。
表4 两组患者肿瘤切除程度及临床疗效比较 [例(%)]

指标对照组(n=50)研究组(n=68)Z/χ2值P值 肿瘤切除程度3.1910.001 部分切除15(30.00)5(7.35) 次全切除4(8.00)4(5.88) 完全切除31(62.00)59(86.76) 临床疗效2.6150.009 CR15(30.00)32(47.06) PR12(24.00)19(27.94) SD10(20.00)12(17.65) PD6(12.00)0(0.00) 死亡7(14.00)5(7.35)1.3940.238
CR:完全缓解;PR:部分缓解;SD:稳定;PD:进展
2.3 两组患者术前及术后的日常生活及生存质量变化比较
两组患者术前ADL及KPS评分差异均无统计学意义(P>0.05);术后6个月,两组的ADL及KPS评分均显著高于术前,且研究组高于对照组,差异均有统计学意义(P<0.05),见表5。
2.4 两组患者生存时间比较
研究组中位生存时间14个月,死亡8例(剔除围术期死亡5例);对照组中位生存时间10个月,死亡15例(剔除围术期死亡7例),研究组的生存时间显著优于对照组(χ2=4.345,P=0.037),见图1。
2.5 两组患者术后并发症发生率比较
研究组术后总并发症发生率及具体每一种并发症的发生率均低于对照组,差异有统计学意义(P<0.05),见表6。

图1 两组患者K-M生存曲线比较


组别nADL评分KPS评分 术前术后6个月t值P值术前术后6个月t值P值 对照组5045.26±5.7253.62±3.268.979<0.00165.49±14.1275.68±10.264.128<0.001 研究组6845.34±3.7679.63±1.2671.306<0.00165.64±13.4390.38±5.7213.976<0.001 t值0.09260.0470.0599.912P值0.927<0.0010.953<0.001

表6 两组患者术后并发症发生率比较 [例(%)]
3 讨论
BSG属于中枢神经系统肿瘤,其诊断分型困难,手术切除效果差异较大,放射治疗效果不佳。成人BSG多位于桥脑,也被称为弥漫内生型桥脑胶质瘤。随着荧光原位杂交、微卫星分析等前沿新技术的应用增多,适合BSG患者的早期筛查技术逐渐增多,患者生存时间逐渐延长[5]。但手术方式仍以神经导航定位技术应用较为广泛。
神经电生理监测涉及术中脑电图、肌电图、诱发电位等多个环节[6]。BSG手术部位位于神经功能区,在手术过程中对神经功能区的损伤程度直接影响了患者术后的生存质量及神经功能。由于脑干前方有斜坡及岩骨尖阻挡,背部存在小脑覆盖,其上方的小脑幕及静脉窦环绕在脑干周围,这些解剖因素致使BSG手术切除的难度及精度需求高[7]。虽然神经导航技术能够有效切除病灶,提升手术精确度,降低术中损伤。但是在神经导航技术应用过程中,在临近脑干区域进行手术操作,患者容易出现诱发电位,而神经电生理监测能够有效预测患者术中神经功能状态,对手术具有指导意义[8]。本研究发现研究组患者的手术时间、术后住院时间显著低于对照组,术后无进展生存期显著高于对照组,提示神经电生理监测结合神经导航技术能够有效减少手术时间和住院时间。而传统的显微技术下手术需要多次对肿瘤部位进行观察,且手术切除步骤繁琐,手术时间及住院时间势必有所延长。
BSG手术中的主要监测指标有BAEP、SEP、MEP、EMG,BAEP监测听觉传导通路,起到预警进性延长波幅下降的作用。SEP用以监测并评估感觉通路的完整性。MEP作为运动神经传导系统功能及波形突然消失的预警指标。EMG属于脑神经和椎体束功能及肌电增多的监测指标,还是患者出现爆发性肌肉收缩的预警指标[9]。通过及时有效的神经电生理监测能够及时阻止神经导航手术过程中对神经的不必要损伤,降低神经损伤程度,提高临床疗效。本研究发现研究组的肿瘤切除程度及临床疗效显著优于对照组,且术后的并发症发生率更低,提示采用神经电生理监测结合神经导航技术能够有效改善患者肿瘤切除程度及临床疗效,降低并发症发生风险,这与桑树山等[10]的研究结果一致。但由于BSG的手术部位隐匿,手术风险大,术中及术后短期病死率仍较高,临床手术过程中需要严格把握手术适应证,降低术中脑组织损伤的风险。未来随着对BSG病理生理的进一步认识,必将出现更有效的手术方式,进一步减少围术期死亡率。
有研究发现通过神经电生理监测技术辅助神经导航技术,BSG患者的神经损伤程度显著降低,有效避免了患者发生永久性神经功能障碍[11]。因为用于监测脑胶质瘤术后神经损伤的指标较少,ADL、KPS能有效反映脑胶质瘤患者术后神经功能恢复情况及生存质量,因此本研究以ADL、KPS作为患者神经功能及生存质量的主要观察指标,结果显示研究组患者术后6个月的ADL及KPS评分均显著高于对照组及本组术前,提示神经电生理监测结合神经导航技术能够有效改善患者的神经功能及生存质量。
神经电生理监测结合神经导航技术能够更直观地展示BSG、白质纤维束及周围脑组织情况。结合动态观测和实时导航,在切除患者肿瘤组织过程中,更好的保护了白质纤维束及周围生命中枢组织。且神经电生理监测弥补了导航系统不能实时反映脑神经及其核团和锥体束等功能的不足,另外,神经导航和DTI可帮助电生理监测缩小监测范围,降低监测难度,使得重建DTI与脑皮层功能成像(BOLD)的投影相符程度更高,而且能有效避免神经导航术中产生脑漂移所造成的诊断误差。有研究提出胶质瘤预后的影响因素为WHO分级及KPS评分[12],而WHO分级属于患者固定的影响因素。本研究中的研究组患者手术后肿瘤切除程度更全面,KPS评分更高;而无进展生存期及生存时间是肿瘤患者预后的主要评价指标。因此,神经电生理监测结合神经导航技术能够有效改善患者预后,继而改善患者无进展生存期及生存时间。
综上所述,神经电生理监测结合神经导航技术用于BSG切除能够有效缩短手术时间,改善肿瘤切除程度,缩短术后住院时间,提高患者神经功能恢复程度、延长患者无进展生存期及生存时间,改善患者预后及生存质量。

