利用RT-qPCR技术筛选菊黄东方鲀的最适内参基因
蒋彩云,乔 琨,许 旻,熊 静,刘智禹,3*,黄文树,3*
(1.集美大学水产学院,福建 厦门 361021;2.福建省水产研究所,福建省海洋物增养殖与高值化利用重点实验室,福建 厦门 361013;3.福建省海洋生物资源开发利用协同创新中心,福建 厦门 361021)
逆转录(Reverse transcription,RT)与定量PCR(quantitative PCR,qPCR)相结合可快速分析大量样本,具有较高的灵敏度和特异性,成为基因表达水平测定最常用的方法[1]。该方法是首先将目的基因的mRNA逆转录成互补DNA(cDNA),再通过RT-qPCR测定cDNA的相对或绝对数量。为消除或减少由于样品而产生的差异,如RNA数量和质量的差异,需要采用内参基因对目的基因的cDNA量进行归一化[2]。因此,样本间内参基因的稳定性是RT-qPCR检测准确性的关键。
理想的内参基因在个体、组织、细胞、所有发育阶段以及不同的实验条件下均恒定表达[3]。研究发现管家基因表达水平受环境因素影响较小,而且是在个体各生长阶段的大多数,或几乎全部组织中持续表达,或变化小。目前已报道的管家基因有数百种之多,其中β-actin、18SrRNA(以下简写18S)、EF1-α和GAPDH常用作内参基因。然而,已有研究结果表明,在所有组织、发育时、生理条件下均稳定表达的理想内参基因并不存在[4],因此,有必要根据研究,选择不同的内参基因。
目前,对人、鼠、猪、羊、鸡等动物的内参基因稳定性已有相关的报道[5],而对鲀科鱼类的内参基因的稳定性研究甚少。近年来,对鲀科鱼类的分子免疫学、毒性、生理发育以及毒素刺激相关的研究越来越多[6-8]。在这些研究中,相对定量PCR是目前比较常用的mRNA表达水平检测方法,目前内参基因在特定实验条件下表达的稳定性并没有被验证。所以对于不同的实验体系,必须进行最适内参基因的筛选,以减少实验的误差。菊黄东方鲀(Takifuguflavidus)隶属于鲀形目、鲀科、东方鲀属,是一种重要的经济鱼类。本实验以养殖菊黄东方鲀的三个发育阶段(3月龄、6月龄和12月龄),以及成鱼养殖和野生菊黄东方鲀的12个组织(肾、肠、胃、脾、肝脏、鳔、心脏、鳃、皮肤、肌肉和性腺等)为研究对象,利用geNorm软件、NormFinder软件和BestKeeper软件分析了β-actin、GAPDH、EF1-α和18S四个管家基因在不同发育阶段不同组织中表达的稳定性,以此筛选出最合适的内参基因。
1 材料与方法
1.1 实验材料
养殖菊黄东方鲀购自漳州市漳浦县和大径河鲀养殖场,野生成年菊黄东方鲀捕自台湾海峡。不同发育阶段的菊黄东方鲀规格见下表1。

表1 采样表
1.2 总RNA提取及cDNA合成
使用0.01%丁香油水门汀麻醉菊黄东方鲀后解剖并取样(每个发育阶段样品分别取自6条鱼),取肾、肠、胃、脾、肝脏、鳔、心脏、鳃、皮肤、肌肉和性腺等12个组织,每个组织取约100 mg,剪成厚度小于0.5 cm的小块放入2 mL RNase free 管中,加入1 mL RNAstore Reagent(TIANGEN,北京天根)试剂,4℃过夜后放入-20℃或-80℃保存备用。使用动物组织总RNA提取试剂盒(TIANGEN,北京天根)抽提总RNA,1.2%琼脂糖凝胶电泳检测RNA的完整性,Infinite M200 PRO酶标仪(TECAN,瑞士)测定RNA浓度及纯度。
每份组织取4 μg总RNA按照TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒(TRANS,北京全式金)说明书反转录合成cDNA第一链。得到的cDNA样本,使用内参基因EF1-α定量引物对cDNA质量进行半定量验证,反应体系10 μL,包括2×Master Taq Mix(TAKARA,日本)5 μL,正反向引物(10 μM)用量各0.5 μL,模版用量0.5 μL,超纯水3.5 μL。在PCR仪上进行扩增,反应程序:94℃、4 min,(94℃、30 s,60℃、30 s,72℃、30 s)×25 cycles,72℃、10 min。PCR结束后,对反应产物进行琼脂糖凝胶电泳。将质量好的cDNA样品置于-20℃保存待用。
1.3 引物设计和标准曲线的建立
在NCBI数据库中,搜索已登录的红鳍东方鲀、暗纹东方鲀等的β-actin基因序列,在菊黄东方鲀基因组序列(Takifuguflavidus,GenBank:GCA_000400755.1)中BLAST检索相似度高的基因序列。利用Softberry软件预测出mRNA序列,再利用Primer 5.0软件,设计跨内含子的定量引物,命名为β-actin-F和β-actin-R。EF1-α、18S和GAPDH的引物设计步骤参照上述β-actin。引物相关信息见表2。

表2 RT-qPCR的内参基因引物序列信息表
注:登录号来自NCBI数据库。
Note:Accession number came from NCBI database.
将含有目的基因(β-actin、GAPDH、EF1-α和18S)DNA片段的质粒(107拷贝/μL)作为标准品,用超纯水进行10倍梯度稀释至102拷贝/μL,以此6个浓度的标准品进行qPCR扩增以获得各浓度标准品的Ct(Cycle threshold)值。以标准品浓度的对数为横坐标,对应的Ct值为纵坐标建立标准曲线。Ct值使用Light cycler 96软件(软件版本1.0)调用,从标准曲线的斜率确定每个样本的PCR效率和相关系数(R2)。计算公式:E=10-1/m,其中m为标曲斜率,E为扩增效率。qPCR的可接受E值在1.9~2.1之间[9]。并通过熔解曲线分析确定PCR产物的特异性。
1.4 实时荧光定量PCR
采用LightCycler 480 SYBR Green I Master(Roche,德国)和Roche LightCycler 96 Real-time PCR仪(Roche,德国)在96孔板上进行PCR反应。反应体系:2×SYBR Green I Master 10 μL,cDNA模板(浓度为0.2 ng/μL)用量4 μL,β-actin、EF1-α、GAPDH和18SrRNA正反向引物(10 μM)各1 μL,补充超纯水至20 μL。qPCR程序:95℃、10 min,(95℃、10 s,60℃、10 s,72℃、10 s)×45 cycles,在延伸阶段检测荧光强度收集信号;熔解曲线程序(95 ℃、10 s,65 ℃、60 s,97 ℃、1 s),每个样品设3个重复,取平均值进行分析。每次运行包括一个阴性对照,以检测反应体系是否污染。所有样品稀释1 000倍。
1.5 数据分析
在geNorm分析中,根据geNorm指令,将原始Ct值转换为相对表达量:2-△Ct,其中△Ct=所有样品Ct值-最小Ct值[9]。geNorm程序通过计算出每个内参基因稳定性的M值来筛选出稳定性最好的内参基因,判定标准为M值越小,内参基因稳定性越好,反之,则稳定性越差[10]。NormFinder分析时数据前处理同geNorm,先获得内参基因表达稳定值,再根据稳定值大小来筛选最合适的内参基因,判定标准为表达稳定值最小的内参基因为最适的内参基因[11]。BestKeeper软件可以直接计算Ct值的原始数据,而不用转换为相对表达量[12],判定原则为标准偏差(SD)和变异系数(CV)越小,内参基因稳定性越好,反之,稳定性越差;此外,如果SD值大于1,则认为它不能作为内参基因[13]。最后采用Su等的加权赋值方法[14],给每种分析方法中每个基因的表达稳定性赋值,最稳定为1分,其次依次为2、3、4分,然后把每个基因所得分数相加进行重新排序,分数越小越稳定。
2 结果
2.1 总RNA和cDNA质量鉴定
Infinite M200 PRO酶标仪检测不同组织(肾、肠、胃、脾、肝脏、鳔、心脏、鳃、皮肤、肌肉和性腺等)样品总RNA的OD260/280,结果为(2.0±0.2),表明其纯度高。用1.2%琼脂糖凝胶对所提取的总RNA进行电泳,并使用Quantity One软件分析其完整性,结果发现所有样品28S的条带亮度约为18S的两倍(图1-A),表明总RNA没有降解。
将所得总RNA进行逆转录,使用EF1-α定量引物对cDNA进行半定量检测,PCR扩增产物进行琼脂糖凝胶电泳,结果显示不同组织的产物均出现与预期大小相近的约150 bp大小的条带(图1-B),说明cDNA质量完好。
注:(A)各组织总RNA电泳图;(B)各组织半定量电泳图。M:DL 2 000 Marker;1:肌肉;2:皮肤;3:肝脏;4:脾脏;5:鳔;6:鳃;7:心脏;8:肠;9:胃;10:鳍;11:肾脏;12:性腺。
Notes:(A)Total RNA electrophoresis of each tissue;(B)Semi-quantitative electrophoresis map of each tissue;M:DL 2 000 Marker;1:Muscle;2:Skin;3:Liver;4:Spleen;5:Bladder;6:Gill;7:Heart;8:Gut;9:Stomach;10:Fin;11:Kidney ;12:Gonads.
2.2 引物特异性及RT-qPCR效率
已知RT-qPCR产物范围为135~263 bp,经1.0%琼脂糖凝胶电泳验证每个内参基因只有一条条带(图2-A)。此外,RT-qPCR熔解曲线也显示出与预期熔解温度相对应的单峰(图2-B),分布在79~83℃之间,表明qPCR反应产物具有较高的特异性,并且无二聚体产生。
根据标准曲线计算出每个内参基因的扩增效率,β-actin、GAPDH、EF1-α和18S基因的扩增效率分别为2.03、2.04、1.97和2.02,线性R2(相关系数)范围为0.993 9 ~1.000 0,符合本实验要求。
2.3 备选内参基因的表达谱
为分析每个内参基因的表达丰度,采用RT-qPCR检测不同样品中备选内参基因的循环阈值(Ct值),这些基因的相对丰度可以通过循环阈值的形式反映出来,低Ct值表示高表达量[15]。本研究对300份样品(每种组织各6份)进行检测,采用Graphpad prism 5对每个内参基因的原始表达数据Ct值进行统计绘图(图3)。4个内参基因在所有样品中Ct值范围为11.35~35.48。其中18S的表达丰度最高,平均Ct值为(16.77±2.11)(Mean±SD),EF1-α(21.08±0.77)次之,GAPDH(24.45±3.27)和β-actin(26.33±3.86)的表达丰度偏低。此外,EF1-α的变异性最低,其Ct值范围也最窄,说明它在不同条件下表达水平较为恒定。
通常,Ct值可以直观地显示备选内参基因的稳定性和表达水平。然而,为了进一步评估所选择的4个备选内参基因在所有实验样本中的稳定性,需要对数据进行更系统的分析:将Ct值转化相应的数据,用geNorm、NormFinder和BestKeeper三种软件程序分析其表达稳定性。
注:(A)所有定量引物的RT-qPCR产物电泳图,M:DL 2 000 Marker,1:GAPDH;2:18S;3:EF1-α;4:β-actin;(B)四个备选内参基因的标准曲线和溶解曲线。
Notes:(A)Electrophoresis of RT-qPCR products of all quantitative primers,M:DL 2 000 Marker,1:GAPDH;2:18S;3:EF1-α;4:β-actin;(B)Standard curves and fusion curves for the four candidate reference genes.
2.4 备选内参基因在不同发育阶段的菊黄东方鲀中稳定性分析
2.4.1 geNorm分析
geNorm计算结果显示(图4),在总样本中,4个备选内参基因的M值均超过1.5,故在菊黄东方鲀整个发育过程中没有一个内参基因是表达恒定的,因此需要对每个阶段的内参基因进行更进一步的稳定性分析。在3月龄和6月龄中18S和EF1-α的M值最低,说明在发育早期18S和EF1-α是最稳定的内参基因。在发育中后期的M值排序均为GAPDH>18S>β-actin>EF1-α。
注:3M、6M和12M分别表示3月龄、6月龄和12月龄。
Note:3M,6M and 12M represented the ages of 3 months,6 months and 12 months,respectively.
2.4.2 NormFinder分析
NormFinder计算结果及排名如表3所示,EF1-α在总样本以及各个发育阶段中的稳定值最小。在3月龄中β-actin的稳定值最大,但在12月龄及后期发育阶段β-actin的稳定值仅大于EF1-α。18S在3月龄和6月龄中稳定值排名仅次于EF1-α,在发育后期较不稳定。GAPDH在菊黄东方鲀的各个发育阶段以及不同生长环境中稳定值均最大。

表3 根据NormFinder计算备选内参基因的表达稳定性
2.4.3 BestKeeper分析
在总样本和三月龄中,只有EF1-α的SD值小于1,所以仅EF1-α可作为该样本的内参基因。在养殖菊黄东方鲀6月龄、12月龄和成年鱼中(表4),EF1-α是最稳定的内参基因,它的(SD±CV)值最低,分别为(0.42±1.96)、(0.57±2.72)、(0.71±3.29),而GAPDH是最不稳定的,它的SD值始终大于1。在野生成年鱼中,18S是最稳定的内参基因。

表4 根据BestKeeper计算备选内参基因的表达稳定性
2.4.4 综合排名分析
根据表5统计结果可以看出,EF1-α是所有条件下得分最小的,排名第一,在总样本、3月龄和6月龄排名次之的是18S,在12月龄、野生和养殖成鱼中β-actin排名第二,GAPDH是除了3月龄外得分最高的。因此,综合排名最稳定的基因为EF1-α,最不稳定的是GAPDH。

表5 geNorm、NormFinder和BestKeeper分析稳定值排名
2.5 备选内参基因在组织中的稳定性分析
4个内参基因在不同发育阶段的菊黄东方鲀组织中表达总水平如图5所示,从图中可以直观地看出偏差越大的稳定性越差。其中鳍、鳃中GAPDH和精巢中GAPDH、β-actin的表达丰度较低,不适宜作为该组织的内参基因。再根据geNorm、NormFinder和Bestkeeper计算出各组织的稳定性值,并进行排序。表6列出了各组织的稳定值和排序情况,EF1-α是胃、肠、脾脏、鳔、心脏、卵巢和精巢的最适内参基因,其中在胃、脾脏和鳔中由于18S和GAPDH的SD值大于1,不能作为内参基因,故选择排名次之的EF1-α。GAPDH是心脏、鳃、皮肤和肾的最适内参基因,18S是心脏、鳍、肝脏和精巢的最适内参基因,β-actin是肌肉的最适内参基因。
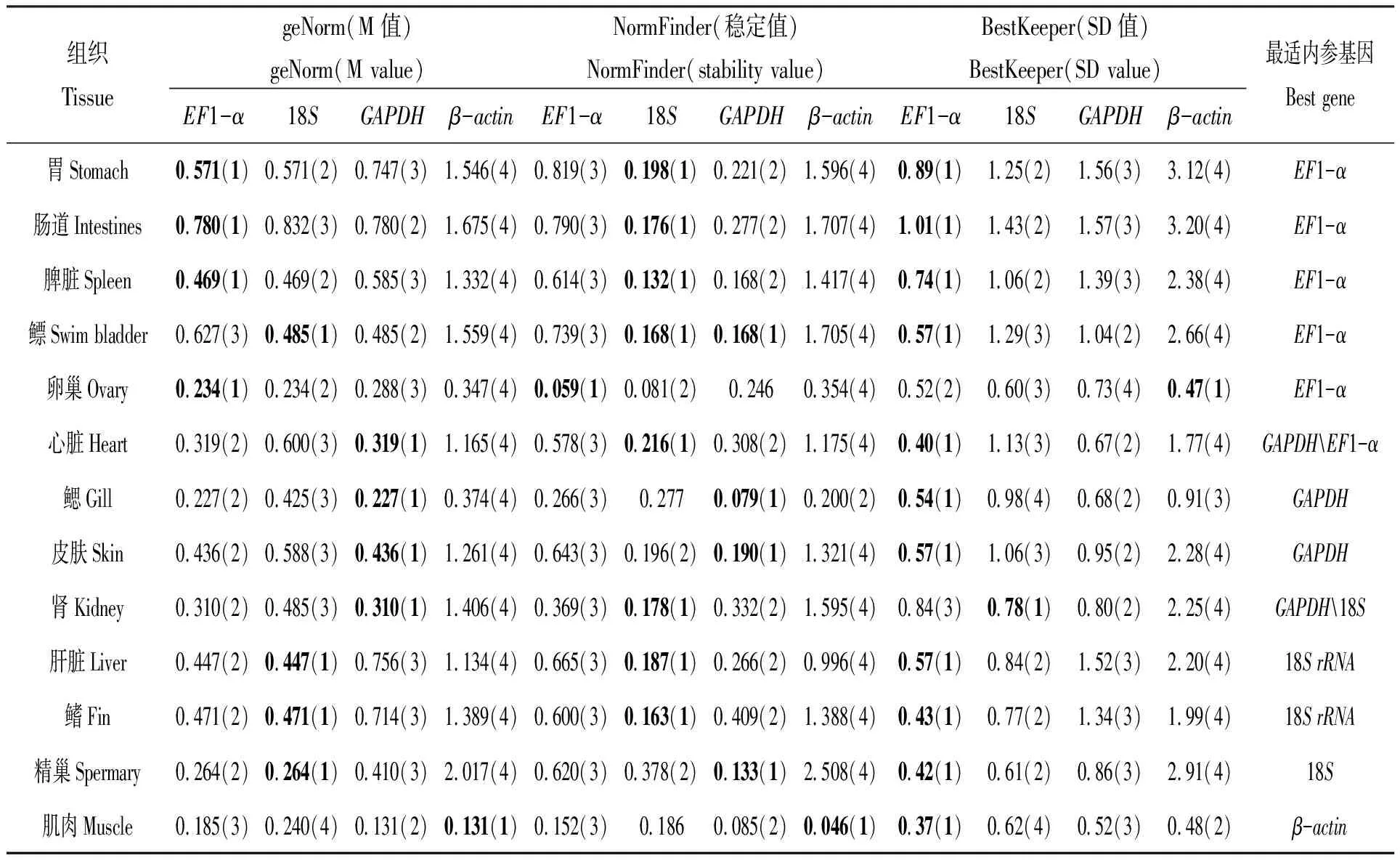
表6 由geNorm、Normfinder和Bestkeeper计算备选内参基因的排序及其各自的基因稳定性值
注:在各组织中每个软件计算结果排序第一的加粗突出显示。
Note:Bold highlighting of the first order of results for each software calculation in each organization.
3 讨论
在qPCR分析过程中,评价作为校准和标准化的内参基因有多种分析方法。目前,已开发的用于内参基因筛选的软件包括:GeNorm软件、NormFinder软件和BestKeeper软件。分别使用这三个软件对数据进行分析,选出稳定度最高的内参基因,最后综合这三个软件得到最稳定的内参基因。研究选择4个常用的管家基因β-actin、GAPDH、18S、EF1-α作为备选内参基因,以不同发育阶段的菊黄东方鲀为研究对象,通过实时荧光定量PCR技术检测分析了4个备选内参基因的表达稳定性,得到4个内参基因的稳定度。
β-actin是一种在动物或植物研究中最常用的内参基因[16-19]。然而,越来越多的证据表明,β-actin在某些情况下有表达差异,其表达会受生长、分化,甚至一些生物刺激的影响[20],因此,β-actin作为内参基因时存在争议。本研究数据也表明,β-actin表达水平在养殖菊黄东方鲀3月龄和6月龄时偏低且组织间差异较大,其中肌肉表达水平比其他组织的高很多,是影响β-actin在组织中表达稳定性的关键因素之一。但β-actin在肌肉中不论是菊黄东方鲀的不同发育阶段还是不同生长环境中的表达差异甚小,且表达水平适中。因此,选择β-actin作为内参基因时应酌情考虑。
GAPDH也是较常见的管家基因之一,在荧光定量PCR分析中经常被用于基因表达数据的标准化[21]。然而,GAPDH作为基因表达分析的内参基因也存在一定的争议。例如,张家岭等报道了GAPDH在蓝点马鲛鱼中表达量最不稳定[22];Tang等研究描述了9种内参基因在斑马鱼胚胎发育和斑马鱼组织中的表达,结果表明GAPDH是最不适合作为两种条件下的内参基因[23]。本研究表明GAPDH基因表达水平在组织间差异显著,在养殖菊黄东方鲀3月龄时表达水平适中,但在发育过程中以及成鱼后,GAPDH在肌肉中的表达水平增加,而在鳃、鳍和脾脏中的表达水平急剧减小。故GAPDH不适于作为菊黄东方鲀基因表达定量分析的内参基因。
一般来说,18S在生物体中表达最为丰富[24]。Olsvik等[23]和Tang等[25]检测了大西洋三文鱼和斑马鱼组织特异性表达,他们证实18S在不同组织类型间表达相对一致。同样,本研究也证实了18S在部分组织中的表达是相对稳定的。但是,一般不选择18S,主要是因为rRNA占总RNA量的80%左右,呈高丰度表达,可能会比目的基因的表达丰度高很多,容易在试验过程中和数据分析时放大误差。
延伸因子1-α(EF1-α)参与mRNA的翻译,是细胞中表达较多的蛋白质[26]。最近的研究表明,EF1-α在梭子蟹正常条件下以及在白斑综合征病毒刺激后各组织中表达水平始终较为稳定[27]。Tsukamoto等在研究红鳍东方鲀体内的TIMP-2s定量表达时,同样选择以EF1-α作为内参基因[28]。本研究发现EF1-α的表达量仅次于18S,表达丰度适中,是菊黄东方鲀各个发育阶段表达水平最为稳定的,可作为研究不同发育阶段组织间基因水平变化的内参基因。
总之,本研究验证了4个管家基因在菊黄东方鲀不同发育阶段以及不同生长环境中的稳定性,并筛选出EF1-α是表达最稳定的内参基因。可以利用这些结果对菊黄东方鲀主要功能基因的定量分析进行校准,以获得准确、可靠、有意义的数据。这些数据将为阐明菊黄东方鲀重要的分子调控机制和加速菊黄东方鲀品种改良提供理论基础。

