载甘草次酸的聚乙二醇-油酸胶束的制备及制剂学研究
梁蔷薇,李莉,刘艳华,2
(1.宁夏医科大学药学院,宁夏 银川 750004; 2.回医药现代化省部共建教育部重点实验室,宁夏 银川 750004)
甘草次酸(glycyrrhetinic acid,GA)是甘草中主要的三萜类活性成分甘草酸的苷元,具有抗感染、抗肿瘤作用,主要用于慢性肝炎和肝癌的治疗[1-3]。国外研究表明,甘草次酸及其衍生物可作为靶向肝脏的配体,因此有研究尝试将甘草次酸作为靶向配体用于肝靶向治疗[4-5]。然而,甘草次酸在水中的溶解性极差,生物利用度较低,限制了其临床应用。目前,甘草次酸临床使用的制剂有注射液。关于GA给药系统还有微乳、固体脂质纳米粒等研究报道[6],虽然一定程度可以解决GA的给药问题,但仍存在制备复杂等不足。
据文献报道,聚合物胶束可在溶液中自组装成疏水性内核和亲水性外壳结构,疏水性内核可以包裹溶解度低的药物如甘草次酸、阿霉素等[7-9],有效改善药物溶解性低的问题。聚乙二醇(PEG)亲水化嵌段是最常见的聚合物胶束载体,低毒且无刺激性,以PEG为亲水嵌段的两亲性聚合物具有良好的生物和血液相容性、抗凝血性、抗巨噬细胞吞噬、长循环等特性[10-15]。因此,本研究采用PEG作为亲水基团对疏水性油酸(oleic acid,OA)进行接枝修饰,合成并表征了两亲性聚乙二醇-油酸(PEG-OA2)高分子材料,以此聚合物为载体材料制备包载甘草次酸的聚合物胶束,以期为难溶性药物提供一种有前景的纳米给药系统。
1 实验部分
1.1 仪器和试药
DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);TDL-40B低速台式大容量离心机(上海安亭科学仪器厂);RE-2000A旋转蒸发器(上海亚荣生化仪器厂);DZF-6090真空干燥箱(上海齐欣科学仪器有限公司);AL204电子天平(梅特勒-托利多仪器有限公司);GM-1.0A隔膜真空泵(天津市津腾实验设备有限公司);VORTEX-5涡旋混合器(上海市其林贝尔仪器制造有限公司);ZS90纳米粒度、Zeta电位分析仪(英国马尔文Malvern科技有限公司);Waters E2695高效液相色谱仪(美国沃特斯科技有限公司);AVANCE 400M核磁共振氢谱仪(德国布鲁克科技有限公司)。
甘草次酸(GA,质量分数97%,批号:JZ16122301,南京景竹生物科技有限公司);PEG2000(批号:MKCF6079,美国西格玛奥德里奇公司);油酸(OA,批号:C0680250224)、N,N′-二环乙基碳二亚胺(DCC,批号:170802242Y)、对二甲氨基吡啶(DMAP,批号:HF709151)均由南京化学试剂股份有限公司提供;N-alpha-芴甲氧羰基-N-epsilon-叔丁氧羰基-L-赖氨酸[Fmoc-lys(Boc)-OH,批号:GLS171103-36802,吉尔生化上海有限公司]、NΑ,NΕ-双(叔丁氧羰基)-L-赖氨酸二环己铵[Boc-Lys(Boc)-OH,批号:GLS160906-31105,吉尔生化上海有限公司];二氯甲烷(分析纯,天津市大茂化学试剂厂);三乙胺(上海广诺化学科技有限公司);甲醇(色谱纯,德国默克股份有限公司)。
1.2 PEG-OA2聚合物的合成
精密称取PEG2k5 g、Fmoc-lys(Boc)-OH 5.86 g、DCC 2.58 g、DMAP 0.15 g于50 mL反应瓶中,加二氯甲烷25 mL溶解,室温下磁力搅拌3 d,反应液过滤后滤液分装入50 mL离心管,加无水乙醇至45 mL,充分振摇后放入-80 ℃冰箱冷冻(20 min)后离心(4 000 r/min,2 min),弃去上清液于37 ℃水浴活化;再加入乙醚沉淀,重复上述操作1次,旋蒸,真空干燥;取该干燥物3.65 g,加入二氯甲烷和三氟乙酸各9 mL,室温下磁力搅拌2 h,反应液用同上述乙醚的操作沉淀2次后旋蒸并真空干燥。取该干燥物5.36 g、Boc-Lys(Boc)-OH 5.95 g、DCC 3.54 g、DMAP 0.21 g,TEA 350 μL,溶于27 mL二氯甲烷,室温下磁力搅拌3 d,同上述操作用无水乙醇和乙醚沉淀2次后,旋蒸并真空干燥。再取该干燥物 1.27 g,加二氯甲烷和三氟乙酸各3 mL,室温下磁力搅拌2 h,反应液用同上述乙醚的操作沉淀2次,反应液旋蒸并真空干燥。取该干燥产物1 g、OA 0.565 g、DCC 0.660 g、DMAP 0.039 g、三乙胺150 μL于棕色瓶,加5 mL二氯甲烷溶解,室温下磁力搅拌3 d,同上述操作用无水乙醇和乙醚沉淀2次后旋蒸并真空干燥[16]。该干燥产物PEG-OA2的合成路线见图1。
1.3 PEG-OA2聚合物的结构表征
精密称取PEG-OA2两亲性高分子材料5 mg,加入氘代三氯甲烷溶解,用注射器转移至干净的核磁管里,采用AVANCE 400M核磁共振氢谱仪鉴定PEG-OA2的化学结构。
1.4 PEG-OA2临界胶束浓度的测定
精密称取PEG-OA2聚合物材料10 mg,溶于1 mL二氯甲烷中,得到质量浓度为10 mg/mL的聚合物溶液。精密称取尼罗红5.7 mg,溶于10 mL二氯甲烷,得到质量浓度为0.57 mg/mL的尼罗红溶液;取0.57 mg/mL的尼罗红溶液0.5 mL,加二氯甲烷49.5 mL,得到质量浓度为0.057 mg/mL的尼罗红溶液。将10 mg/mL的聚合物溶液用纯化水稀释成质量浓度为0.000 1、0.000 5、0.001、0.005、0.01、0.02、0.04、0.05、0.08、0.1、0.2、0.5 mg/mL溶液,各加10 μL质量浓度为0.057 mg/mL的尼罗红溶液,氮气吹膜,真空干燥(1 h)后分别各加200 μL PBS复溶,再加蒸馏水至3 mL,用荧光分光光度计测定荧光强度[17](激发波长350 nm,发射波长350~450 nm)。
图1 PEG-OA2聚合物的合成路线
Figure 1 Synthesis scheme of PEG-OA2polymer
1.5 载药聚合物胶束的制备
精密称取GA 5 mg,溶解于1 mL二氯甲烷中,制得质量浓度5 mg/mL的GA溶液。精密称取PEG-OA250 mg,溶解于0.5 mL二氯甲烷中,制得质量浓度100 mg/mL的PEG-OA2聚合物溶液。按照摩尔比1∶1、2.5∶1、5∶1的比例,分别取对应体积GA溶液和PEG-OA2聚合物溶液,氮气吹膜后真空干燥1 h,各加200 μL PBS涡旋溶解后得到不同摩尔比的载药聚合物胶束(PEG-OA2/GA)[16]。空白胶束的制备方法同载药聚合物胶束。
1.6 PEG-OA2/GA载药胶束粒径和电位的测定
取PEG-OA2/GA载药胶束溶液各100 μL,加900 μL纯化水稀释,在温度为25 ℃下,采用ZS90纳米粒度、Zeta电位分析仪测定聚合物胶束的粒径以及Zeta电位。
1.7 PEG-OA2/GA载药胶束的形态观察
取空白胶束和摩尔比为5∶1的PEG-OA2/GA载药胶束,滴加适量于覆盖碳膜的铜网上,用3%磷钨酸负染后置于透射电镜下观察聚合物胶束的形态。
1.8 PEG-OA2/GA载药胶束载药量和包封率的测定
取不同摩尔比的PEG-OA2/GA载药胶束,各加800 μL纯化水稀释,各等分为2份,置于离心管中,标明对应摩尔比例下的样品1和样品2溶液;取不同摩尔比例下的样品2溶液离心(3 000 r/min,5 min);再依次从未离心的3份样品1溶液和已离心后的样品2溶液中均平行各取2份溶液,每份150 μL,共得12份样品溶液,再依次各加800 μL甲醇,经滤膜过滤后,采用HPLC法测定样品中药物的含量[18][色谱条件:Diamonsil C18色谱柱(200 mm×4.6 mm,5 μm);流动相:甲醇-水-冰醋酸(体积比53∶47∶0.1);流速:1.0 mL/min;检测波长:233 nm;柱温:30 ℃;进样量:10 μL]。再按以下式子计算得到包封率和载药量:包封率=胶束中包封药物的质量/胶束中投入的药物总质量×100%,载药量=胶束中包封药物的质量/(载体质量+载药质量)×100%。
1.9 PEG-OA2/GA载药胶束的稳定性考察
取不同摩尔比的PEG-OA2/GA载药胶束,置4 ℃冰箱保存,观察是否有沉淀析出,记录胶束保持稳定的时间(d)。
2 结果与讨论
2.1 PEG-OA2聚合物的结构表征
图2为聚合物PEG-OA2在CDCl3中的1H NMR(CDCl3)光谱,δ2.0、1.3分别归属于OA结构上的—CH2和—CH3的伸缩振动吸收峰;δ3.6归属于PEG结构上的—OCH2、—OCH3的特征吸收峰;δ7.7呈现的吸收峰归属于PEG-OA2结构中Fmoc的特征吸收峰,由以上特征峰结果表明PEG与OA通过化学键成功相连,OA在PEG-OA2聚合物中的接枝率为20.13%。

图2 聚合物PEG-OA2在CDCl3中的1H NMR光谱
Figure 21H NMR spectrum of PEG-OA2polymer in CDCl3
2.2 PEG-OA2的临界胶束浓度
临界胶束浓度(critical micelle concentration,CMC)是表征两亲性聚合物在水中的自组装特性和胶束的体内外结构稳定性的重要参数。以PEG-OA2的质量浓度为横坐标,测得尼罗红的荧光强度为纵坐标作图,所得曲线见图3。由曲线的拐点确定PEG-OA2载体材料的CMC为25.2 μg/mL,此CMC值较小,表明制备的PEG-OA2两亲性载体材料在水中具有良好的自组装能力和结构稳定性,可作为胶束载体包载难溶性药物,并且经静脉注射进入体内后不易解聚,具有良好的血液稀释稳定性。
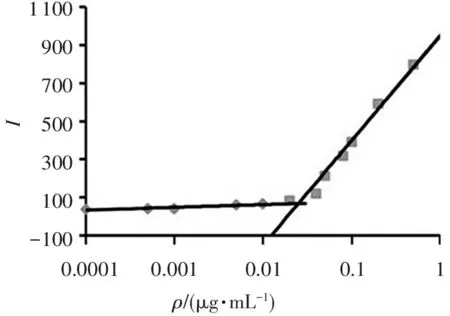
图3 尼罗红荧光强度与PEG-OA2聚合物浓度的关系图
Figure 3 Plots of fluorescence intensity of nile red against PEG-OA2polymer concentration
2.3 PEG-OA2/GA载药胶束的粒径和Zeta电位
图4是PEG-OA2空白胶束和PEG-OA2/GA载药胶束的动态光散射粒径图,可见它们均具有较小的粒径,分布比较集中,峰形较好,说明聚合物胶束的粒子大小比较均一。从表1可见:不同摩尔比的PEG-OA2/GA的粒径较空白胶束的大,可能是受疏水作用力π-π共轭作用的影响,疏水性药物GA被包裹在两亲性高分子载体材料的疏水性内核中,药物占据一定的空间位置,使得PEG-OA2/GA载药胶束的粒径总体较空白胶束的粒径大;随着PEG-OA2/GA摩尔比的增加,胶束的粒径减小,这可能是因为存在分子间疏水作用力π-π共轭作用的影响,当包载等量药物时,增加载体材料的量,药物被充分包裹,药物与载药材料结合更加紧密,分子间的空隙越小,所以载药胶束的粒径依次变小。另外,由表1 中的Zeta电位值可见,空白胶束及不同摩尔比的PEG-OA2/GA载药胶束的Zeta电位均接近于0,可能是因为载体材料中PEG不带电荷,使得PEG-OA2/GA载药胶束的亲水性外壳不带电荷,则聚合物胶束整体的电性接近中性,所以空白胶束和载药胶束的电位均接近于0。
2.4 PEG-OA2/GA载药胶束的形态
图5中A、B分别是空白胶束PEG-OA2和摩尔比为5∶1的PEG-OA2/GA载药胶束的透射电镜图。可见,聚合物胶束外观圆整,多为球形或类球形粒子,大小较均一;此外,聚合物胶束粒子比粒径仪测得的小,可能是因为在透射电镜样品制备过程中胶束溶液干燥,引起粒子失水而粒径变小。
2.5 PEG-OA2/GA载药胶束的载药量和包封率
采用HPLC法测定不同摩尔比的PEG-OA2/GA载药胶束的载药量和包封率,表1结果显示PEG-OA2/GA的摩尔比为5∶1时的包封率最好,可能是在包载相等摩尔质量药物的情况下载体材料的量最多,可以载药的胶束空间更大,有更多的药物进入载体内核被充分包载,因而药物包封率增大;随着载体/药物摩尔比的增加,载药量依次减小,可能因为包载等量药物时,增加载体材料的量,用于载药以外的游离材料的量也逐渐增多,因此载药量逐渐降低。
2.6 聚合物胶束的稳定性
由表1结果显示,增大PEG-OA2/GA的摩尔比,载药聚合物胶束的稳定性也增加,可能是因为当包载等量药物时,载体材料越多,通过药物与载体之间的疏水作用力π-π共轭作用更强,药物被包裹得越完全,使得药物越难析出,所以增加了包载药物聚合物胶束的稳定性。
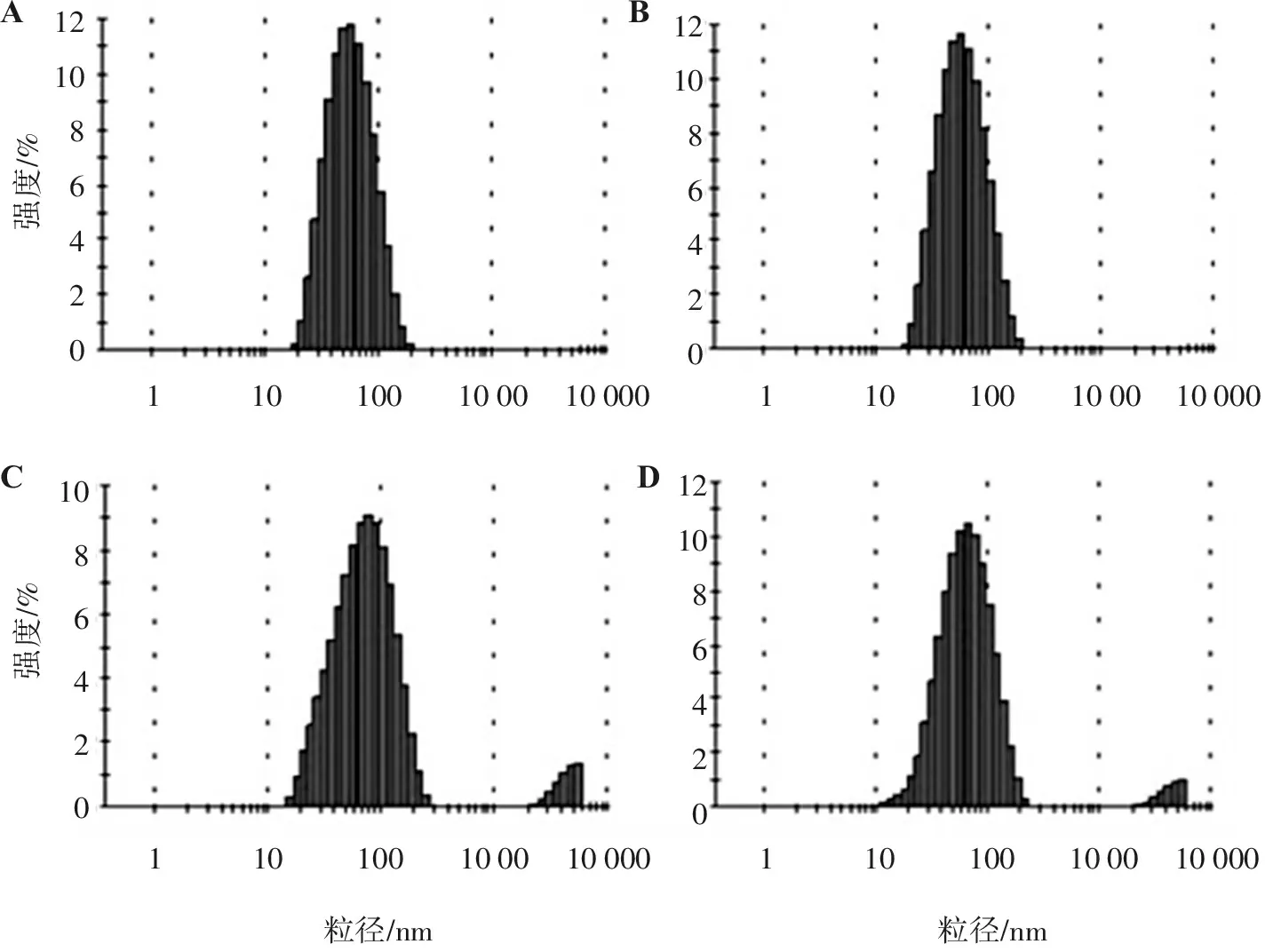
A. PEG-OA2; B、C、D分别为摩尔比为1∶1、2.5∶1、5∶1的PEG-OA2/GA载药胶束。
图4 PEG-OA2空白胶束和PEG-OA2/GA载药胶束的粒径图
Figure 4 Particle sizes of blank micelles and PEG-OA2/GA
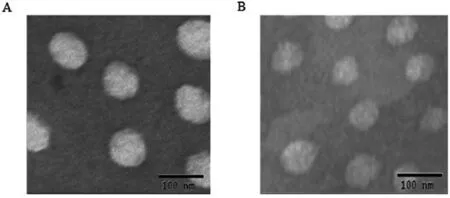
图5 PEG-OA2胶束(A)和PEG-OA2/GA胶束(B)的TEM图像
Figure 5 TEM images of PEG-OA2micelles (A) and GA-loaded PEG-OA2micelles (B)
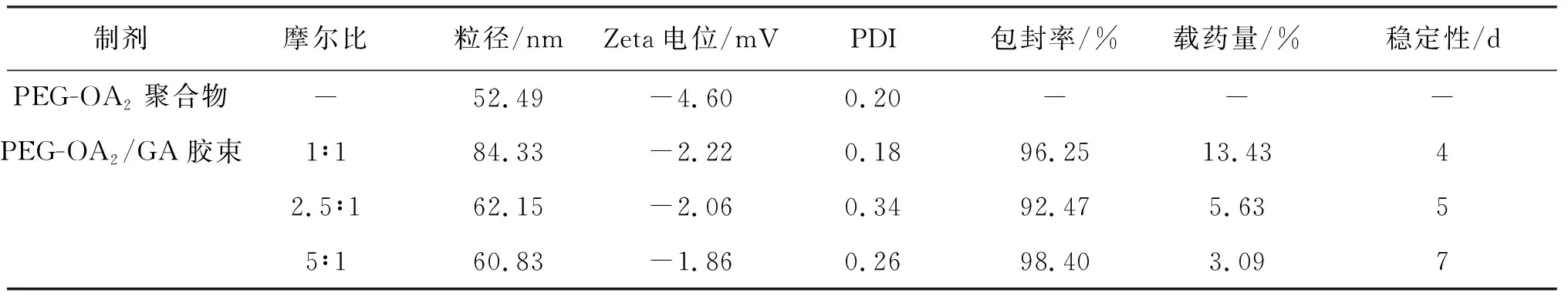
表1 不同摩尔比GA/PEG-OA2载药胶束与PEG-OA2载体的制剂学表征Table 1 Characterization of PEG-OA2 carriers and GA-loaded PEG-OA2 micelles at different PEG-OA2 and GA molar ratios
3 结论
本研究合成的新型两亲性高分子材料PEG-OA2具有良好的胶束自组装特性,以PEG-OA2作为聚合物胶束的载体材料,用来包载甘草次酸制备的聚合物胶束具有较强的载药能力,且稳定性好,可以有效改善甘草次酸的溶解性,为其他难溶性药物的纳米载体系统研究提供一定的参考价值。

