基于区分性溶出介质的艾地苯醌片的研究
马敏超,李 雯,王 珏,付 强*
基于区分性溶出介质的艾地苯醌片的研究
马敏超1,李 雯1,王 珏2,付 强1*
(1. 沈阳药科大学 无涯创新学院,辽宁 沈阳 110016;2. 中国食品药品检定研究院 包装材料与药用辅料检定所,北京 100050)
筛选可以有效区分艾地苯醌固体制剂质量的溶出介质,并开发制备艾地苯醌片剂。以溶出度为指标,评价市售艾地苯醌片剂在不同溶出介质中的溶出行为,筛选出能够区分药物制剂质量的溶出介质;采用粉末直接压片技术制备艾地苯醌片剂;评价自制艾地苯醌片在不同溶出介质中的溶出。两种艾地苯醌市售片在纯水中的溶出曲线差异最显著;对于自制制剂,微粉化的艾地苯醌片的溶出度大于未微粉化的艾地苯醌片。纯水是有效区分艾地苯醌片剂质量的溶出介质;微粉化技术可以有效提高药物的溶出度。
药剂学;片剂;微粉化;艾地苯醌;溶出度
对于口服固体制剂而言,溶出度是评价其质量的一个关键参数[1]。《中华人民共和国药典》中所规定的溶出实验大多是在漏槽条件下进行的,但这难以区分制剂的内在质量。因此,采用体外溶出实验区分制剂的差异,对药物制剂的质量评价具有重要意义[2]。
艾地苯醌(idebenone,IDB)是一种常用于治疗脑功能损伤和精神行为障碍的药物[3]。IDB几乎不溶于水,限制了其在体内的生物利用度[4-5]。微粉化技术可改善这类药物在水中的溶解度[6-7],因此,可以尝试采用微粉化技术提高这类药物的口服生物利用度。本文作者筛选出可以有效区分IDB固体制剂水溶性的溶出介质;基于此,采用微粉化技术提高IDB的水溶性,开发IDB片剂。
1 仪器与材料
RC12AD溶出试验仪(天津天大天发科技有限公司),UV1102II紫外可见分光光度计(天美科学仪器有限公司),ZP-5旋转式压片机(上海天和制药机械有限公司),BT-9300LD干湿法两用激光粒度分布仪(丹东百特仪器有限公司),BSA124S-CW电子天平(赛多利斯科学仪器仪器(北京)有限公司)。
艾地苯醌(武汉远成共创科技有限公司,批号313070),艾地苯醌市售片(厂家A,批号8G0661D57),艾地苯醌市售片(厂家B,批号20170902),微晶纤维素(MCC)、交联聚维酮(PVPP)、聚维酮K30(PVP K30)、二氧化硅、硬脂酸镁(安徽山河药用辅料股份有限公司),聚山梨酯80(南京威尔药业股份有限公司)。
2 方法与结果
2.1 对照品溶液的配制
精密称取IDB对照品15 mg,置500 mL量瓶中,加乙醇5 mL溶解后,加质量分数0.3%聚山梨酯80溶液稀释至刻度,摇匀。精密量取上述溶液3 mL,置10 mL量瓶中,加水稀释至刻度,摇匀,作为对照品溶液。
2.2 区分性溶出介质的筛选
2.2.1IDB在不同介质中的平衡溶解度
依照《中华人民共和国药典》(2015年版)四部通则8004缓冲液,配制pH 1.0盐酸溶液,pH 4.5醋酸缓冲溶液,pH 5.8、pH 6.8、pH 7.4和pH 8.0的磷酸盐缓冲液,以及质量分数分别为0.02%、0.05%、0.1%、0.2%、0.3%和0.5%的聚山梨酯80水溶液,分别向纯水和上述溶液中加入过量的IDB,涡旋后,放入37 ℃恒温水浴中振摇48 h。取样,以0.22 μm滤膜滤过,依照《中华人民共和国药典》(2015年版)四部通则0401紫外-可见分光光度法,于279 nm波长处测定吸光度,以对照品比较法测定上清样品中IDB的质量浓度,计算不同条件下IDB的平衡溶解度。结果见表1。
Table 1 Equilibrium solubility of IDB in different media at 37 ℃ (±s, n=3)
表 1 IDB在不同介质中的平衡溶解度(± s, n=3)

Table 1 Equilibrium solubility of IDB in different media at 37 ℃ (±s, n=3)
MediaSolubility/ (mg·L-1) Water13.21 ± 3.05 pH 1.2 HCl16.68 ± 0.92 pH 4.5 acetate buffer16.87 ± 0.85 pH 5.8 PBS14.19 ± 3.48 pH 6.8 PBS15.91 ± 1.69 pH 7.4 PBS14.92 ± 2.45 pH 8.0 PBS16.17 ± 1.19 Tween 80 (w=0.02%)31.57 ± 0.53 Tween 80 (w=0.05%)47.47 ± 3.67 Tween 80 (w=0.1%)91.34 ± 1.54 Tween 80 (w=0.2%)167.85 ± 5.58 Tween 80 (w=0.3%)293.37 ± 7.64 Tween 80 (w=0.5%)334.57 ± 3.46
由表1可知,在水及不同pH介质中,IDB的平衡溶解度均在13~16 mg·L-1内且无统计学差异(>0.05),因此,IDB的平衡溶解度无pH依赖性。另外,随着聚山梨酯80浓度的增加,IDB的溶解度随之增大;当聚山梨酯80的浓度达到甚至高于0.1%时,1 000 mL的溶出介质可以满足IDB的漏槽条件。
2.2.2区分IDB市售片质量的溶出介质的筛选
取两种不同厂家的IDB市售片各6片,依照《中华人民共和国药典》(2015年版)四部通则0931溶出度与释放度测定法第二法桨法,分别以水、质量分数分别为0.02%、0.05%、0.1%、0.2%和0.3%的聚山梨酯80水溶液1 000 mL为溶出介质,设置温度为37 ℃,转速为75 r•min-1,于5、10、15、20、30、45和60 min取样10 mL,滤过,精密量取续滤液3 mL,置10 mL量瓶中,加溶出介质稀释至刻度,摇匀,即为供试品溶液。取上述供试品和对照品溶液,测定供试品溶液中IDB的质量浓度,进而计算IDB片剂的累积溶出百分率。结果见图1~6。
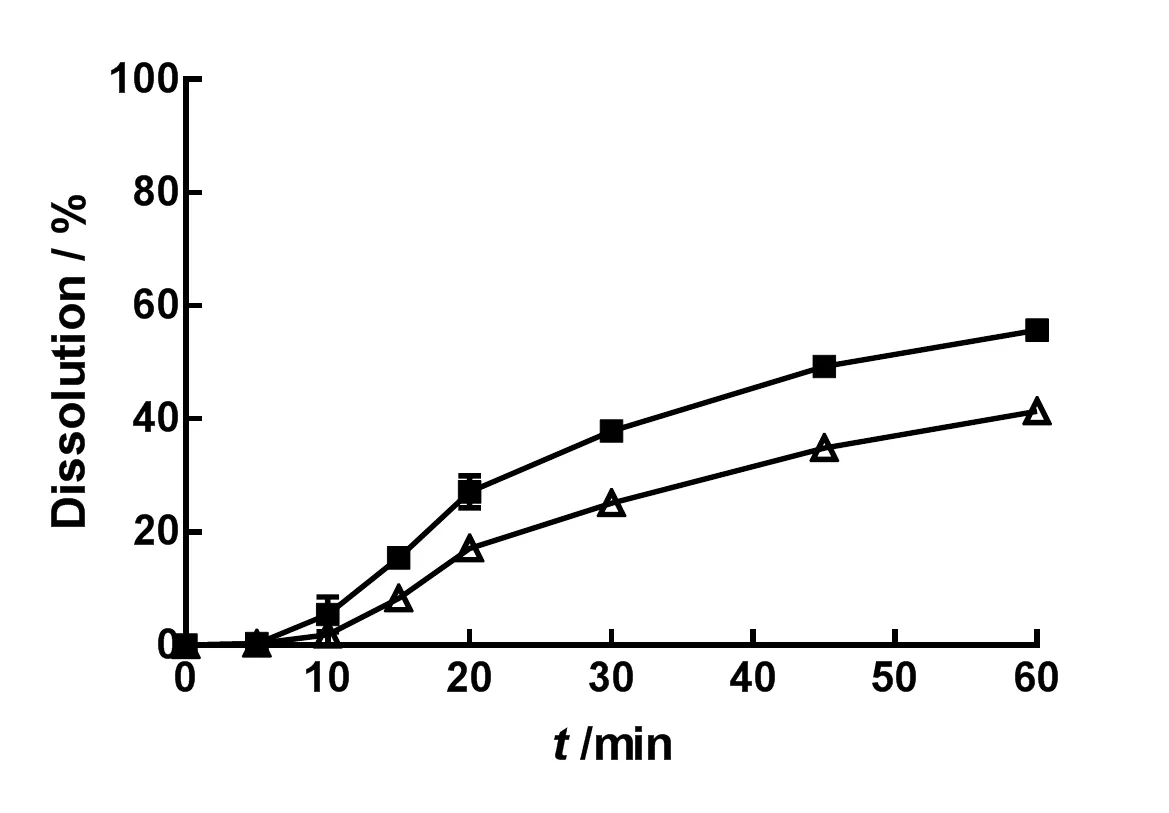
—Brand A;—Brand B

—Brand A;—Brand B

—Brand A;—Brand B

—Brand A;—Brand B

—Brand A;—Brand B

—Brand A;—Brand B
差异因子1是衡量两条曲线相对偏差的参数,1越大,说明两条溶出曲线的差异越显著。因此,可以通过差异因子(1)法计算图1~6中两条溶出曲线的总体差异,计算公式如下:

其中为取样时间点个数,R为厂家B的IDB市售片在时刻的累积溶出百分率,T为厂家A的IDB市售片在时刻的累积溶出百分率。计算结果见表2。

Table 2 The f1 values of IDB tablets in different media
由表2可知,1 000 mL的纯水可以更好地区分难溶性药物IDB的内在质量。
2.3 微粉化对IDB片剂溶出的影响
以溶出度为评价指标,评价微粉化技术在提高难溶性药物IDB溶出度中的有效性。
2.3.1 微粉化药物的制备
精密称取IDB原料药3 g,采用手动研磨法将药物研磨2 h,为避免药物熔融,每研磨10 min,置于室温冷却2 min,即得微粉化药物。
2.3.2 粒径测定
将200 mg的微粉化药物与未微粉化药物分别分散于8 mL水中,于湿法条件下,采用激光粒度分布仪测定其粒径。设置激光粒度分布仪遮光度下限为2、上限为20。结果见表2。

Table 3 Particle size distributionsof IDB
2.3.4 IDB自制片的制备
称取1.5 g的IDB原料药、7.5 g(处方量75%)的MCC、0.3 g(处方量3%)的PVP K30、0.5 g(处方量5%)的PVPP、0.1 g(处方量1%)的二氧化硅和0.1 g(处方量1%)的硬脂酸镁,采用等量递加法混合;以8号冲压片,控制厚度为5.25 mm,片重200 mg,即得。按照以上处方工艺过程,称取微粉化IDB,同法操作,即得微粉化IDB自制片。
2.3.5 IDB自制片的溶出度研究
以“2.2.2”所述方法,测定微粉化IDB自制片和非微粉化处理的IDB片在1 000 mL水中的溶出度。结果见图7。

—Micronized;—Crude
由图7可知,原料药经过微粉化处理的IDB自制片的溶出行为好于未经过微粉化处理的片剂。因此,微粉化技术可以有效地提高模型药物IDB在水中的溶解性,继而可能提高药物在体内的生物利用度。
2.3 评价微粉化的IDB片剂在不同溶出介质中的溶出
以“2.2.2”所述方法,测定微粉化IDB自制片在1 000 mL水,质量分数分别为0.02%、0.05%、0.1%、0.2%和0.3%的聚山梨酯80水溶液中的溶出度。结果见图8。
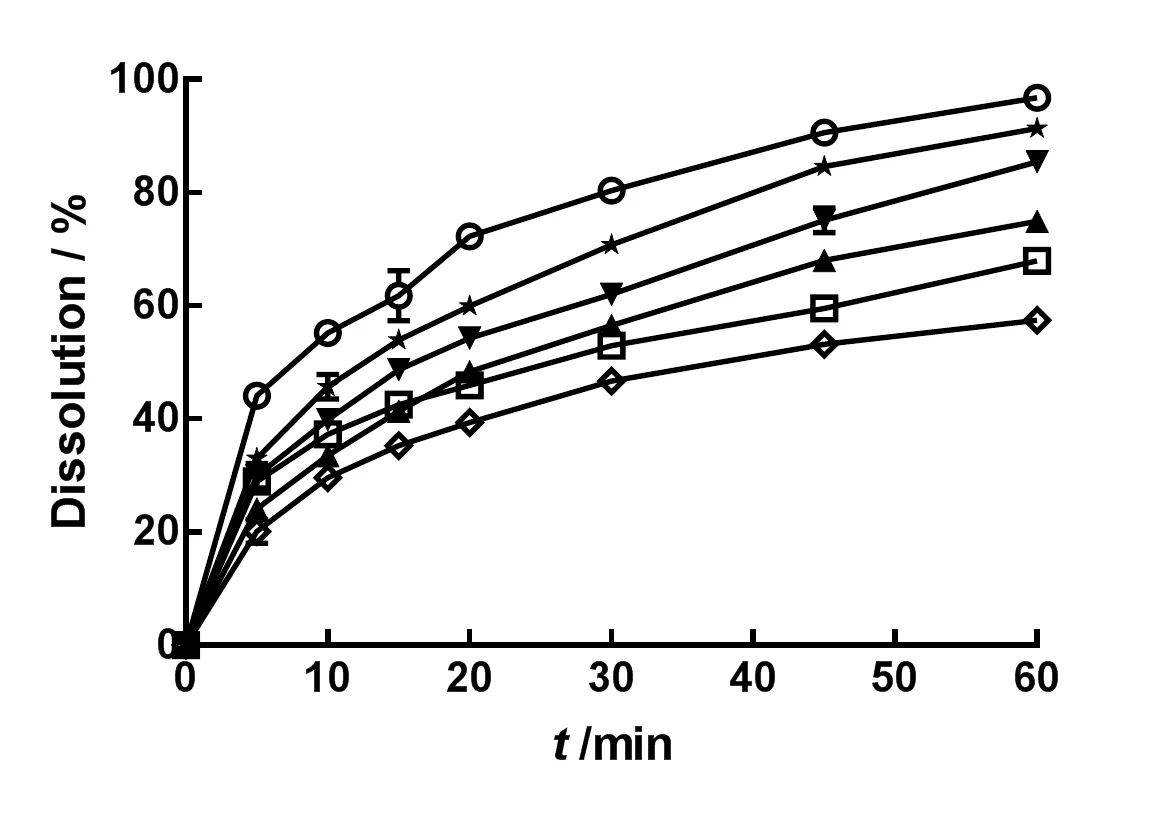
—Tween 80(w=0.3%);—Tween 80(w=0.2%);—Tween 80(w=0.1%);—Tween 80(w=0.05%);—Tween 80(w=0.02%);—Water
由图8可知,自制微粉化IDB片在质量分数0.3%聚山梨酯80水溶液中可以实现完全溶出。与市售片相比,自制微粉化片前10 min溶出迅速,说明自制片的质量良好。
3 讨论
对于BCS II类药物,溶出过程是口服吸收的限速步骤,药物在适宜溶出介质中的溶出行为可以预测其口服吸收[8-12]。据报道[8],基于比格犬体内药动学行为,明确含有质量分数0.05%十二烷基硫酸钠的pH 4.5醋酸盐缓冲液(非漏槽条件)可以最大程度地区分不同厂家生产的尼莫地平片剂的质量。同样,本研究发现,随着溶出介质中聚山梨酯80浓度的增加,两种市售IDB片剂的溶出曲线越来越接近,说明表面活性剂的加入会降低介质的区分能力。通过1因子的比较,明确1 000 mL的纯水介质可以更好地区分难溶性药物IDB的内在质量。
IDB的熔点为52~55 ℃,因此,对原料药进行微粉化处理的关键在于避免IDB熔化。通过手动研磨法可以很好地解决上述问题,但是研磨时间较长,并不具有可生产性。然而,如采用低温研磨设备,生产效率会明显提高。
[1] 谢俊霞, 孙英华, 孙进, 等. 市售阿奇霉素固体制剂的溶出行为[J]. 沈阳药科大学学报, 2005, 22(5): 338-341.
[2] SWANEPOEL E, LIEBENBERG W, DEVARAKONDA B, et al. Developing a discriminating dissolution test for three mebendazole polymorphs based on solubility differences[J]. Die Pharmazie, 2003, 58(2): 117.
[3] 田勇, 胡亚斐. 艾地苯醌片溶出度测定方法的研究[J]. 中国药学杂志, 2004, 40(10): 782-783.
[4] 胡蓉, 陈双喜, 钟海军, 等. 艾地苯醌固体分散体的制备及体外溶出度研究[J]. 中国药房, 2015, 26(34): 4831-4834.
[5] KIM H J, YOON K A, HAHN M, et al. Preparation andevaluation of self-microemulsifying drug delivery systems containing idebenone[J]. Drug Development and Industrial Pharmacy, 2000, 26(5): 523-529.
[6] 陈鹏, 张小岗. 微粉化技术提高水不溶性药物溶解度[J]. 化学通报(网络版), 2007(1): 766-771
[7] 金刚, 王洁. 提高难溶性药物溶出度方法的研究进展[J]. 吉林化工学院学报, 2013, 30(11): 22-24.
[8] HE Z, ZHONG D, CHEN X, et al. Development of a dissolution medium for nimodipine tablets based on bioavailability evaluation[J]. European Journal of Pharmaceutical Sciences, 2004, 21(4): 487-491.
[9] FRASER E J, LEACH R H, POSTON J W, et al. Dissolution-rates and bioavailability of digoxin tablets[J]. Journal of Pharmacy & Pharmacology, 1973, 301(7816): 1393.
[10] 王萍, 张全英, 潘杰. 4家药厂卡马西平片溶出度和生物利用度考察[J]. 药学与临床研究, 2004, 12(5): 1-3.
[11] 刘皋林, 陈强, 李珍, 等. 国产和进口格列齐特体外溶出度测定及其药物动力学特性比较[J]. 第二军医大学学报, 1994, 15(1): 52-57.
[12] 李磊, 张天虹, 何仲贵. 呋喃妥因片剂的体外溶出度对体内生物利用度的影响[J].中国药学杂志, 2003, 38(9): 687-689.
Study on idebenone tablets based on differential dissolution medium
MAMinchao1, LI Wen1, WANG Jue2, FU Qiang1*
(1.,,110016,; 2,,100050,)
To obtain the most effective dissolution medium which can distinguish the quality of solid preparations for idebenone and develop the idebenone tablets.With dissolution as the index, the dissolution behaviors of idebenone tablets in different dissolution media were evaluated to obtain an optimal dissolution medium. Then, idebenone tablets were developed using a direct compression method. Finally, the dissolution behaviors of the micronized idebenone tablets in different dissolution media were investigated.The difference of dissolution curves of two brands of commercial tablets of idebenone in pure water was the most remarkable. The dissolution behavior of the micronized tablets was higher than that of the crude ones.The quality of idebenone tablets can be distinguished effectively in pure water, and the dissolution of drugs is effectively improved by micronization technology.
pharmaceutics; tablets; micronization; idebenone; dissolution
R 94
A
(2020)02–0112–08
10.14146/j.cnki.cjp.2020.02.004
2019-05-07
国家科技重大专项基金资助项目(2017ZX09101001)
马敏超(1994-),女(回族),辽宁沈阳人,硕士研究生,E-mail mmc0622@163.com;
付强 (1984-),男(汉族),辽宁沈阳人,副教授,博士,主要从事药物制剂新技术提高难溶性药物口服吸收的研究,Tel. 13555824099,E-mail fuqiang@syphu.edu.cn。
(本篇责任编辑:马丽丽)

