药学类专业有机反应机理中共振式的书写技巧*
李海浪,祝姗姗,余亚选,叶廷秀,张建雄
(厦门医学院药学系,福建 厦门 361023)
在药学类专业诸多专业基础课程中,有机化学是最难学的专业基础课程之一。由于高考考试科目、内容以及方向的改革,当前的大学本科生高中阶段几乎都选学物质结构而不是有机化学,有机化学为零基础。大学本科有机化学的学习缺乏高中与大学之间的衔接过渡,跳跃性大。此外,有机化学内容庞杂内容多、学时少,学生普遍反映上课听得懂,可是,课后对教材上的内容又理解不来,做起习题更是捉襟见肘。如何找一条快速入门有机化学的教学途径,是每个有机化学任教老师必须要思考的问题。纵观国内外经典有机化学教材[1-8],几乎都按“结构-机理-反应-合成”的模式进行编写与教学,从机理入手学习有机化学已成为普遍共识。有机机理学习中,不可避免会涉及到共振式的书写问题[9]。当我们写一个有机反应机理时,看到一个结构式头脑必须快速而准确地呈现出其相应的共振式。此外,共振式对于预测有机反应分子进攻位点也有非常独到的作用。由此可见,共振论在有机机理教学与学习中占有举足轻重的地位。如何准确、快速地写出共振式是有机机理学习中的一项重要能力。药学类专业的有机化学教材共振论部分基本上仅囿于共振式稳定性条款的介绍,可操作性差,学生在书写有机机理涉及共振式时难免出错。有鉴于此,本文拟就有机机理中常见的共振式书写技巧进行探讨。
1 快速书写共振式技巧

(1)技巧一:寻找与带孤对电子的原子紧邻的缺电子原子
孤对电子可被缺电子原子共享,形成新的π键。例如:
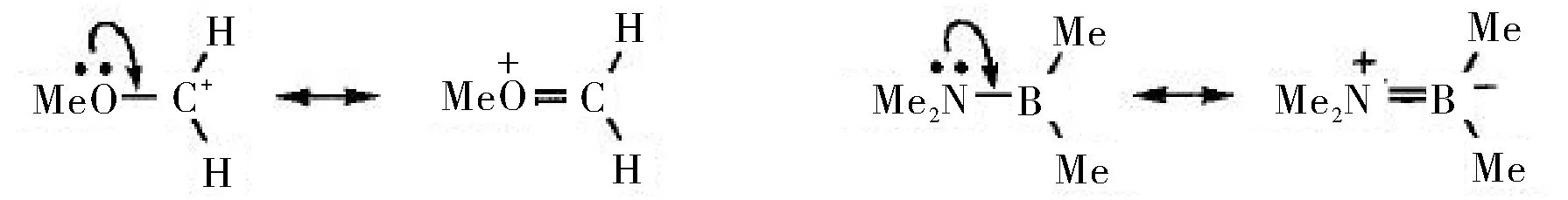
氧原子上的孤对电子处于sp3杂化轨道,该轨道含有两个自旋方向相反的能量较高的未成键电子,而与氧原子相邻的碳正离子拥有一个空的p轨道,因此,氧原子sp3杂化轨道上的一对能量较高的未成键电子会转移一个电子到碳正离子空的p轨道上,氧原子本身带上一个正电荷,碳正离子空的p轨道因得到一个电子变成碳自由基;然后,氧正离子自由基与碳自由基形成新的π键。同理,氮原子sp3杂化轨道上的一对高能的未成键电子转移一个到与其相邻的硼原子上,氮原子变成氮正离子自由基而硼原子变成硼负离子自由基;然后,氮正离子自由基与硼负离子自由基形成一个新的π键。从这两个例子可以看出,正离子共振后得到的共振式仍然带正电荷,中性分子共振后得到的共振式仍然显电中性。这是因为共振式之间仅仅只是电子的重新分布或排布,共振式之间的电子总数既没有增加也没有减少。
(2)技巧二:寻找与π键紧邻的缺电子原子
π电子可转移到缺电子原子上,形成新的π键。例如:

碳碳双键由一个σ键和一个π键构成,而π键是由两个各含有一个电子的p轨道“肩并肩”重叠而成。与碳碳双键紧邻的碳正离子含有一个空的p轨道,该p轨道与碳碳双键中π键的两个p轨道是等同的。当碳正离子与碳碳双键之间的σ键旋转到碳正离子的p轨道与碳碳双键中π键的两个p轨道处于同一平面时,由于这三个p轨道是等同的,两个电子可以在这三个p轨道之间自由转移。与亚甲基碳正离子紧邻的碳原子p轨道上的一个电子转移到亚甲基碳正离子上,本身变成次甲基碳正离子而亚甲基碳正离子变成亚甲基自由基。同理,与次甲基碳正离子紧邻的叔碳自由基p轨道上的一个电子也可以转移到次甲基碳正离子p轨道上,本身变成叔碳正离子而次甲基碳正离子得到一个电子变成次甲基自由基。最后,当亚甲基自由基与次甲基自由基之间的σ键旋转至两个各含一个电子的p轨道在同一平面时,两个p轨道发生“肩并肩”重叠,形成新的π键。
(3)技巧三:寻找与π键紧邻的自由基
自由基单电子可与π键中的一个电子形成新的π键,产生新的自由基。例如:

我们知道,碳碳双键由一个σ键和一个π键组成,π键是由两个处于同一平面的且各含有一个电子的p轨道“肩并肩”重叠而成。从某种意义上讲,我们可以把π键看作两个紧密相邻的“双自由基”。在本例中,如果把双键看作两个紧密相邻的“双自由基”,那么左边共振式就是次甲基自由基上的p轨道与叔碳自由基上的p轨道“肩并肩”重叠,形成π键;右边的共振式是亚甲基自由基上的p轨道与次甲基自由基上的p轨道“肩并肩”重叠,形成一个新的π键。
(4)技巧四:寻找与π键相邻的孤对电子
孤对电子将π电子推向π键的远端,带孤对电子的原子与原π键近端形成新的π键。例如:

在本例中,氧负离子负电荷的两个电子处在一个sp3杂化轨道上,相对半充满或全空轨道而言,显然电子比较拥挤,能量比较高。因此,当C-O σ键旋转至氧负离子负电荷所在的sp3杂化轨道与π键中的两个p轨道在同一平面时,氧负离子的负电荷对与其紧密相邻的碳原子p轨道上的一个电子由排斥作用,该碳原子p轨道上的一个电子被推至亚甲基碳自由基,本身变成碳正离子而亚甲基自由基变成碳负离子。然后,氧负离子sp3轨道上的两个电子转移一个到叔碳正离子上,本身由sp3杂化变成sp2杂化的氧原子而叔碳正离子变成叔碳自由基。当C-O σ键旋转至氧原子p轨道与叔碳自由基p轨道处于同一平面时,两个各含一个电子的p轨道发生“肩并肩”重叠,形成新的π键。
(5)技巧五:π键可在形成π键的两原子之间进行均裂
例如:

π键也可以在形成π键的两原子之间进行异裂,例如:

在有机反应中,共价键连接的两个原子或基团,如A-B,其断裂方式主要有两种,一种是形成共价键的两个电子平均分布到A和B上,生成的B和B各带一个未配对的电子。这种反应通常在光、热或自由基引发剂的作用下进行[12]。π键是由两个分别含有一个电子且处于同一平面的p轨道“肩并肩”重叠而成。从上述例子可以看出,当我们把两个各含有一个电子的p轨道分别看作一个自由基,那么,双键就等同于一个紧密相邻的“双自由基”。键的断裂方式与反应条件密切相关,当反应在酸、碱或极性条件下进行时,共价键的两个电子转移到A或B上。对于极性双键或叁键的断裂,π电子对通常落在电负性大的原子上。
特别值得注意的是,垂直于π键的孤对电子或空轨道,无法与π键发生相互作用。例如:
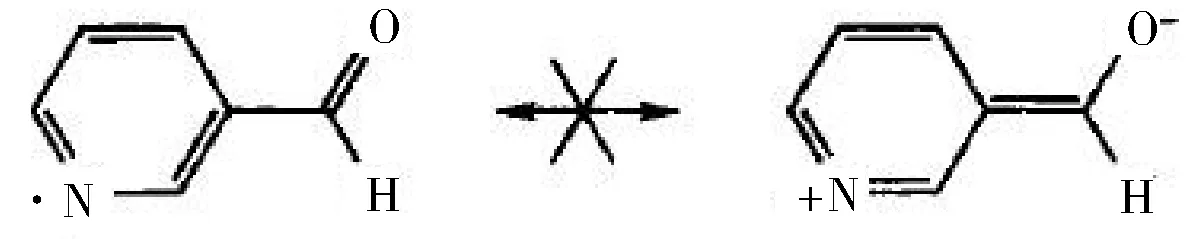
学生在书写过程中非常容易犯错误,主要问题是没有从微观、立体的角度去看N原子孤对电子所处的p轨道与吡啶芳香环的6个p轨道相互垂直。π键是由两个分别含有一个电子且处于同一平面的p轨道“肩并肩”重叠而成。当孤对电子锁处的轨道或者空轨道与π键的两个p轨道不在同一平面时,该轨道就无法与π键的两个p轨道发生“肩并肩”重叠,因此,无法与π键发生相互作用,不存在共振结构式。
2 结 语
路易斯(Lewis)酸碱理论认为,可给出电子的物质是碱,可接受电子对的物质是酸。根据这个理论,我们可以认为碳正离子、自由基、空轨道是酸;阴离子、孤对电子、π电子是碱。酸碱反应的实质是酸碱配合反应,即:酸的价电子层空轨道接受碱提供的孤对电子而形成配位键,A+:B=A:B。因此,我们也可以把有机分子看作路易斯酸和路易斯碱的复合物[13]。由此可见,我们可以这么认为,整个书写共振式的过程,实际上就是在分子内寻找路易斯酸与路易斯碱并不断发生各种分子内的路易斯酸碱配合反应,形成各种路易斯酸和碱复合物的过程。以上是关于有机化学反应机理中共振式书写的几点技巧,理解领会是基础,关键还是要多加践行、内化成自己的东西,在有机机理中共振式的书写才能得心应手。
——碳正离子的产生及稳定性比较

