黄瓜棒孢叶斑病菌实时荧光定量PCR方法的建立与应用
张艳菊,刘齐月,张 笛,陶 磊,王春龙,刘行风,李雪莲,马 天,刘 东
(东北农业大学农学院,哈尔滨 150030)
黄瓜棒孢叶斑病又称褐斑病、靶斑病。1906年首次在欧洲发现[1],目前中国[2]、美国[3]、日本[4]、韩国[5]等地均有发生和报道。近年来黄瓜棒孢叶斑病在我国黄瓜种植区发生严重,成为黄瓜生产主要病害之一[6]。黄瓜棒孢叶斑病一般在田间叶片发病率为10%~25%,严重时可达70%甚至100%[7]。黄瓜棒孢叶斑病菌侵染破坏力强、极易变异,防治难度超过黄瓜霜霉病,已由次要病害上升至世界主要病害[8]。当前黄瓜棒孢叶斑病在黑龙江地区黄瓜保护地生产中十分常见,危害较重。
引起黄瓜棒孢叶斑病病原菌为多主棒孢[Corynesporacassiicola(Berk &Curt)Wei],属于丝孢纲(Hyphomycetes)暗色菌科(Dematiaceae)棒孢属(Corynespora)真菌,1950 年统一定名为Corynespora cassiicola[9]。该病以危害叶片为主,根据不同温湿度条件,叶部病斑分为3 种类型:小型斑、大型斑、多角型斑[10]。由于易于流行、发病范围广、危害重且该病症状易与黄瓜霜霉病、黄瓜细菌性角斑病及黄瓜炭疽病混淆,因此建立准确、快速、灵敏、实用的黄瓜棒孢叶斑病菌检测方法及早期监测非常必要。
实时荧光定量PCR(Real-time fluorescence quantitative PCR)技术已广泛应用于植物病原真菌、细菌、病毒等多方面检测。在黄瓜棒孢叶斑病菌应用方面,孙炳学等建立一种快速、高效、定量检测黄瓜多主棒孢(Corynespora cassiicola)琥珀酸脱氢酶B 亚基(SdhB)H278R 突变的实时荧光定量PCR(AS-real-time PCR)检测方法[11]。高苇等设计一种检测土壤中黄瓜棒孢叶斑病菌的实时荧光定量PCR方法[12],但其试验模板为土壤,操作繁杂,难度大、成本高,且黄瓜棒孢叶斑病为气传病害[13],建立叶片病菌检测方法更适用于生产中病害的检测与预测。
本试验旨在设计一种快速、准确、灵敏的实时荧光定量PCR 方法,在侵染黄瓜叶片早期检测黄瓜棒孢叶斑病菌,为黄瓜棒孢叶斑病预测预报和监测提供技术支持。
1 材料与方法
1.1 供试菌株及菌株DNA提取
供试菌株:来自黑龙江省不同地区的5个黄瓜棒孢叶斑病菌株及7个黄瓜其他病害致病菌。黄瓜棒孢叶斑病菌(Corynespora cassiicola)为采集于黑龙江省并已鉴定的菌株,黄瓜霜霉病菌(Pseudoperonospora cubensis)及黄瓜白粉病菌(Sphaerothecacu curbitae)采自东北农业大学园艺实验站。黄瓜角斑病菌(Pseudomonas syringae)、黄瓜枯萎病菌(Fusarium oxysporum)、黄瓜黑斑病菌(Alternaria cucumerina)、黄瓜黑星病菌(Cladosporium cucumerinum)及黄瓜炭疽病菌(Colletotrichum orbiculare)由东北农业大学农学院植物病理研究室提供(见表1)。
供试作物品种:黄瓜(Cucumis sativusL.)感病品系D0401由东北农业大学园艺与园林学院黄瓜课题组提供。

表1 供试菌株名称和来源Table 1 Codes and origin of the isolates used in this study
黄瓜棒孢叶斑病菌(C.cassiicola)、黄瓜黑斑病菌(A.cucumerina)、黄瓜黑星病菌(C.cucumerinum)、黄瓜炭疽病菌(C.orbiculare)培养于马铃薯葡萄糖琼脂(PDA)平板;黄瓜枯萎病菌(F.oxysporum)培养于马铃薯蔗糖琼脂(PSA)平板;黄瓜霜霉病菌(P.cubensis)、黄瓜白粉病菌(S.cucurbitae)收集于新鲜黄瓜叶片;黄瓜角斑病菌(P.syringae)置于28 ℃King B培养基中120 r·min-1摇动生长。收集培养后菌株,利用CTAB 法提取供试真菌及卵菌基因组DNA[14],细菌基因组DNA采用改良CTAB法提取[15]。
1.2 特异性引物设计与验证
参考Wu等列举黄瓜棒孢叶斑病菌保守肌动蛋白序列actin[16],选定黄瓜棒孢叶斑病菌actin 参考序列(GenBank:MH511656.1)及其他供试病原菌actin 序 列(GenBank: HM148567; KF178566;JQ965663;JQ671742.1),利用DNAMAN 软件比对,Primier 6.0软件设计10对特异性引物,引物序列见表2,由吉林省库美生物科技有限公司合成,使用时将引物用ddH2O稀释至10 μmol·L-1。
将上述引物分别以供试菌株基因组DNA(10 ng·μL-1)为模板作普通PCR扩增,检测该引物对黄瓜棒孢叶斑病菌是否存在特异性。普通PCR反应体系为(25 μL):Premix Taq™12.5 μL、上下游引物(10 μmol·L-1)各0.5 μL、模板DNA(10 ng·μL-1)1 μL 和ddH2O 10.5 μL。阴性对照无DNA。扩增条件为:94 ℃预变性5 min,94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min。利用EPS-600 型电泳仪,Jel Doc 2001型凝胶成像系统(BIO-RAD,美国),1%琼脂糖凝胶电泳检测结果。
1.3 标准品制备
标准品为提纯的目的基因片段,用于制作实时荧光定量PCR 标准曲线。普通PCR 反应体系为(50 μL):Premix Taq ™25 μL、上下游引物(10 μmol·L-1)各1 μL、黄瓜棒孢叶斑病菌基因组DNA(10 ng·μL-1)2 μL 和ddH2O 21μL;扩增条件为:94 ℃预变性5 min,94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min。制备1%含EB 琼脂糖凝胶,取4 μL PCR产物,各加入2 μL 溴酚兰溶液,用DL2000 DNA Marker作对照,恒压电泳30 min,全自动凝胶成像系统观察并拍照。将PCR扩增产物胶回收(南京维诺赞生物技术有限公司),回收产物经1%琼脂糖凝胶电泳检测是否存在目的基因条带,若条带存在则将胶回收产物送吉林库美生物有限责任公司测序。
1.4 黄瓜棒孢叶斑菌实时荧光定量PCR体系建立与优化
1.4.1 实时荧光定量PCR反应条件优化
本文将层次分析的方法应用在矿井设计方案中,初步尝试决策方法,应用的结果证明,层次分析的方法非常简单实用,具有系统性、逻辑性和灵活性,在采矿领域里,除了选择矿井设计方案之外,还可以进行系统优化、采矿方案优化等,各类资源的设计、分配都可以实用层次分析法进行判断和处理。
为建立适合黄瓜棒孢叶斑病菌实时荧光定量PCR 反应体系,优化退火温度、模板浓度及引物浓度。
①退火温度:将退火温度设置为57、58、60、62 ℃4个退火温度。
②模板浓度:根据不同浓度模板DNA 对产物扩增效率及反应荧光吸收强度的影响,设置模板含量为1、2、3 μL(10 ng·μL-1),确定合适体系DNA模板浓度。
③引物浓度:根据反应熔解曲线和产物扩增效率,将引物含量设置为0.2、0.3、0.4 μL(10 μmol·L-1)。
实时荧光定量PCR 反应体系为(20 μL):10 μL Taq SYBR®Green qPCR Premix,0.2~0.4 μL 上下游混合引物(10 μmol·L-1),1~3 μL(10 ng·μL-1)模板DNA,ddH2O 补齐至20 μL。扩增条件为:94 ℃预变性3 min,94 ℃变性10 s,52~58 ℃退火30 s,72 ℃延伸15 s,40个循环;72 ℃延伸5 min。
1.4.2 建立标准曲线
将标准品10 倍梯度稀释,得到浓度梯度依次为1.36×101~1.36×10-7ng·μL-1模板DNA。每个浓度3 次重复,空白对照为灭菌ddH2O。利用已筛选反应程序及反应体系作实时荧光定量PCR,以起始浓度对数值为X 轴,以Cq 值为Y 轴构建标准曲线。标准曲线由实时荧光定量PCR软件自动生成。
1.4.3 灵敏度与重复性试验
将10 倍梯度稀释的黄瓜棒孢叶斑病菌标准品作为模板作实时荧光定量PCR,确定该体系检测黄瓜棒孢叶斑病菌最小浓度。
将3个稀释浓度标准品作批次内和批次间重复性试验,验证该检测方法稳定性。批内重复试验可对同一样品同时测定3次重复,批间重复可在不同时间对同一样品模板测定3次重复。SPSS 16.0统计软件计算Cq值,得到相应标准差SD及变异系数CV,变异系数CV 小于2%时,认为该反应体系重复性与稳定性良好。
1.5 实时荧光定量PCR 定量检测黄瓜叶片棒孢叶斑病菌潜伏侵染量动态变化
1.5.1 供试菌株及作物
供试菌株:黄瓜棒孢叶斑病菌(Corynespora cassiicola),采自东北农业大学园艺实验站。供试作物品种:黄瓜高抗品种D9320(HR)、抗病品种美国小黄瓜(R)、中抗品种北京301(MR)、感病品种D805(S)、高感品种D0401(HS),由东北农业大学黄瓜课题组提供。
1.5.2 育苗及接种
将5 个不同品种黄瓜种子播种于育苗穴盘中,7 d 后子叶展平时将幼苗移入营养钵内,每钵留1株。白天25 ℃,夜晚15 ℃正常管理。待黄瓜第1片真叶展平时取下,将真叶打成直径20 mm 叶盘。配制浓度为1×105个·mL-1黄瓜棒孢叶斑病菌孢子悬浮液,每个叶盘接种3滴浓度1×105个孢子·mL-1菌悬液,每滴10 μL,每个处理15 个叶盘,3 次重复,接种ddH2O设为对照,接菌后注意保湿避光。
1.5.3 采集样品并调查病情指数
接种2、4、8、12、24、36、48、96 和120 h后各取样1次,每次不同品种各采集3个叶盘,3次重复。清水反复冲洗后置于离心管中备用。同时调查发病情况。病情分级标准为[17]:0级:无病症;1级:病斑面积占叶面积5%以下;2级:病斑面积占叶盘面积5%~25%;3 级:病斑面积占叶盘面积25%~50%;4级:病斑面积占叶盘面积50%以上。
1.5.4 提取样品DNA并检测侵染量
将收集的叶盘剪碎,混匀,称取0.1 g,利用CTAB法提取黄瓜叶片基因组DNA。以得到的基因组DNA 为模板,应用已优化的实时荧光定量PCR体系检测黄瓜棒孢叶斑病菌侵染黄瓜叶片侵染量。根据标准曲线,计算每个时段黄瓜叶片内棒孢叶斑病菌浓度。
2 结果与分析
2.1 黄瓜棒孢叶斑病菌引物特异性检测
提取供试菌株基因组DNA经1%琼脂糖凝胶电泳检测,结果如图1 所示。病原菌DNA 条带清晰明亮,提取的DNA 具有较高浓度和纯度,可用作底物模板以满足下一步试验要求。
表2为10对引物特异性检测结果,“+”表示琼脂糖凝胶电泳检测有条带,“-”表示琼脂糖凝胶电泳检测无条带,结果显示引物CAF2/CAR2 对黄瓜棒孢叶斑病菌具有良好特异性。
引 物CAF2(5'GCCTCGAGCTGTTTTCCGTAAG T3')/CAR2(5'CCGATCATGATACTGGCAGT GGTC3')扩增的来自不同地区黄瓜棒孢叶斑病菌和其他黄瓜病原菌琼脂糖凝胶电泳结果见图2。可见仅黄瓜棒孢叶斑病菌扩增出186 bp 特异性条带,而其他黄瓜病害病原菌无条带,表明引物CAF2/CAR2 可用作黄瓜棒孢叶斑病菌特异性引物。
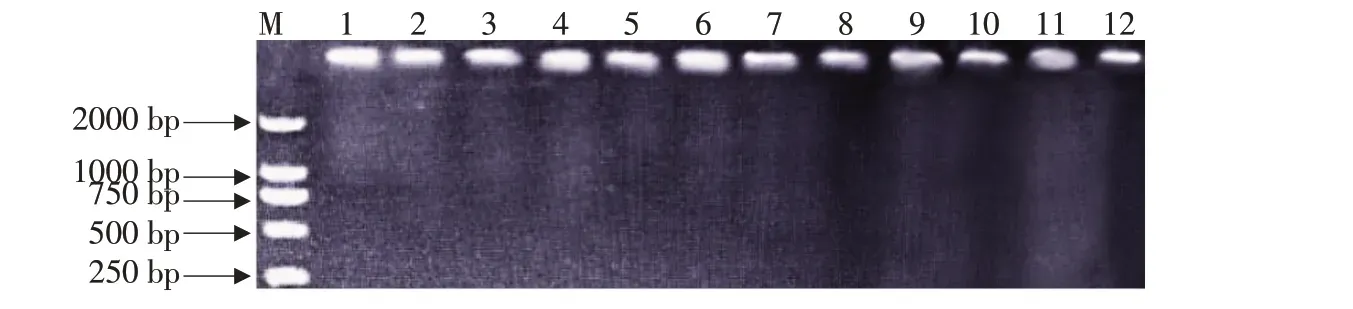
图1 病原菌DNA检测电泳结果Fig.1 Electrophoresis results of pathogen DNA
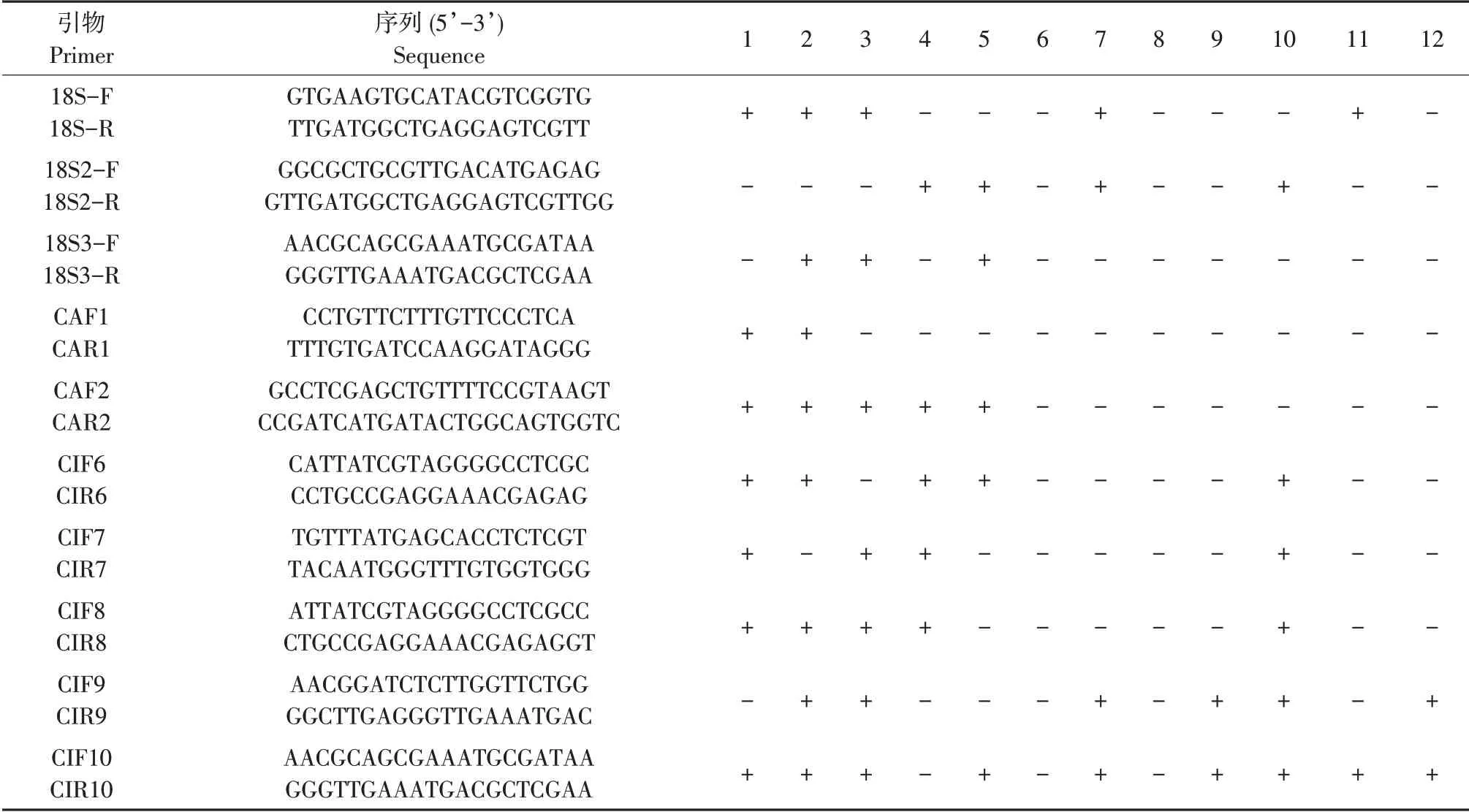
表2 引物特异性检测结果Table 2 Primer pairs used in this study and the specific test result

图2 引物CAF2/CAR2对黄瓜棒孢叶斑病菌特异性检测结果Fig.2 Specific detection results of cucumber target leaf spot by primer CAF2/CAR2
2.2 目的基因鉴定
将胶回收纯化后(见图3)目的基因产物送至吉林库美生物有限责任公司测序。结果表明,CAF2/CAR2 扩增出的黄瓜棒孢叶斑病菌目的基因为186 bp。

图3 胶回收电泳结果Fig.3 Gel recovery product detection electropherogram
其序列如下:CTTAACCGTAAACTATGCCGA CTAGGGATCGGGCGATGTTTCTATCTTGACTCGCT CGGCACCTTACGAGAAATCAAAGTTTTTGGGTTCT GGGGGGAGTATGGTCGCAAGGCTGAAACTTAAAG AAATTGACGGAAGGGCACCACCAGGCGTGGAGCC TGCGGCTTAATTTGACTCAACACGGGGAAA。
2.3 黄瓜棒孢叶斑病菌实时荧光定量PCR 体系建立与优化
2.3.1 退火温度
3 种浓度模板在退火温度为57、58、60 和62 ℃下平均Cq 值和荧光信号强度见表3。可见,模板浓度相同时,退火温度60 ℃,Cq 值最小,对应荧光信号强度最强,表明该反应在60 ℃时具有较高扩增效率。而在其他退火温度下,反应扩增效率低、不稳定。因此,当退火温度为60 ℃时,实时荧光定量PCR反应最稳定。
2.3.2 模板浓度
将黄瓜棒孢叶斑病菌DNA 模板分别以1、2 和3 μL(10 μmol·L-1)添加至反应体系,根据熔解曲线稳定性确定合适的DNA 模板浓度,如图4 所示。当模板加入量为3 μL 时,曲线总体稳定,加入量为1或2 μL时,熔解曲线与3μL浓度相比,表达不稳定。因此,当检测系统中DNA 模板量为3μL时,更有利于样品基因表达。
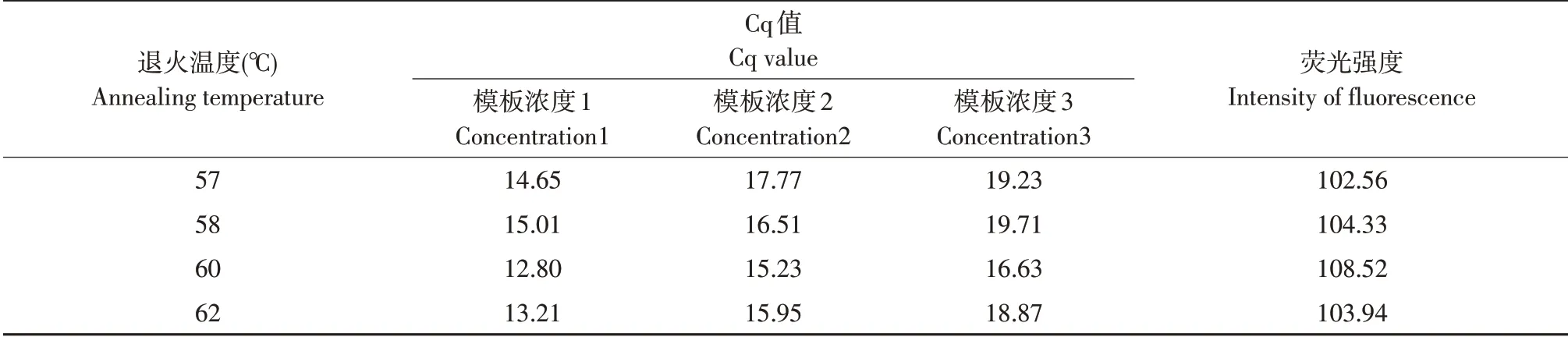
表3 不同退火温度下实时荧光定量PCR Cq值和荧光强度Table 3 Cq value and intensity of fluorescence signal in different annealing temperature

图4 不同DNA浓度熔解曲线Fig.4 Melting curves of different DNA concentrations
2.3.3 引物浓度
引物以0.2、0.3 和0.4 μL(10 μmol·L-1)添加到反应系统中时,可根据熔解曲线确定适合引物量(见图5)。
由图5 可知,当体系中引物量为0.2 μL(10 μmol·L-1)时,熔解曲线表达最稳定。当引物添加量为0.3 或0.4 μL 时,反应熔解曲线明显不一致,且曲线导数不同。当引物添加0.2 μL 时,熔解曲线显示相同趋势,反应过程更稳定。因此,体系中引物最适添加量为0.2 μL(10 μmol·L-1)。
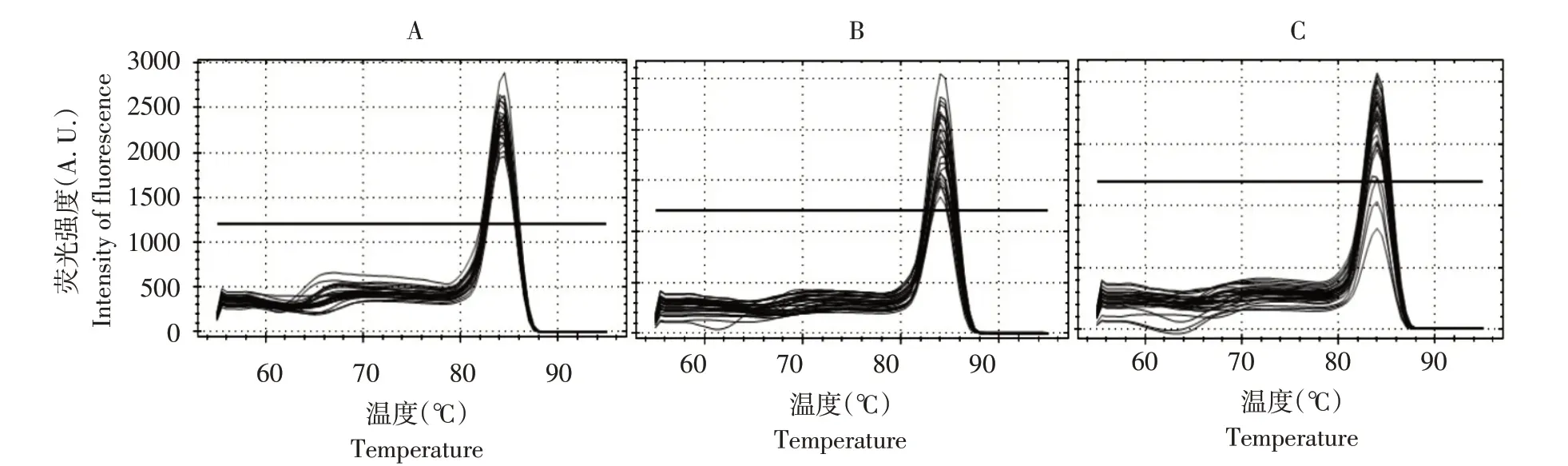
图5 不同引物浓度熔解曲线Fig.5 Melting curves of different primer concentrations
2.4 黄瓜棒孢叶斑病菌实时荧光定量PCR标准曲线建立
应用上述优化实时荧光定量PCR 体系,对浓度梯度为1.36×101~1.36×10-7ng·μL-1标准品作实时荧光定量PCR 处理,获得各自Cq 值(见表4),标准曲线见图6。由于1.36×101~1.36×10-7ng·μL-1间浓度拷贝数与其对应Cq值具有良好线性关系,因此选择此浓度梯度为模板。标准曲线相关系数R2为0.995(>0.95),斜率为-3.54(-3.58~-3.10),扩增效率为108.23%(90%~110%)。标准曲线公式为y=28.06-3.54x。
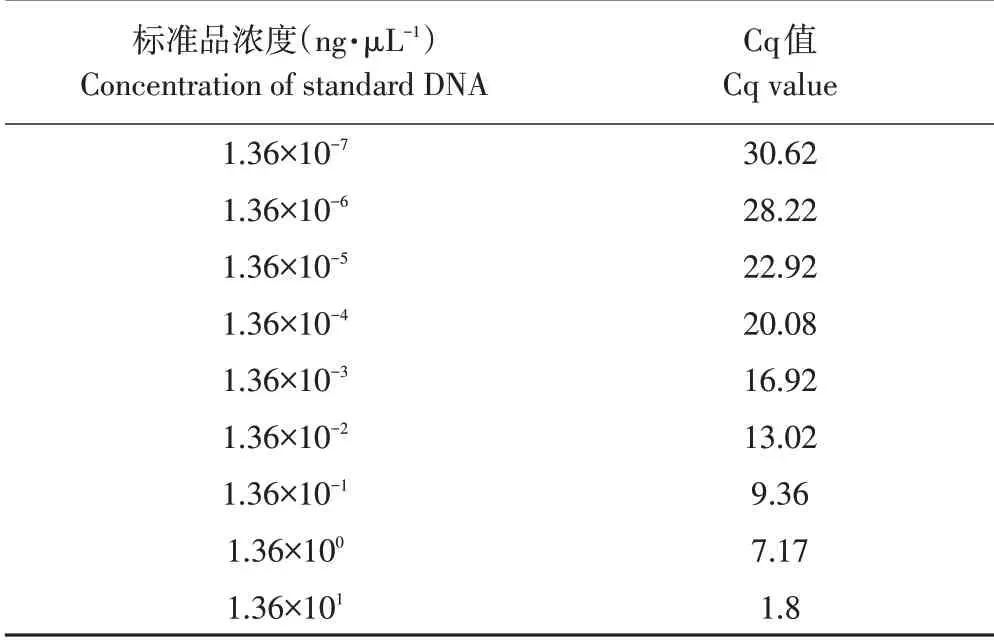
表4 浓度梯度标准品对应Cq值Table 4 Cq value of concentration gradient standard DNA
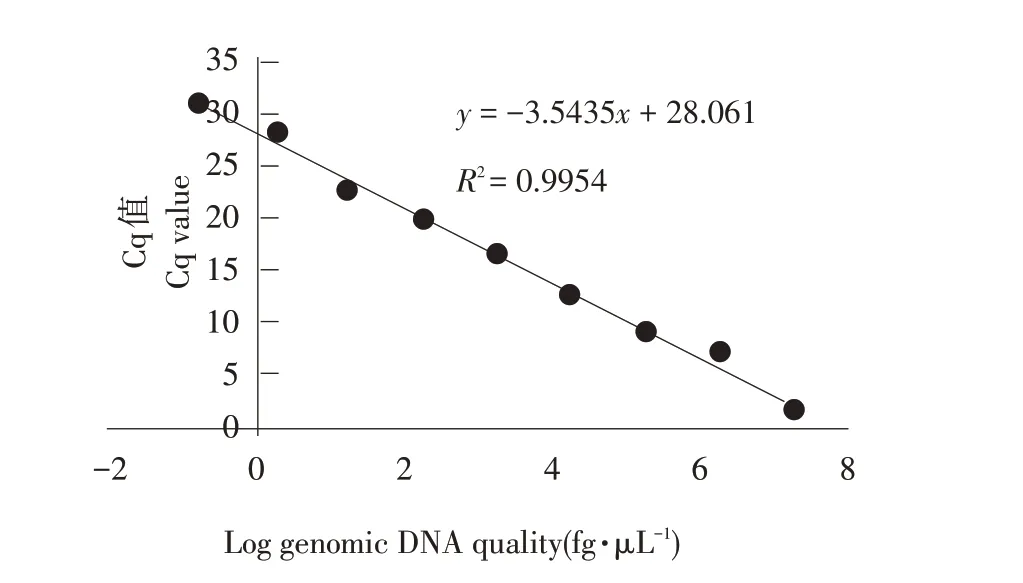
图6 黄瓜棒孢叶斑病菌实时荧光定量PCR标准曲线Fig.6 Standard curve of Corynespora cassiicola using real-timefluorescence quantitativePCR
2.5 黄瓜棒孢叶斑病菌实时荧光定量PCR 灵敏度、稳定性和可重复性检验
选择1.36×10-1~1.36×10-7ng·μL-110 倍浓度梯度的7 个标准品作实时荧光定量PCR 反应(如图7 所示),检测到标准品DNA 最小浓度为1.36×10-6ng·μL-1。
为验证该体系可重复性和稳定性,测试3个浓度标准品批次内和批次间重复性。表5所示为反应Cq 值、标准差和变异系数,其中组内和组间重复变异系数均小于2%,说明该体系具有良好的可重复性和稳定性。
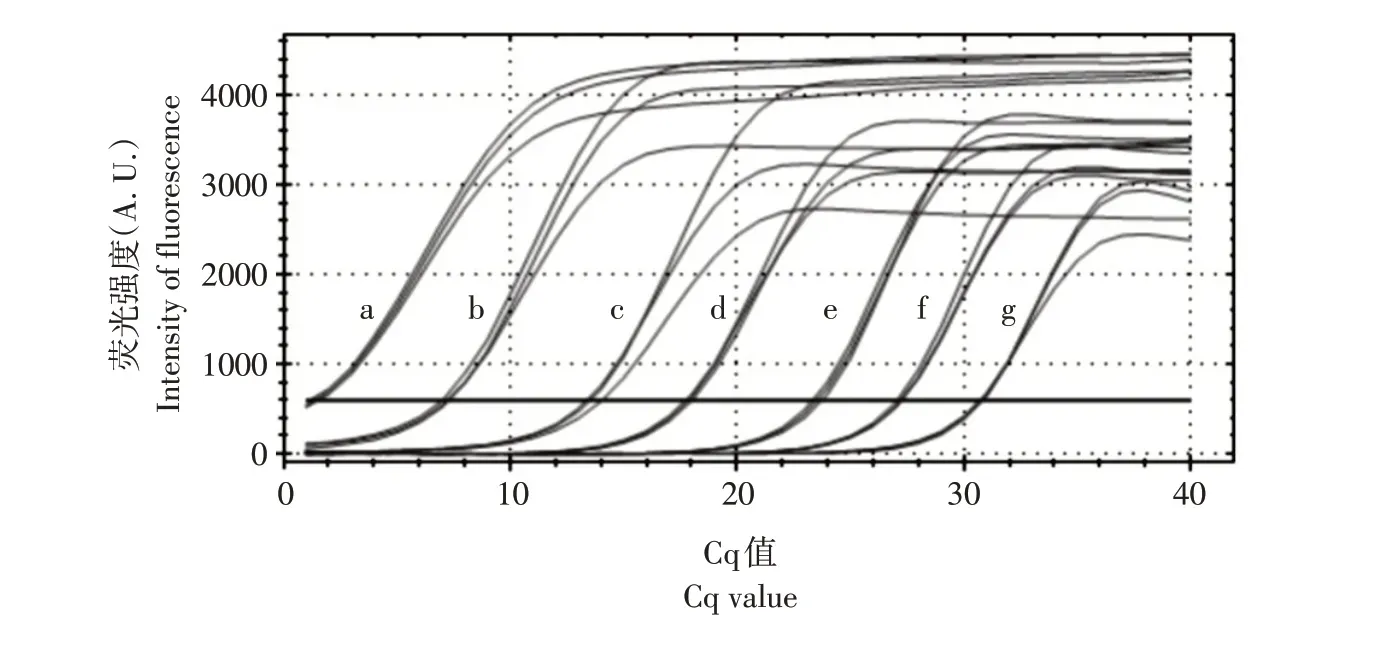
图7 实时荧光定量PCR灵敏感度检测Fig.7 Sensitivity detection of primers by real-time fluorescence quantitative PCR
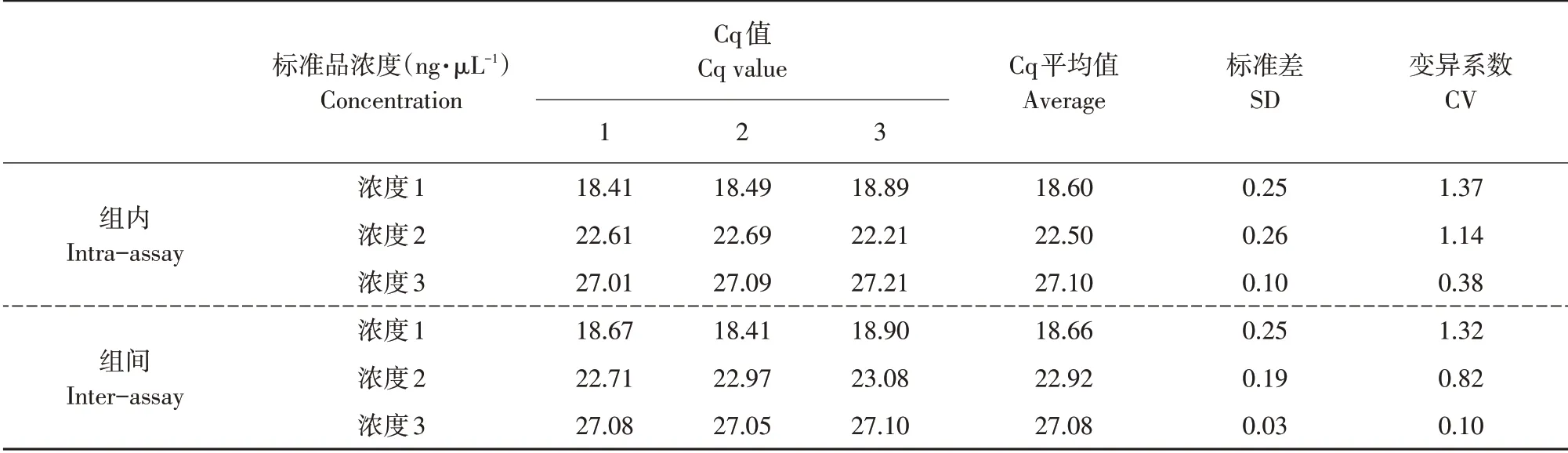
表5 黄瓜棒孢叶斑病菌实时荧光定量PCR体系稳定性检测Table 5 Stability detection of real-time fluorescence quantitative PCR system for Corynespora cassiicola
2.6 应用实时荧光定量PCR检测黄瓜叶片中棒孢叶斑病菌潜伏侵染量动态变化
2.6.1 黄瓜接种后发病情况
黄瓜棒孢叶斑病菌点滴接种黄瓜真叶叶盘后,将温度控制在17~25 ℃,相对湿度80%以上,参考黄瓜棒孢叶斑病菌病情分级标准[17],发病症状及病情级别如图8 所示,其中A 表示0 级发病植株叶片症状;B表示1级发病植株叶片症状;C表示2级发病植株叶片症状;D表示3级发病植株叶片症状;E表示4级发病植株叶片症状。
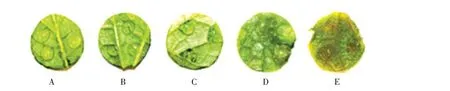
图8 黄瓜棒孢叶斑病不同级别发病症状Fig.8 Symptoms of cucumber target leaf spot with different disease level
2.6.2 接种后不同时间黄瓜叶片病情级别及叶片带菌量
表6为黄瓜棒孢叶斑病菌接种5种不同抗性黄瓜真叶叶盘后病情级别及病菌在植物组织内潜伏侵染量Cq值变化及病菌浓度。Cq值大于30表示病菌未侵染黄瓜叶片,可将此部分忽略不计。病情级别调查结果说明不同抗性黄瓜品种潜伏期表现不同,对于高抗品种,黄瓜棒孢叶斑病菌潜伏期最长,为96 h;抗性品种与中抗品种病菌潜伏期为48 h;感病品种与高感品种病菌潜伏期为24 与12 h。而Cq 值反映黄瓜棒孢叶斑病菌真正开始侵染黄瓜叶片时间:对于高抗品种、抗性品种、中抗品种,黄瓜棒孢叶斑病菌侵染时间为接种后8 h,对于感病品种与高感品种,接种后4 h 即可检出。由此可见,实时荧光定量PCR 检测可在黄瓜叶片外观无任何症状时即检测到黄瓜棒孢叶斑病菌存在,证明其快速灵敏的特点,也为不同抗性黄瓜品种防治时间选择提供理论依据。表6 还可看出,未接种黄瓜叶片CK 无Cq 值,说明寄主DNA 不影响病菌检测。

表6 接种后不同时间黄瓜叶片病情级别及叶片带菌量Table 6 Disease level and amount of Corynespora cassiicola in cucumber leaves at different times after inoculation
3 讨论与结论
黄瓜棒孢叶斑病是主要侵染黄瓜叶片、通过气流传播的病害。该病流行迅速且难以防治,症状又易与其他黄瓜病害混淆,特别是在早期阶段,难以通过症状直接区分。而实时荧光定量PCR 技术可灵敏、特异地识别并量化空气和植物中病原菌,因此本试验筛选出一对黄瓜棒孢叶斑病菌特异性引物CAF2/CAR2,该引物可区分黄瓜棒孢叶斑病菌与其他几种在症状上易混淆的黄瓜致病菌。同时优化实时荧光定量PCR 反应条件,建立黄瓜棒孢叶斑病菌实时荧光定量PCR 检测方法。可在病菌侵染早期快速、准确鉴定黄瓜棒孢叶斑病,还可用于监测黄瓜棒孢叶斑病菌动态变化,指导病害科学防治,防止病害爆发流行。
在实时荧光定量PCR 方法选择上,本研究选用荧光染料SYBR GreenⅠ法,与Taq Man 探针法相比,该方法可监测任何dsDNA 序列扩增,检测方法较为简单,成本较低[18]。实时荧光定量PCR有相对定量和绝对定量两种,相对定量是在一定样本中靶序列相对于另一参照样本量的变化,即比较处理样本和未处理样本相对基因的表达差异[19],而绝对定量是根据标准曲线得到样本拷贝数进而对未知样本定量。本研究并未涉及与另一参照样本比较,因此明确叶片中黄瓜棒孢叶斑病菌侵染量及动态变化,选择绝对定量法更简洁快速,成本更低。
与已报道检测土壤中黄瓜棒孢叶斑病菌实时荧光定量PCR体系相比[12],本体系更适用于黄瓜叶片中病菌检测。以此检测方法为基础,可开展田间黄瓜棒孢叶斑病监测与预测预报工作,在田间仅需采集黄瓜叶片并作荧光定量PCR 检测,即可明确黄瓜棒孢叶斑病菌有无及侵染量,为病害流行监测提供依据。
黄瓜棒孢叶斑病菌人工接种通常采用叶片喷雾接种法[20],难以控制接菌量,本研究需对叶片中病菌精确定量,因此选择点滴接种法。与喷雾接种法相比,该方法保证每个叶盘接种菌量相同,保证后续定量检测结果准确性。截止目前,叶盘发病病情分级尚无通用标准,本研究参考棒孢叶斑病通用分级标准[17],将黄瓜叶片等比例缩放后判断叶盘病情级别,黄瓜感病品种接种棒孢叶斑病菌至肉眼可观察到病斑为24 h 左右,与Sharma[21]与Liu 等[22]研究结果相同。本研究建立实施荧光定量PCR 方法应用于黄瓜叶片中棒孢叶斑病菌潜伏侵染量检测,明确黄瓜棒孢叶斑病在5种不同抗性黄瓜品种上的侵染时间,结合栽培品种抗病性,在生产实践中可为黄瓜棒孢叶斑病防治提供参考。

