红鳍东方鲀及杂交鲀的脑和肾脏转录组比较分析
刘福君 保明秀 荆笛


摘要 为探究杂交鲀(红鳍东方鲀×菊黄东方鲀)与红鳍东方鲀差异的分子调节机制,利用Illumina高通量测序技术对红鳍东方鲀及杂交鲀的脑、肾脏样本组织进行转录组测序,筛选差异表达基因。结果表明:通过RNA-seq技术共筛选到2 207个DEGs (脑)和1 823个DEGs (肾脏)。其中在脑组织样本中有1 068个DEGs表达上调,1 139个DEGs表达下调,肾脏组织样本中有851个DEGs表达上调,972个DEGs表达下调;通过GO功能分类与KEGG富集分析,将脑组织的差异基因区分为60个功能类别及137个代谢途径,包括G蛋白偶联受体信号通路、跨膜转运、分子功能调节剂、钙离子结合等;肾脏组织的差异基因被区分为31个功能分类及142个代谢途径,包括氧化还原酶活性、肽酶活性、蛋白水解、细胞外区域等。该研究探讨了杂交鲀与红鳍东方鲀生长发育差异过程的相关分子调控机制,可为后续相关研究提供初步理论参考与依据。
关键词 红鳍东方鲀;转录组;高通量测序;功能注释
Abstract The study is to explore the molecular regulatory mechanism of the differences between the hybrid puffers fish(Takifugu rubripes×Takifugu flavidus) and Takifugu rubripes.In this study, Illumina highthroughput sequencing technology was used to sequence transcriptomes of the brain and kidney samples of Takifugu rubripes and hybrid puffers, screen differentially expressed genes. The results showed that 2 207 DEGs (brain) and 1 823 DEGs (kidney) were screened by RNAseq technology.Among them,1 068 DEGs were upregulated and 1 139 DEGs were downregulated in brain samples.And 851 DEGs were upregulated and 972 DEGs were downregulated in kidney samples.Through GO functional classification and KEGG enrichment analysis, the differential genes were divided into 60 functional categories and 137 metabolic pathways in the brain samples,which included Gprotein coupled receptor signaling pathway, transmembrane transport, molecular function regulator and calcium ion binding,etc..Differential genes in kidney tissue were divided into 31 functional categories and 142 metabolic pathways, which included oxidoreductase activity, peptidase activity, proteolysis and extracellular region,etc..This study discussed the mechanism of molecular regulation in the process of growth and development differences between hybrid puffers fish and Takifugu rubripes,which can provide a preliminary theoretical reference and basis for the followup research.
Key words Takifugu rubripes;Transcriptome;Highthroughput sequencing;Function notes
將带有不同遗传性状的两个亲本进行杂交,产生的子代所具备的性状均优于双亲的生物学现象,称为杂交优势(heterosis,hybrid vigor),比如杂交后代的抗逆性、早熟高产、品质优越等生物学现象。水产方面,我国成功培育了许多杂交鲤,如兴国红鲤与散鳞镜鲤杂交产生的丰鲤、荷包红鲤与沅江鲤杂交产生的荷沅鲤和建鲤、荷包红鲤与湘江野鲤杂交产生的岳鲤等,研究发现杂交鲤产量至少增加30%,多者可达2.5倍以上[1-3],另外将鲫鱼与其远缘杂交的后代具有肉质鲜美、生长速度快、广食性等优点[4-5]。
东方鲀属属于硬骨鱼纲(Osteichthyes),鲀形目(Tetraodontiformes),鲀亚目(Tetraodontidei),鲀科(Tetraodontidae),在我国主要分布于东海、黄海及渤海[6],周边地区主要分布在朝鲜半岛和北太平洋西部的日本,代表物种是红鳍东方鲀和菊黄东方鲀,其肉质营养丰富,蛋白含量高,是一种高经济价值的鱼类[7]。但是菊黄东方鲀的生长速度较慢,而红鳍东方鲀是东方鲀中生长速率最快、体型最大的种类[8-9]。已有相关研究显示红鳍东方鲀和菊黄东方鲀的杂交后代,具有养殖存活率高、生长速度快等优良性状,可利用其杂交优势来进行增产增效。
转录组(transcriptome)有广义与狭义上的解释。广义上转录组是指在特定条件下的细胞或组织的所有RNA总和,包括非编码RNA (noncoding RNA)和信使RNA (mRNA),狭义上转录组是指细胞内全部转录出来的信使RNA,转录组具有空间与时间的限制,通过提供相应基因的时空表达情况来进一步确定其生理调节机制,具有高通量、高灵敏度、高准确性及成本相对较低等优势,目前已广泛应用于各种生物转录组的研究[10-12]。
该研究利用Illumina高通量测序技术对红鳍东方鲀及杂交鲀进行转录组测序及比较分析,测序数据通过筛选、拼接和组装,然后再进行功能分类、功能注释及代谢途径分析,以期为后期深入研究杂交河鲀生长发育的分子调控机制提供理论参考。
1 材料与方法
1.1 供试材料 试验用鱼为大连天正实业有限公司唐山咀东养殖场的红鳍东方鲀和杂交鲀(红鳍东方鲀×菊黄东方鲀),同一批孵化及同条件饲养情况下挑选活力较强、体格健壮、身体无损伤的成鱼各10条。采样所需的剪、咬骨钳、镊子、刀等器械均事先通过高压灭菌锅进行121 ℃,2 h灭菌,采样前使用75%乙醇擦拭且经火焰消毒。将试验鱼现场解剖,分别取全脑及肾脏组织储存于10倍体积的RNA later中,以便后续总RNA提取。
1.2 总RNA提取 cDNA文库构建和测序
利用RNA提取试剂盒提取红鳍东方鲀和杂交鲀(红鳍东方鲀×菊黄东方鲀)的总RNA。为了保证试验数据的高质量,上述提取的总RNA需要进行琼脂糖凝胶电泳、紫外分光光度计和Aglient 2100方法检测,主要包括样品浓度、纯度及完整性,A260/A280、A260/A230、28S/18S、RIN (RNA integrity number)。RNA质量要求有如下指标:RIN=7.0,A260/A280为1.8~2.0,28S/18S为1.5。通过完整性及纯度检测后,使用Oligo(dT)磁珠纯化和进行mRNA的富集,随后进行mRNA的分离及片段化,合成一链和二链cDNA。之后再进行3′末端加A,连接测序接头末端修复,而后用AMPure XP beads筛选250~300 bp的cDNA,最后富集cDNA文库。将上述cDNA文库进行Illumina测序,首先过滤原始数据中低质量、末端质量低、含测序引物的reads,得到clean reads,然后再进行de novo拼接,最后通过CAP3软件拼接来获得最终Unigene序列集合[13]。使用DEGseq软件找寻筛选差异表达基因(differentially expressed genes,DEGs)时以P<0.05作为标准[14]。
1.3 差异表达基因GO与KEGG富集分析
通过FPKM (fragments per kilobase of transcript per million fragments mapped)[14]方法对Unigenes进行DEGs表达量计算。通过软件cuffdiff来分析转录本与基因水平上的差异表达,差异表达的基因和转录本需要满足以下标准:计算表达倍数变化(fold change),需要|log2 FoldChange|>1;2个样本中mapping reads数之和≥10;对P进行FDR校正得到Q,同时需要P≤0.05及Q≤1。最后将所得的差异表达基因单独进行聚类分析、Pathway分析和GO功能分析。
2 結果与分析
2.1 转录组数据质控分析
分别取红鳍东方鲀脑组织(H_B1)、肾脏组织(H_L1),杂交鲀(红鳍东方鲀×菊黄东方鲀)的脑组织(Z_B2)和肾脏组织(Z_L2),利用RNA-seq技术对样品文库进行测序,分别得到Raw reads 59 463 756、48 936 330、49 340 508和49 165 672条;去除N含量超过10% (containing N)、带有接头(adapter related)和低质量(low quality)的reads以后得到Clean reads分别为58 214 792、48 236 284、48 530 284和47 363 626;Phred值大于20、30的碱基比例(Q20, Q30)分别为97.62%、98.20%、97.74%、98.12%(Q20)以及93.56%、94.75%、93.78、94.60% (Q30);总碱基数中碱基C和G数量总和占比分别为48.92%、53.79%、48.98%和52.56%(表1)。
2.2 差异基因的筛选
根据FPKM法[15-16]对样品间差异进行分析,分别用红色、蓝色和绿色表示显著上调基因、显著下调基因和无显著性差异基因,结果显示共得到差异表达基因(DEGs)共2 207个(脑组织,图1)和1 823个(肾脏组织,图2)。其中杂交鲀的脑组织样本相对于红鳍东方鲀的脑组织样本表达上调的DEGs有1 068个,表达下调的有1 139个。各差异表达基因的水平不同(log2FoldChange高度不同),差异水平变化主要存在于>2~≤7 (上调基因占48.36%, 下调基因占51.64%),其次为>0~≤2 (上调基因占45.23%,下调基因占54.77%),最后是>7~≤15 (上调基因占71.33%,下调基因占28.67%);而杂交鲀的肾脏组织样本相对于红鳍东方鲀的肾脏组织样本表达上调的有851个,表达下调的有972个,同样主要集中在>2~≤7 (上调基因占39.66%, 下调基因占60.34%),其次为0~≤2 (上调基因占55.14%, 下调基因占44.86%),最后是>7~≤15 (上调基因占49.36%,下调基因占50.64%) (表2)。
2.3 差异基因GO分析
差异表达基因经过GO富集分析可分为三大类,分别是描述基因产物及个体基因的分子功能(molecular function, MF),描述亚细胞结构、位置及大分子复合体的细胞组成(cellular component, CC)与描述参与基因编码的生物学过程(biological process, BP)。对筛选到的差异表达基因进行GO富集分析,结果显示在红鳍东方鲀和杂交鲀的脑组织样本中,差异表达基因可主要归纳于35个生物学过程、15个细胞组成以及10个分子功能(图3)。
在生物学过程中以G蛋白偶联受体信号通路(G-protein coupled receptor signaling pathway) (70个)和跨膜转运(transmembranetransport) (66个)存在较多差异表达基因;在分子功能方面,差异表达基因集中于分子功能调节剂(molecular function regulator) (69个)以及钙离子结合(calcium ion binding)(66个)。
而在肾脏组织样本中,差异表达基因主要归纳于26个分子功能、4个生物学功能和1个细胞组成(图4)。差异表达基因在分子功能中以氧化还原酶活性(oxidoreductase activity) (70个)和肽酶活性(peptidase activity) (66个)居多;生物学过程上集中在氧化还原过程(oxidationreduction process) (66个)及蛋白水解(proteolysis) (65个);在细胞组成上则存在于细胞外区域(extracellular region) (51个)。结果表明红鳍东方鲀和菊黄东方鲀的杂交后代在生长发育上主要是通过以上富集途径的差异表达基因来调控的。
2.4 KEGG代谢途径分析
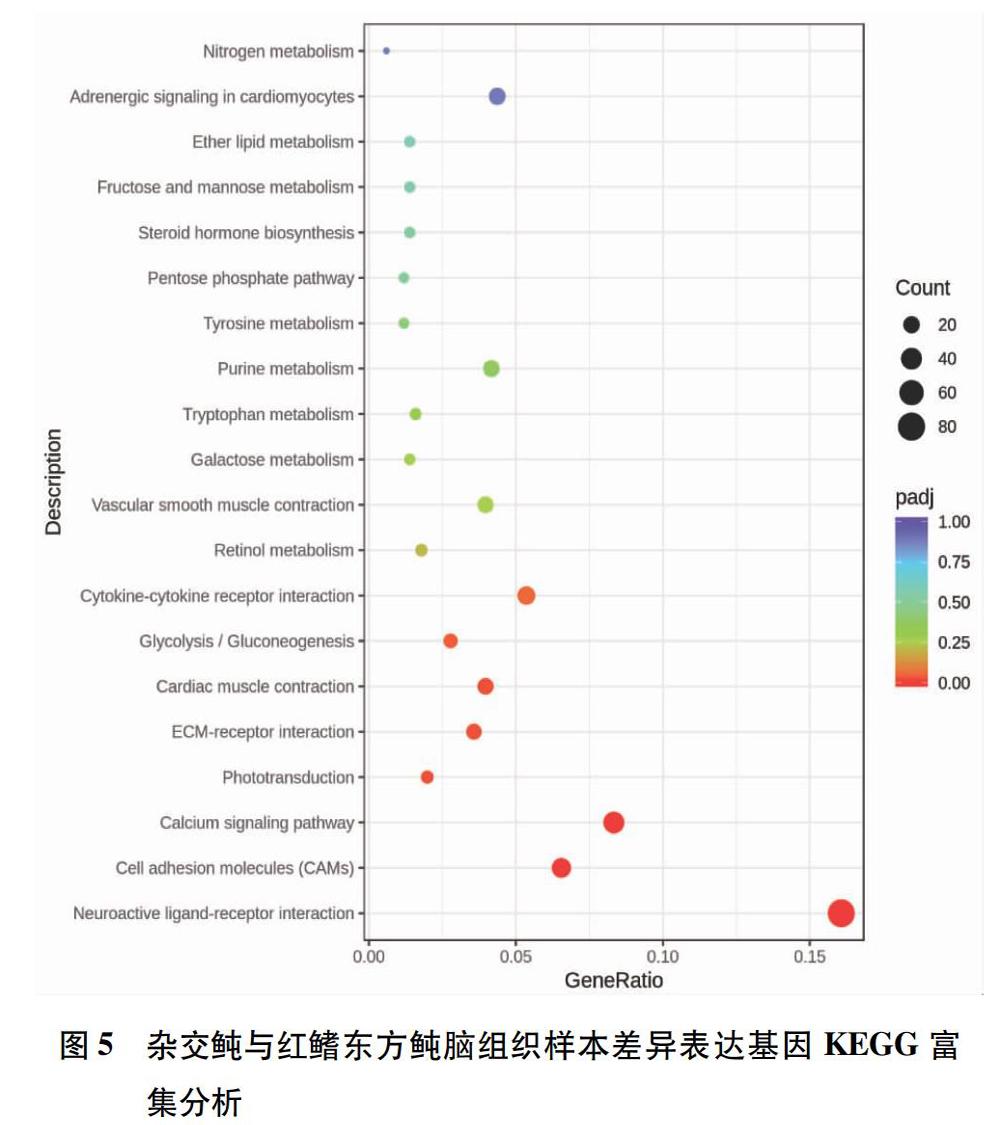
选取padj值最小的前20条通路(pathway),以颜色来区分不同padj范围,点的大小来表示注释到KEGG通路编号上的差异基因数,从而绘制散点图。如图5所示,脑组织样品经过KEGG富集分析共建立了137条pathway,在神经活性配体-受体相互作用(neuroactive ligandreceptor interaction)中差异表达基因最多,共有81个;其次为钙信号通路(calcium signaling pathway),达42个;细胞黏附分子(cell adhesion molecules,CAMs)达33个。另一方面,肾脏组织样品经KEGG富集分析共建立了142条pathway,其中神经活性配体-受体相互作用达40个;NOD样受体信号通路(NODlike receptor signaling pathway)达30个(图6)。这些通路的padj值较小,说明这些通路的富集程度较高。结果表明红鳍东方鲀和杂交鲀的脑组织和肾脏组织样品中以神经活性配体-受体相互作用中相关差异基因的表达最为活跃。
3 讨论与结论
通常情况下杂交后代会比亲本的抗逆性强、早熟高产、品质优越等。前期已有相关研究显示红鳍东方鲀和菊黄东方鲀的杂交后代在生长速率方面显著高于菊黄东方鲀,但未超过红鳍东方鲀,而在肉质方面,杂交东方鲀和菊黄东方鲀保持了基本一致的极佳口感,且对低水温、重金属离子、盐度的波动均有良好的抗逆性[17-19]。
该研究应用Illumina高通量测序技术对红鳍东方鲀及杂交鲀(红鳍东方鲀与菊黄东方鲀杂交后代F1)脑和肾脏的转录组测序,分别筛选到2 207个和1 823个差异表达基因进行GO富集分析和KEGG功能富集分析,结果显示杂交鲀与红鳍东方鲀的差异表达基因主要富集在神经活性配体-受体相互作用过程、NOD样受体信号通路和钙信号通路过程等,且在神经活性配体-受体相互作用过程中存在生长激素(growth hormone, GH)和催乳素(prolactin,PRL)的调控。在鱼类的生长内分泌调控方面,催乳素和生长激素都是较为重要的影响因素[20],其对鱼类的生长发育起到了重要作用,如催乳素可以维持体内外电解质和水的平衡、调节内分泌与新陈代谢、脑功能和行为协调、免疫调节和保护、繁殖以及促进生长和发育[21];而生长激素可以促进消化系统的氨基酸吸收及增加组织细胞的RNA合成进而促使鱼体蛋白质合成,提高食物转化率,还有调节鱼类生殖功能、促进体细胞分裂、增强鱼体免疫力和刺激骨骼肌肉组织发育等效果[22-23]。因此初步推测神经活性配体-受体相互作用过程、NOD样受体信号通路和钙信号通路过程可能是杂交鲀杂交优势的主要由来,但还需要进一步研究证明。
该研究通过对红鳍东方鲀及杂交鲀的转录组比较分析,揭示了神经活性配体-受体相互作用途径可能参与调控出了杂交鲀的杂交优势,为后期继续进行杂交鲀和红鳍东方鲀生长发育差异过程的相关分子调控机制的研究提供了初步理论依据与参考,有利于进一步提高杂交河鲀的经济价值。
参考文献
[1] 马仲波,唐钢胜,张峰,等.鲤鱼三杂交[(荷包红鲤♀×元江鲤 ♂)♀×镜鲤 ♂]遗传改良与利用的研究[J].淡水渔业,1984(6):25-27.
[2] 潘光碧,唐刚胜,杜森英,等.鲤鲫移核鱼与散鳞镜鲤杂交优势及遗传性状的研究[J].水产学报,1989,13(3):230-238.
[3] 佟雪红,董在杰,缪为民,等.建鲤与黄河鲤的杂交优势研究及主要生长性状的通径分析[J].大连水产学院学报,2007,22(3):159-163.
[4] 陈学年,郭玉娟.彭泽鲫与兴国红鲤杂交优势的研究与利用[J].淡水渔业,2000(9):14-16.
[5] 陈林,朱曉鸣,韩冬,等.芙蓉鲤鲫幼鱼饲料适宜淀粉含量[J].水生生物学报,2016,40(4):690-699.
[6] 雷霁霖. 海水鱼类养殖理论与技术[M].北京:中国农业出版社,2002:683-702.
[7] 韦众.河鲀鱼的生物学特性及其养殖(综述)[J].安徽农业大学学报,1999,26(4):436-439.
[8] 万玉美,赵海涛,张福崇.红鳍东方鲀、菊黄东方鲀及其杂交F1幼鱼耗氧率与窒息点研究[J].水产科学,2013,32(1):21-25.
[9] 赵海涛,万玉美,张福崇,等.菊黄东方鲀(♀)×红鳍东方鲀(♂)F1代及其亲本肌肉营养成分的比较分析[J].大连海洋大学学报,2013,28(1):77-82.
[10] 刘伟,王腾蛟,唐海琳,等.高通量细菌鉴定方法研究进展[J].微生物学通报,2014,41(12):2501-2509.
[11] POLICHT F A,SONG M H,SITAILO S,et al. Analysis of genetic copy number changes in cervical disease progression[J]. BMC Cancer, 2010, 10(1):432-438.
[12] 张春兰,秦孜娟,王桂芝,等.转录组与RNA-Seq技术[J].生物技术通报,2012(12):51-56.
[13] 李琳,冯帅,汪莹,等.鼠伤寒沙门菌ATCC13311诱导耐药株的转录组测序和分析[J].中国兽医学报,2015,35(7):1088-1094,1111.
[14] ANDERS S,HUBER W.Differential expression analysis for sequence count data[J]. Genome Biol,2010, 11:1-12.
[15] TRAPNELL C,WILLIAMS B A,PERTEA G, et al. Transcript assembly and quantification by RNAseq reveals unannotated transcripts and isoform switching during cell differentiation[J].Nat Biotechnol,2010,28(5):511-515.
[16] TRAPNELL C,ROBERTS A,GOFF L,et al. Differential gene and transcript expression analysis of RNAseq experiments with TopHat and Cufflinks[J].Nat Protoc,2012,7(3): 562-578.
[17] 范文涛,刘海金,赵文江,等.菊黄东方鲀♀×红鳍东方鲀 ♂杂交后代早期形态特征及生长速度的比较[J].水产学报,2011,35(7):1065-1071.
[18] 张福崇,万玉美,方笑,等.盐度对杂交东方鲀存活和摄食的影响[J].河北渔业,2012(12):2-6.
[19] 张福崇,趙海涛,万玉美.杂交河魨F1代苗种生产与养殖技术研究[J].河北渔业,2011(10):19-21,32.
[20] 于力群,王厚鹏,朱作言,等.生长激素/催乳素家族配体和受体成员在斑马鱼早期胚胎中的表达比较和交叉活性分析[J].水生生物学报,2014,38(5):809-818.
[21] 张耀,郭定宗.催乳素结构与功能研究进展[J].动物医学进展,2007,28(5):49-52.
[22] 匡刚桥,刘臻,鲁双庆.鱼类生长激素基因的研究现状及展望[J].水利渔业,2006(6):1-3.
[23] 徐斌,李德尚,张培军.鱼类生长激素的分子生物学和应用研究的进展[J].海洋与湖沼,1997(5):553-557.

