朝天罐总酚的提取纯化及其抗氧化活性研究
陈艳华 蒋霞 陈依雨


摘要 [目的]優化朝天罐总酚的提取纯化工艺并评价其抗氧化活性。[方法]采用单因素和正交试验方法优化朝天罐总酚回流提取工艺,并使用大孔树脂对朝天罐总酚进行分离纯化。采用清除DPPH、ABTS·及Fe3+还原能力试验,与维生素C的抗氧化能力进行比较,评价朝天罐总酚的抗氧化活性。[结果]最佳提取工艺条件为乙醇浓度35%,提取温度80 ℃,料液比1∶50(g∶mL),提取时间 3 h,提取次数1次;AB-8型大孔树脂为纯化朝天罐总酚的最佳树脂,最佳动态工艺条件为上样液质量浓度2.0 mg/mL、上样流速2 mL/min、洗脱液乙醇浓度60%、洗脱流速3 mL/min、洗脱用量120 mL。在最佳工艺条件下,纯化后的朝天罐总酚含量为74.26%,对比于粗提物中的总酚含量(15.36%)提高了3.83倍。朝天罐总酚的抗氧化活性随质量浓度的增大而增强,其清除DPPH自由基的能力较维生素C强,对ABTS+自由基和铁离子也有较好的清除能力和还原能力,经AB-8树脂纯化后,其抗氧化能力显著提高(P<0.01)。[结论]优选的提取纯化工艺稳定可行、提取率高,朝天罐总酚抗氧化性能较强,为朝天罐总酚的应用提供了科学依据和理论基础。
关键词 朝天罐;总酚;提取工艺;大孔树脂;抗氧化
Abstract [Objective]The research aimed to optimize extraction and purification technology of total phenols from Osbeckia opipara and evaluate its antioxidant activity.[Method]The total phenols extraction technology was optimized by single factor experiment and orthogonal experiment.In addition,the total phenols were purified by macroporous resin.Antioxidant activity of total phenols from Osbeckia opipara was evaluated through several in vitro antioxidant assays,such as DPPH radical scavenging activity,ABTS radical scavenging activity and ferric reducing antioxidant effect with vitamin C as a reference.[Result]Optimum extraction conditions of total phenols were as follows: ethanol concentration of 35%,extraction temperature of 80 ℃,solidliquid ratio of 1∶50 (g∶mL),extraction time of 3 h and number of extractions of once.The results showed that A B8 type resin was the most suitable resin for the purification of total phenols from Osbeckia opipara.The optimum dynamic conditions were as follows: sample concentration of 2.0 mg/mL,sample flow rate of 2 mL/min,with 60% ethanol as eluent,elution rate of 3 mL/min and eluent volume of 120 mL.Under the optimal conditions,the total phenols content was 74.26%,which was 3.83 times higher than that of crude extract (15.36%).Antioxidant capacity of total phenols from Osbeckia opipara was concentrationdependent,its DPPH radical scavenging ability was stronger than vitamin C.It also had a better scavenging activity of ABTS and ferric reducing antioxidant effect.After purification,its antioxidant activities were improved significantly than before(P<0.01).[Conclusion]The preferred extraction and purification process is stable and feasible,with high extraction rate,and the antioxidant capacity of total phenol from Osbeckia opipara is strong,which provides a scientific basis and theoretical basis for the application of total phenol from Osbeckia opipara.
Key words Osbeckia opipara;Total phenols;Extraction technology;Macroporous resin;Antioxidant
朝天罐(Osbeckia opipara C.Y.Wu et C.Chen)为野牡丹科金锦香属植物,又名倒罐草、张天刚、七孔莲、向天葫芦等,产于浙江、福建、台湾、江西、湖南、广东、海南、广西、贵州及四川南部,生于海拔250~800 m的山坡、山谷、水边、路边、疏林中或灌木丛中,越南至泰国也有分布[1],为广西少数民族地区常用本草药材。主要以根入药,其味甘、微苦,性平,归肾、大肠经,具有清热利湿、散淤止血、解毒散结等功效,主治腰膝酸软、咯血、痢疾、肠炎、咽喉痛等;亦可全株入药,用于治疗小儿风热、痔疮出血、月经不调、癌症等[2]。研究发现,酚类为朝天罐根的主要化学成分之一[3]。大量研究表明,酚类化合物为植物中重要的药理活性物质,具有抗氧化[4]、抗肿瘤[5]、抗炎[6]、抗菌、抗病毒[7]、降血糖、降血脂[8]等作用。目前关于朝天罐酚类提取物的研究鲜见文献报道,笔者对朝天罐总酚的提取工艺和分离纯化工艺进行了研究,确定最佳提取纯化条件,并评价其抗氧化活性,旨在为朝天罐活性成分的综合利用及进一步研究开发提供理论基础。
1 材料与方法
1.1 仪器 EL204电子天平(上海梅特勒-托利多仪器有限公司);R-1001N旋转蒸发仪(郑州长城科工贸有限公司);TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司)。
1.2 材料 朝天罐药材采于广西金秀瑶族自治县,经广西医科大学天然药物与生药学教研室焦爱军教授鉴定为朝天罐根;没食子酸对照品(北京索莱宝科技有限公司,批号519D021);大孔吸附树脂:D101、AB-8、HPD-100、HPD-450、HPD-600、HPD-700(沧州宝恩吸附材料科技有限公司);1,1-二苯基-2-苦基肼自由基(东京化成工业株式会社);ABTS快速法试剂盒、FRAP法试剂盒(上海碧云天生物技术有限公司)。
1.3 朝天罐总酚提取工艺优选
1.3.1 朝天罐总酚的提取。工艺流程:经预处理的朝天罐干燥根→粉碎→过60目筛→回流提取→过滤→旋蒸浓缩→定容→测定总酚含量。取朝天罐药材粉末(60 目)约1 g,精密称定,加入体积分数为75%乙醇20 mL,80 ℃水浴回流提取1 h,重复3次,过滤,滤渣用75% 乙醇洗涤,合并滤液,将提取液经50 ℃旋转蒸发,75%乙醇定容至 25 mL,摇匀,即得。
1.3.2 标准曲线的绘制。采用福林酚法[9]测定总酚含量。精密称取没食子酸对照品2.83 mg,加入超纯水溶解定容至25 mL;取朝天罐总酚提取液和没食子酸对照品溶液适量,分别置于10 mL 容量瓶中,加入0.5 mL福林-酚试剂,摇匀,6 min 后加入20% Na2CO3 溶液1.5 mL,超纯水定容至刻度,摇匀,于室温下避光反应1 h后,以相应的试剂为空白对照,于400~900 nm光谱扫描,结果对照品与样品溶液在750 nm 处均有最大吸收,故选择测定波长750 nm。精密量取没食子酸对照品溶液0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mL分别加入10 mL 容量瓶内,按上述方法显色后,依法测定吸光度,以对照品浓度(X)为横坐标、吸光度(Y)为纵坐标绘制标准曲线,得回归方程Y=0.083 7X+0.031 9(r=0.999 5),且在1.132~9.056 μg/mL其线性关系良好。
1.3.3 单因素试验。精密称取朝天罐药材粉末约1 g (过60目筛) 回流提取,在其他提取条件固定的前提下,分别选取乙醇浓度(35%、45%、55%、 65%、75%、85%、95%)、提取温度(50、60、70、80、90 ℃)、料液比[1∶10、1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL)]、提取时间(1、2、3、4、5 h)、提取次数(1、2、3次)5个因素,考察其对朝天罐总酚含量的影响。各提取液按“1.3.2”项下方法测定,计算朝天罐总酚含量。
1.3.4 正交试验设计。根据单因素试验结果,选取对朝天罐总酚含量有显著影响的因素和水平进行正交试验设计。确定对乙醇浓度(A) 、提取温度(B) 、料液比(C) 及提取时间(D) 4 个因素进行考察,每个因素选择3个水平,采用L9(34 ) 正交表安排试验,具体正交试验因素水平见表1。
1.3.5 验证试验。精密称取3 份朝天罐粉末30 g,根据优选的最佳提取工艺进行3次验证试验。
1.4 优化朝天罐总酚纯化工艺
1.4.1 大孔树脂预处理[10]。大孔树脂先用95%乙醇浸泡24 h,湿法装柱后用95%乙醇洗至流出液加适量水无白色浑浊,再用水洗至无醇味。加5% 盐酸浸泡4 h后,用水洗至中性,再加5% 氢氧化钠溶液浸泡4 h,最后用水洗至中性备用。
1.4.2 大孔吸附树脂的选择[11]。称取D101、AB-8、HPD-100、HPD-450、HPD-600和HPD-700各 2.00 g 置于100 mL具塞锥形瓶中,设置平行3组试验,最后结果计算平均数。加入 30 mL浓度为 0.5 mg/mL的朝天罐总酚粗提液,于恒温振荡器(25 ℃,120 r/min) 振荡吸附24 h,抽滤,取滤液测定总酚含量。用水清洗3次树脂,用滤纸吸干树脂表面水分,转入100 mL 具塞三角瓶中,加入50%的乙醇30 mL,于恒温振荡器(25 ℃,120 r/min) 振蕩解吸12 h,取上清液测定总酚含量。计算不同树脂的吸附量、吸附率、解吸量及解吸率。
1.4.3 AB-8大孔树脂对朝天罐总酚的动态吸附-解吸试验。将处理后的大孔树脂10 g湿法装入(2.5 cm×30.0 cm)层析柱内,超纯水平衡后进行动态吸附与解吸试验[12],分别考察朝天罐总酚上样液浓度(0.5、1.0、1.5、2.0、2.5、3.0 mg/mL)、上样流速(1、2、3、4、5 mL/min)、上样量(每 10 mL收集1管流出液,共收集50管)、洗脱液浓度(30%、40%、50%、60%、70%、80%、90%乙醇水溶液)、洗脱流速(1、2、3、4、5 mL/min)与洗脱用量(每 10 mL收集1管流出液,共收集20管)对吸附与解吸效果的影响,绘制泄漏和洗脱曲线,计算动态吸附率和解吸率。
1.4.4 工艺验证试验。精密称取3 份朝天罐粉末30 g,按最佳提取纯化工艺条件进行提取和纯化,计算总酚得率和纯度。
1.5 抗氧化活性測定
1.5.1 DPPH 自由基清除能力。测定方法参照文献[13],并稍作改动。精确吸取质量浓度分别为5、10、15、20、25、30、35、40 μg/mL的朝天罐总酚粗提物及纯化物供试品溶液各1 mL,分别与3 mL浓度为0.1 mmol/L的DPPH 无水乙醇溶液混合,充分摇匀后避光放置30 min,于波长517 nm处以 A空白(1 mL蒸馏水+3 mL无水乙醇)调零测定吸光度。以VC 为阳性对照,根据公式(1)计算清除率。
DPPH 自由基清除率=[1-(A1-A2)/A0]×100%(1)式中,A1为样品(1 mL 样品+3 mL DPPH 工作液)吸光度;A2为样品对照组(1 mL 样品+3 mL 无水乙醇)吸光度;A0为空白对照组(1 mL 蒸馏水+3 mL DPPH工作液)吸光度。
1.5.2 ABTS+ 自由基清除能力。参照ABTS快速法试剂盒说明书,并参考研究方法[14]。在96孔板的每个检测孔中加入20 μL过氧化物酶工作液;空白对照孔中加入10 μL蒸馏水,样品检测孔内加入10 μL各种样品(各样品浓度为40、60、80、100、120、140、160、180 μg/mL),混匀;每孔内再加入170 μL ABTS工作液,轻轻混匀;室温孵育6 min后测定波长414 nm 处的吸光度。以VC 为阳性对照,根据公式(2)计算清除率。
ABTS+ 清除率=[1-(A1- A2)/A0]×100%(2)式中,A0为空白对照吸光度;A1为样品吸光度;A2为样品对照组吸光度。
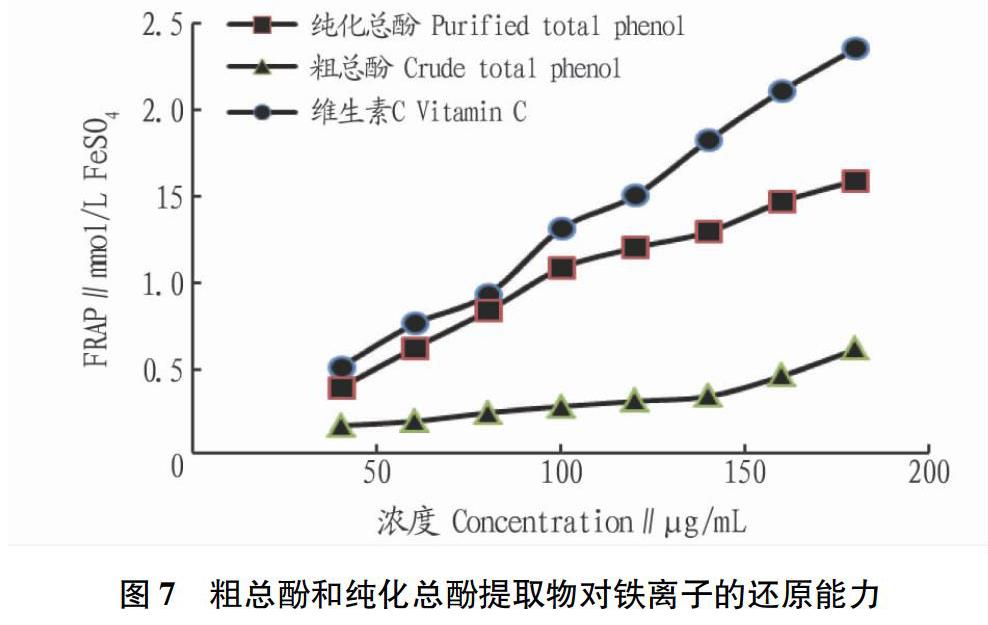
1.5.3 铁离子还原能力(FRAP)。参照FRAP法试剂盒说明书,并参考文献[15],稍作改动。精确称取27.8 mg FeSO4·7H2O溶解定容至10 mL,浓度即为10 mmol/L。在96孔板的每个检测孔中加入180 μL FRAP工作液;空白对照孔中加入5 μL蒸馏水,标准曲线检测孔内加入5 μL各种浓度的FeSO4标准溶液(浓度分别为0.15、0.3、0.6、0.9、1.2、1.5、1.8、2.4 mmol/L),样品检测孔内加入5 μL各种样品(各样品浓度分别为20、40、60、80、100、120、140、160、180 μg/mL),混匀;37 ℃孵育5 min后测定波长593 nm处的吸光度。以VC 为阳性对照,样品铁离子还原能力用mmol/L FeSO4表示。
2 结果与分析
2.1 朝天罐总酚提取工艺优选
2.1.1 单因素试验结果。由图1a可见,总酚含量开始随着乙醇浓度的升高而逐渐增加,在45% 时达到最高;但随着乙醇浓度进一步增加,总酚含量逐渐降低,这可能是由于部分朝天罐酚性成分亲水性较好造成。因此将乙醇浓度水平设置在35%~55%。
由图1b可知,在50~90 ℃,随着温度的升高,总酚含量也随之增加。在50~80 ℃总酚含量显著升高,80~90 ℃总酚含量上升趋于平缓,因此提取温度水平设置在70~90 ℃。
由图1c可知,随着料液比的增加,朝天罐总酚含量逐渐升高,在料液比为1∶50(g∶mL)时达到最大值,可能是随着溶剂体积的增加,溶剂与溶质充分接触,溶出速度加快,使总酚含量升高。当料液比超过1∶50时,总酚在溶剂中的溶解度已达到饱和,且随着其他提取物的增多,不利于总酚溶出,总酚含量呈下降趋势。因此将料液比设置在1∶40~1∶60。
图1d显示,随着提取时间的增加,总酚含量逐渐升高,当提取时间达到3 h 时,总酚含量达到最大值,此时提取效果最好。当提取时间进一步延长(>3 h),溶剂中酚性成分浓度逐渐增大,和固相中的浓度差逐渐变小,有效成分难以进一步溶解。因此将提取时间设置在2~4 h 。
图1e结果表明,提取1、2、3次后,总酚含量逐渐升高,但上升平缓,考虑工艺成本和节约资源,将提取次数设置为提取1 次。
2.1.2 正交试验结果。由表2可知,乙醇浓度、提取温度、料液比、提取时间对朝天罐总酚含量均有不同程度的影响,其中乙醇浓度对总酚提取率的影响最大,其次为料液比、提取时间,提取温度对总酚含量的影响最小。影响总酚含量的因素作用主次为A>C>D>B,即乙醇浓度>料液比>提取时间> 提取温度。确定最佳提取工艺为A1B3C2D2,由于温度对总酚的提取影响较小,考虑到实际生产中能耗的减少及生产效率,故提取温度设置为80 ℃,即加50倍量35% 乙醇在温度为80 ℃下回流提取3 h,1次。
2.1.3 验证试验。根据优选的最佳提取工艺进行3次验证试验,结果见表3,朝天罐总酚平均得率为32.13%,RSD 为1.42%;平均纯度为15.36%,RSD 为2.08%;表明优选的提取工艺稳定性好,合理可行。
2.2 朝天罐总酚纯化工艺优化
2.2.1 大孔吸附树脂的筛选。由表4可见,不同型号的树脂由于极性、比表面积、平均孔径不同,对朝天罐总酚的吸附和解吸能力各不相同。其中,HPD-600虽然有较高的吸附能力,吸附率可达92.86%,但是其解吸率较低,为87.45%,较难将总酚解吸出来,所以HPD-600不适合用于朝天罐总酚的纯化。AB-8、D101 和HPD-100的吸附能力相近,但解吸率AB-8>HPD-100>D101,由于适宜的纯化树脂不仅要对目标成分吸附量大,而且要求解吸率高,以保证目标成分最大程度地被回收,因此综合考虑选择AB-8为朝天罐总酚的最佳纯化树脂。
2.2.2 AB-8大孔树脂对朝天罐总酚的动态吸附-解吸试验。从图2a可以看出,随着朝天罐总酚浓度的升高,吸附率随之增大,但在上样液浓度大于2.0 mg/mL时,吸附率增加趋于平缓,且观察到上样液开始出现浑浊,上样后在柱床上层出现沉淀,对大孔树脂造成污染和堵塞,不利于树脂的吸附。因此,上样液浓度选择2.0 mg/mL为宜。
[6] 祖元剛,胡艳,姜守刚.红松多酚物质的提取工艺及其抗炎活性初步研究[J].植物研究,2016,36(4):634-640.
[7] PIZZOLITTO R P,DAMBOLENA J S,ZUNINO M P,et al.Activity of natural compounds from peanut skins on Fusarium verticillioides growth and fumonisin B1 production[J].Industrial crops & products,2013,47:286-290.
[8] OBOH G,ADEMILUYI A O,AKINYEMI A J,et al.Inhibitory effect of polyphenolrich extracts of jute leaf (Corchorus olitorius) on key enzyme linked to type 2 diabetes (αamylase and αglucosidase) and hypertension (angiotensin I converting) in vitro[J].Journal of functional foods,2012,4(2):450-458.
[9] MUSCI M,YAO S C.Optimization and validation of FolinCiocalteu method for the determination of total polyphenol content of Puerh tea[J].International journal of food sciences and nutrition,2017,68(8):913-918.
[10] 韦琴,梅辉,乐薇,等.板栗壳原花青素的含量测定及其纯化工艺研究[J].粮食与油脂,2016,29(9):81-85.
[11] 王慧芳,苏淑云,邵圣娟,等.大孔树脂分离纯化陈皮黄酮工艺及其抑菌活性[J].中成药,2018,40(12):2667-2672.
[12] 贺丽莹,王晶,肖萌,等.延龄草总皂苷AB-8大孔树脂纯化工艺研究[J].时珍国医国药,2018,29(12):2870-2872.
[13] NIU X N,QIN R L,ZHAO Y D,et al.Simultaneous determination of 19 constituents in Cimicifugae Rhizoma by HPLCDAD and screening for antioxidants through DPPH free radical scavenging assay[J].Biomedical chromatography,2019,33(10):1-8.
[14] MICHALINA G,GRZEGORZ B,ANDRZEJ D,et al.Antioxidant properties of ferrous flavanol mixtures[J].Food chemistry,2018,268:567-576.
[15] ABDULQADER A,ALI F,ISMAIL A,et al.Antioxidant compounds and capacities of Gac (Momordica cochinchinensis Spreng) fruits[J].Asian Pacific journal of tropical biomedicine,2019,9(4):158-167.

