1株鸭3型腺病毒的分离鉴定及fiber基因序列分析
严专强 曾凡桂 招丽婵 王占新 鲁俊鹏*
1.温氏食品集团股份有限公司,广东新兴527400;2.广东省畜禽健康养殖与环境控制企业重点实验室,广东新兴527400
腺病毒(Adenovirus,ADV)为线状双股DNA 病毒,无囊膜,直径70~110 nm,呈二十面体对称。腺病毒粒子由252 个壳粒组成,包含240 个不在顶点的壳粒(六邻体)和12 个顶点壳粒(五邻体)。每个五邻体基底带有1~2 根被称为纤丝的纤突(fiber),纤丝的长度与病毒的抗原性相关。感染禽类的腺病毒主要有3 个群,I 群代表株是鸡胚致死性孤儿病毒,目前从鸡分离到12 个血清型,火鸡2 个血清型,鹅4 个血清型,鸭2 个血清型;Ⅱ群主要包括火鸡出血性肠炎病毒、大理石脾病毒和鸡大脾病病毒;Ⅲ群与减蛋综合征相关,目前只包含一个成员,即减蛋综合征病毒[1-2]。
鸭l 型腺病毒是与减蛋综合症相关的Ⅲ群腺病毒,鸭2 型腺病毒于1977年从法国番鸭中分离,该病毒抗原与已知的腺病毒不同,是一种新型的禽腺病毒[3]。2014年奥地利科学家Marek 等通过高通量测序技术获得该病毒全序列,该型病毒被正式命名[4]。鸭3 型腺病毒于2014年在我国首次分离,该病毒hexon基因推导的氨基酸序列与鸭2 型腺病毒GR 株同源性仅为60%,且该病毒含有2 个fiber 基因(fiber-1 和fiber-2),而GR 株只含有1 个[5]。为了解鸭3 型腺病毒的流行与变异情况,本研究对近期广东地区分离的毒株进行了主要免疫原性相关基因序列测定和分析,以期为该病的防治提供参考。
1 材料与方法
1.1 主要材料和试剂
13日胚龄番鸭胚由温氏食品集团股份有限公司提供;ExTaq 酶、DL 2000 DNA Marker、Prime-Script One Step RT-PCR Kit、pMD-19 T 载体等购自TaKaRa 公司;DNA 提取试剂盒(Stool DNA Kit)购自OMEGA 公司;小牛血清为GIBCO 公司产品,无菌分装后20 ℃保存备用;DMEM 培养液及胰酶等购自GIBCO 公司。
1.2 临床样品处理
2019年10月,广东某鸭场30日龄番鸭出现肝脏肿大、出血、白色点状坏死等症状。采集发病鸭肝脏置于玻璃研磨器中充分研磨,收集组织悬液于2 mL 离心管中,反复冻融3 次,离心弃沉淀,取上清液通过0.22 μm 滤膜过滤,所得样本置于-80 ℃保存备用。
1.3 病毒分离
番鸭胚成纤维细胞按常规方法制备,将待分离样本接种番鸭胚成纤维细胞,每天观察,72 h 后将细胞冻融3 次再次接种番鸭胚成纤维细胞传代,盲传至第5 代,收获细胞标记为GD2019。
1.4 PCR 鉴定
参照文献[6-7]分别合成针对鸭3 型腺病毒(DAdV-3)、鸭肝炎病毒(DHV)、呼肠孤病毒(MDRV)、小鹅病毒(GPV)的引物对细胞分离到的病毒进行PCR 检测,各反应温度见表1。扩增产物用1 g/L 琼脂糖凝胶电泳检测,并用凝胶成像系统照像。
1.5 fiber 基因测序与分析
用fiber 基因测序引物(表1)对鉴定为鸭3 型腺病毒的细胞培养物进行扩增,将PCR 产物回收纯化后连接于pMD-19 T 载体,转化至E.coli DH5α感受态细胞,挑取单克隆菌落,37 ℃过夜摇菌,菌液PCR 鉴定为阳性的样品送华大基因测序公司进行测序。序列使用DNASTAR 和MEGA 7.0 软件进行拼接和分析。
2 结果与分析
2.1 病毒分离结果
用特异性引物对分离株进行DHV、MDRV 和GPV 的PCR 检测,均未检测到阳性,而用DAdV 特异性引物检测到了阳性病毒(图1)。
2.2 fiber 基因同源性分析
测序结果显示,GD2019 株fiber-1 基因全长为1 380 bp,编码459 个氨基酸,fiber-2 基因全长为1 443 bp,编码480 个氨基酸。氨基酸序列同源性分析发现,GD2019 株与已报道的鸭3 型腺病毒的fiber-1 和fiber-2 同源性均为100%(表2)。GD2019株fiber-1 与鸭1 型腺病毒、鸭2 型腺病毒、鹅4 型腺病毒和鸡4 型腺病毒同源性在12.2%~25.8%之间,GD2019 株fiber-2 与鹅4 型腺病毒和鸡4 型腺病毒同源性分别为37.1%和23.7%(表2)。结果表明,鸭3 型腺病毒的fiber 基因非常保守,与其他禽腺病毒同源性较低。
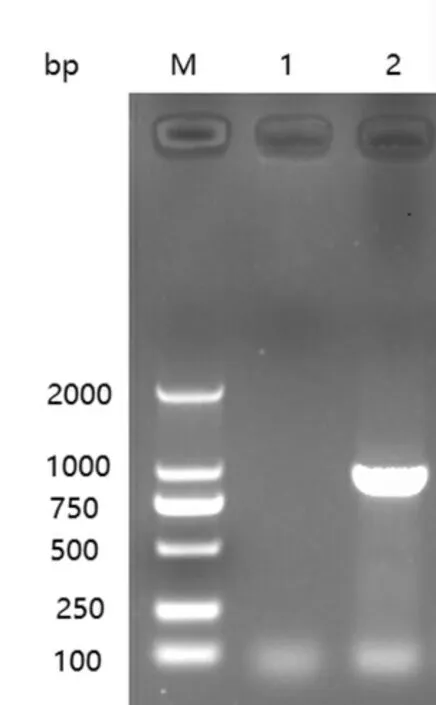
图1 病毒分离毒株PCR 检测结果
2.3 fiber 基因进化分析
分别对GD2019 株fiber-1 和fiber-2 基因序列与GenBank 上已发表的不同种属禽腺病毒的fiber基因进行分子进化分析。结果发现,鸭3 型腺病毒fiber-1 基因聚类在1 个分支,与鸭2 型腺病毒、鸭1型腺病毒以及其他禽腺病毒处于不同分支(图2)。鸭3 型腺病毒fiber-2 基因与鹅4 型腺病毒亲缘关系较近,与其他禽腺病毒亲缘关系较远。

表1 病毒检测引物
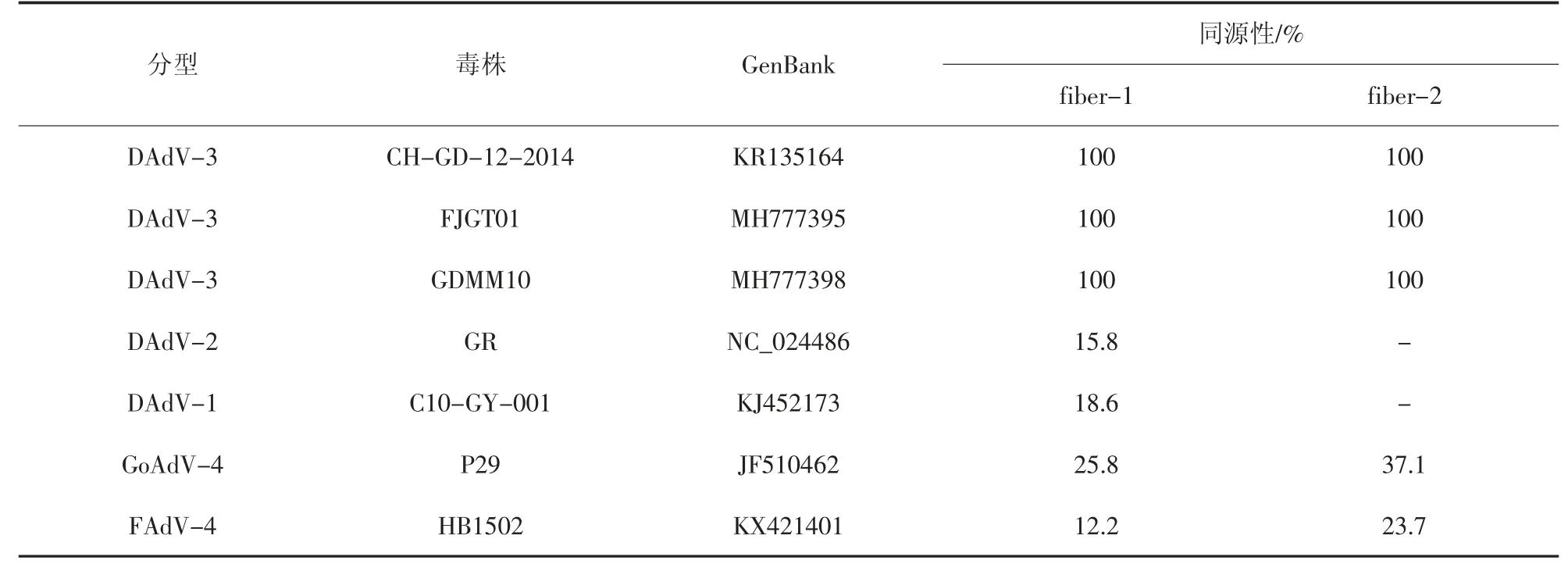
表2 分离株与其他禽腺病毒fiber基因核苷酸序列推导的氨基酸序列同源性比较
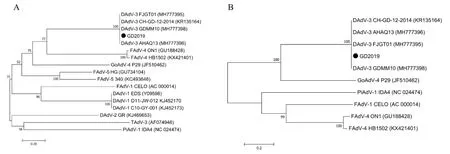
图2 分离株fiber 基因推导的氨基酸序列遗传进化树
3 讨论
fiber 基因在腺病毒的感染过程中起着关键作用,所有感染力强的禽腺病毒都被检测到含有2 个fiber 基因[8]。缺失fiber-1 后会造成病毒产量下降,腺病毒受体的特异性转导作用下降,使病毒只能感染禽类细胞,不能感染哺乳动物类细胞;缺失fiber-2 会导致病毒无法增殖、组装或扩散,不能产生病毒粒子[9]。本研究从临床发病鸭肝脏中成功分离了1株鸭3 型腺病毒,序列分析发现该型病毒fiber 基因非常保守,且比鸭1 型和鸭2 型腺病毒多1 个基因片段。推测鸭3 型腺病毒感染力比鸭1 型和鸭2 型腺病毒强,这可能是2014年以来该病毒在广东和福建等地区鸭群中持续流行的原因。
鸭3 型腺病毒的fiber-2 蛋白具有良好的免疫原性。Yin 等[7]在大肠杆菌中表达并纯化了鸭3 型腺病毒的fiber-1 和fiber-2 蛋白,免疫攻毒保护试验结果显示,重组fiber-2 蛋白免疫组IgY 抗体水平显著高于fiber-1 组和全病毒灭活疫苗组,重组fiber-2 蛋白免疫可以提供100%的攻毒保护,并完全抑制排毒,优于fiber-1 蛋白和全病毒灭活疫苗。疫苗免疫是针对鸭3 型腺病病毒有效的防控方法,高效疫苗的研发对该病的控制具有重要意义。

