杭州湾和三门湾拖网大型底栖动物群落组成和多样性研究*
严润玄 韩庆喜 王晓波
杭州湾和三门湾拖网大型底栖动物群落组成和多样性研究*
严润玄1韩庆喜1①王晓波2①
(1. 宁波大学海洋学院 宁波 315211; 2. 国家海洋局宁波海洋环境监测中心站 宁波 315012)
本研究根据2017年8月和2018年8月在东海北部杭州湾和三门湾大型底栖动物的拖网采集资料, 对这两个海域的大型底栖动物群落结构和多样性进行了研究。杭州湾的10个站位和三门湾的6个站位共获得61种大型底栖动物, 其中甲壳动物最多(22种), 其次是鱼类(20种)、软体动物(14种)、棘皮动物(2种)、刺胞动物(2种), 多毛类最少(1种)。杭州湾大型底栖动物优势种出现3种, 三门湾出现8种, 脊尾白虾是两个海域唯一的共同优势种。相比2017年, 杭州湾和三门湾在2018年鱼类的种类和数量都有明显的增长。根据大型底栖群落的多样性指数, 杭州湾不同区域的生物多样性差异较大, 而三门湾则较为平均。对杭州湾和三门湾大型底栖动物进行聚类分析和nMDS排序分析, 结果表明, 杭州湾不同站位大型底栖动物相似度低, Q8、Q9、Q10站位群落结构与三门湾的站位更为接近, 三门湾的底栖群落在2017年和2018年存在较大差异。杭州湾和三门湾大型底栖动物群落的变化可能与环境因子、人类活动、厄尔尼诺事件等的变化相关。
杭州湾; 三门湾; 拖网大型底栖动物; 群落组成; 群落结构
大型底栖动物不仅在海洋生态系统结构、功能以及能量流动中起着重要作用(Brey, 2012; Fuhrmann, 2015; Shojaei, 2016), 亦可用于生物资源评估和生态环境质量评价(Li, 2005), 也是近海污染和有机积累监测的重要手段(Han, 2013)。我国有关大型底栖动物的相关研究起步较晚, 研究力量相对薄弱, 需要加强数据资料积累和研究深度以支撑国家海洋战略的实施(张均龙等, 2016)。拖网采集得到的大型底栖动物包含许多重要的经济种类和经济饵料种(徐炜等, 2009), 对其群落组成和多样性的研究是保护和利用海洋生物资源的基础(Griffiths, 2008; 韩庆喜等, 2012)。
杭州湾紧邻上海市和宁波市, 是东海近岸经济活动最为强烈的海湾(田鹏等, 2019), 同时也是安氏白虾等重要经济物种的天然繁育场所(王淼等, 2019); 三门湾滩涂面积广、生物资源丰富, 是我国著名的海水养殖基地, 这两个海湾在我国东海近岸具有重要的经济意义和生态意义, 然而有关这两个海湾底栖生态的研究较少(廖一波等, 2011; 寿鹿等, 2012)。由于人口密度高, 工业发展迅速, 以及港口建设、交通和旅游业同步发展, 海湾环境正遭受污染和破坏(Yang, 2011), 对海湾底栖动物进行研究有助于明确海湾环境和生态系统受到的具体影响, 保障海湾经济的可持续发展。本研究根据2017年8月和2018年8月两个航次对杭州湾和三门湾拖网大型底栖动物的调查资料, 分析拖网大型底栖动物群落结构和多样性的变化, 旨在丰富东海近岸海湾底栖群落的基础数据, 为进一步研究海湾生态系统动态变化过程提供依据, 为杭州湾和三门湾的生态保护和资源开发活动提供指导。
1 材料方法
1.1 调查区域和时间
在东海北部近岸的杭州湾、三门湾共设置16个采样站位, 分别是杭州湾站位10个, 包括Q1、Q2、Q3、Q4、Q5、Q6、Q7、Q8、Q9和Q10; 三门湾站位6个, 包括S1、S2、S3、S4、S5和S6。于2017年8月和2018年8月进行两个航次的大型底栖动物生态调查, 站位分布如图1所示。
1.2 采样方法
本研究使用网口宽1.5m的阿氏拖网(Agassiz trawl)对大型底栖动物进行采集, 每个站位有效拖网1次, 拖网距离为500m, 拖网距离用GPS测定。网获样品先置于95%的酒精桶中密闭保存, 带回实验室在体视显微镜(型号: SMZ-168 BL; 生产公司: MOTIC CHINA GROUP CO., LTD; 产地: 厦门)下对其进行形态学鉴定, 尽量鉴定到种, 对每一物种的个体数量进行分别计数。多毛类按头部计数, 若有栖管需剥除, 软体动物的空壳不鉴定不计数, 软体动物称重时不去贝壳。样品的处理、鉴定、计数等均按《海洋调查规范》(GB 12763.6-91)进行。
1.3 数据处理
运用优势度计算公式对大型底栖动物优势种进行分析。优势度计算公式(徐兆礼等, 1989)如下:
= (n/)f, (1)
式中,为采获样品中所有种类的总个体数,n为第种的个体数,f为该种出现的站位数与总站位数的比率。当物种优势度> 0.02时, 该种即为优势种。
采样站位分布图采用软件ArcGIS Desktop 10.5绘制; 优势度计算、柱形图制作采用Microsoft office 2010 package; Margalef物种丰富度指数()、Pielou均匀度指数(′)、Shannon-Wiener指数(′)计算、聚类分析以及nMDS 排序采用生物多元统计软件PRIMER (Plymouth Routines in Multivariate Ecological Research) 6.0。
2 结果
2.1 大型底栖动物类群组成
在杭州湾和三门湾进行的调查共获得大型底栖动物61种, 甲壳动物最多, 有22种(占物种总数的36.07%), 其次是鱼类(20种, 占物种总数的32.79%)、软体动物(14种, 占物种总数的22.95%)、棘皮动物(2种, 占物种总数的3.28%)、刺胞动物(2种, 占物种总数的3.28%), 多毛类最少, 仅1种(占物种总数的1.64%)。
2017年在杭州湾的调查获得大型底栖动物26种, 隶属于4门5纲9目16科, 甲壳动物最多, 其次是鱼类、软体动物, 刺胞动物最少(表1)。从不同类群的个体数来看(图2), 甲壳动物占绝对优势(1407个), 主要贡献者是安氏白虾(1191个, 占甲壳动物个体数的84.65%), 其次是鱼类(22个)、软体动物(20个)和刺胞动物(1个)。
2017年在三门湾的调查获得大型底栖动物26种, 隶属于5门7纲12目20科, 甲壳动物最多, 其次是软体动物、鱼类, 刺胞动物和棘皮动物最少(表1)。从不同类群的个体数来看(图2), 甲壳动物最多(198个), 其次是软体动物(80个)、鱼类(20个)、刺胞动物(4个)和棘皮动物(2个)。
2018年在杭州湾的调查获得大型底栖动物37种, 比2017年增加了11种, 隶属于6门8纲14目21科, 鱼类最多, 其次是甲壳动物和软体动物, 棘皮动物、刺胞动物和多毛类最少(表1)。从不同类群的个体数来看(图2), 甲壳动物有绝对优势(1124个), 主要贡献者依旧是安氏白虾(757个, 占甲壳动物个体数的67.35%), 其贡献率相比2017年有明显下降, 其次是鱼类(152个)、软体动物(73个)、棘皮动物(15个)、多毛类(6个)和刺胞动物(2个)。
2018年在三门湾的调查获得大型底栖动物38种, 比2017年增加了12种, 隶属于5门7纲13目26科, 甲壳动物最多, 其次是鱼类、软体动物, 棘皮动物和刺胞动物最少(表1)。从不同类群的个体数来看(图2), 软体动物(380个)超越甲壳动物成为个体数最多的类群, 主要贡献者是锥螺(278个, 占软体动物个体数的73.16%), 其次是甲壳动物(254个)、鱼类(139个)、棘皮动物(10个)和刺胞动物(5个)。
表1 2017—2018年杭州湾和三门湾大型底栖动物组成
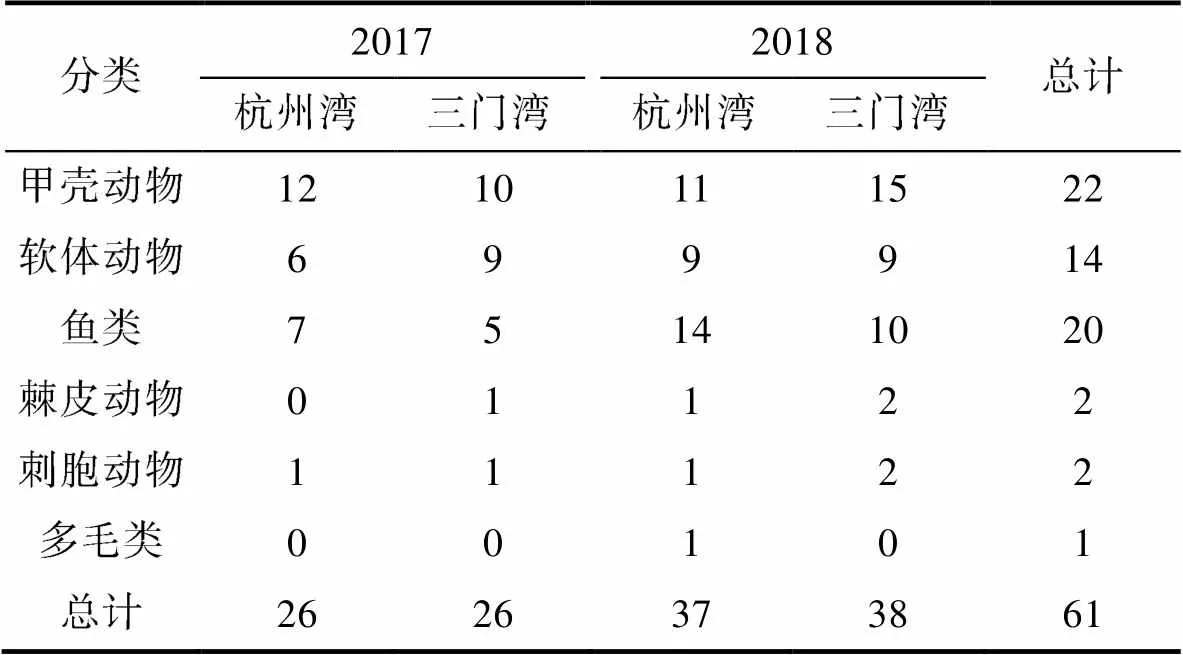
Tab.1 Composition of macrobenthos in Hangzhou Bay and Sanmen Bay during 2017—2018

图2 2017—2018年杭州湾和三门湾大型底栖动物个体数
2.2 大型底栖动物优势种
2017年杭州湾优势种为安氏白虾和脊尾白虾, 优势度分别为0.575和0.077; 2017年三门湾优势种为锥螺、哈氏仿对虾、红带织纹螺、中国毛虾和凹鳍孔鰕虎鱼, 优势度分别为0.099、0.022、0.063、0.248和0.033(表2)。
表2 2017—2018年杭州湾及三门湾大型底栖动物优势种

Tab.2 The dominant species of macrobenthos in Hangzhou Bay and Sanmen Bay during 2017—2018
2018年杭州湾优势种为安氏白虾、脊尾白虾和龙头鱼, 优势度分别为0.388、0.180和0.027; 2018年三门湾的优势种为锥螺、哈氏仿对虾、脊尾白虾、孔鰕虎鱼、凹鳍孔鰕虎鱼和纵肋细纹螺, 优势度分别为0.118、0.030、0.093、0.069、0.031和0.022。
2.3 大型底栖动物的多样性指数
2017年、2018年本研究调查海域各站位的物种数()、个体数()、Margalef物种丰富度指数()、Pielou均匀度指数(′)、Shannon-Wiener指数(′)如表3所示。在2017年, 杭州湾的Q9站位、′、′值都是所有站位中最高; 在2018年杭州湾的Q8、Q10站位成为、′、′值最高的两个站位。杭州湾的不同站位间多样性指数差异较大, 三门湾的各站位多样性指数相对接近。
2.4 大型底栖动物群落结构
杭州湾、三门湾拖网大型底栖动物丰度数据经过平方根转换和标准化, 转化为Bray-Curtis相似性矩阵, 再进行聚类分析(Cluster)和非度量多尺度分析(nMDS), 并将nMDS 排序结果与Cluster 分析结果比较, 排序图中压力系数Stress值小于0.2, 可认为其图形具有解释意义(周红等, 2003; 刘迅等, 2017), 图3、图4、图5的Stress值分别为0.01、0.13、0.12, 均小于0.2, 分析结果可信。基于聚类分析和非度量多尺度分析, 在合理的相似性水平(一般超过20%)下将大型底栖动物划分成数量合适的不同组(刘迅等, 2017)。在40%相似度水平下杭州湾在2017年、2018年的调查数据可以划分为4个组, 2017年的站位Q9单独一组, 2017年的站位Q8、Q10一组, 2018年的站位Q8、Q9、Q10一组, 其他站位一组(图3)。三门湾在25%相似度水平下在2017年、2018年的调查数据可划分为4组, 2018年的S1站位单独一组, 2017年的S1站位、S6站位一组, 2017年的S2、S3、S4一组, 其他站位一组(图4)。杭州湾、三门湾所有站位在30%相似度水平下可以分为5组, 2017年的S1、S6、Q9一组, 2017年的S2、S3、S4一组, 2018年的S2、S3、S4、S5、S6、Q8、Q9、Q10和2017年的S5、Q8、Q10一组, 2018年的S1单独一组, 其他站位一组(图5)。
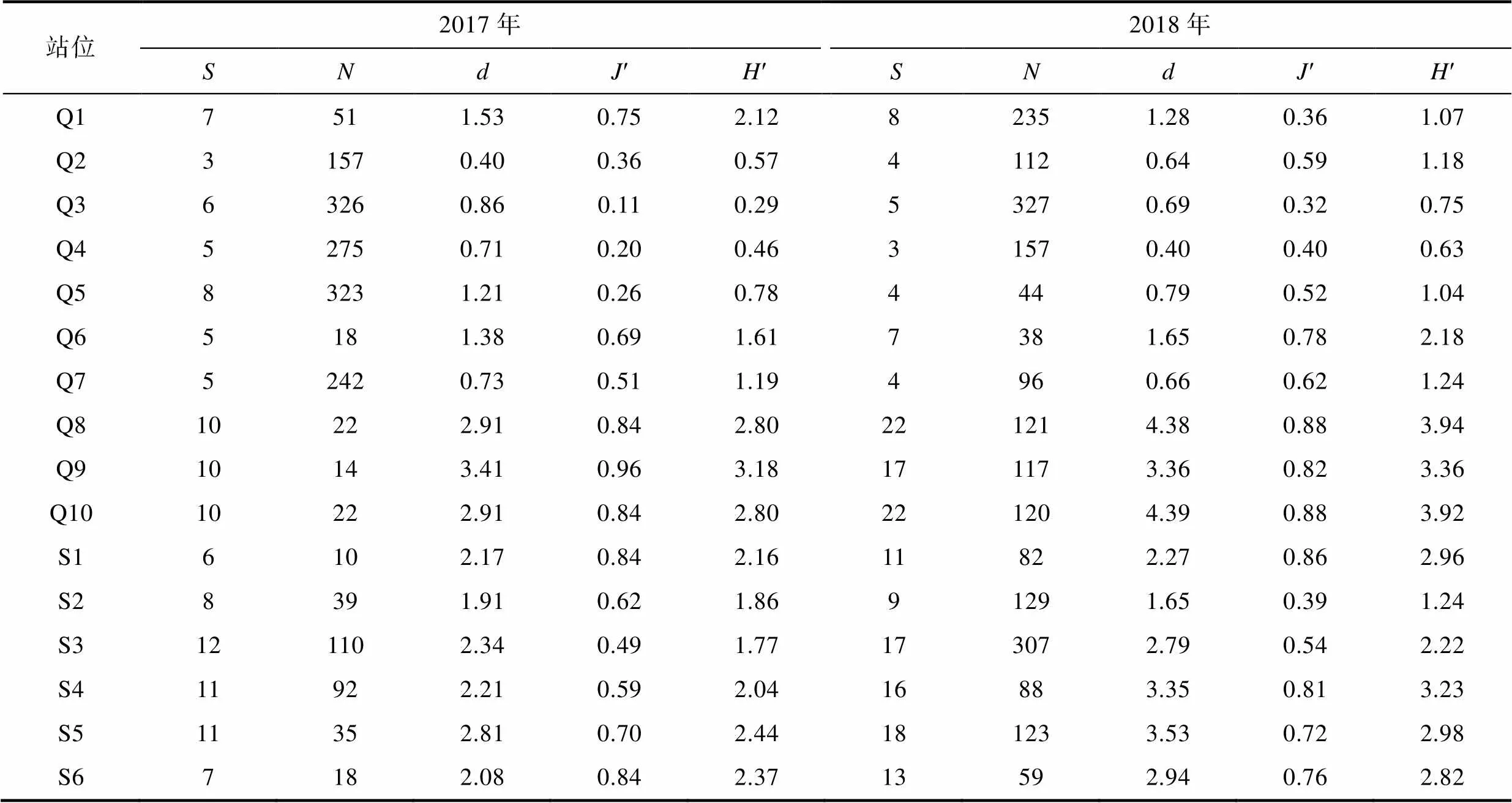
表3 2017—2018年杭州湾、三门湾大型底栖动物各站位物种数(S)、个体数(N)、Margalef物种丰富度指数(d)、Pielou均匀度指数(J′)、Shannon-Wiener指数(H′)

图3 杭州湾大型底栖动物聚类分析(a)和nMDS 排序(b)
运用PRIMER6.0软件, 对杭州湾、三门湾底栖群落进行SIMPER分析。杭州湾大型底栖动物群落在2017年的平均相似度为35.31%, 主要贡献者是安氏白虾(贡献率48.27%)和脊尾白虾(贡献率28.04%); 杭州湾底栖群落在2018年的平均相似度为39.66%, 主要贡献者是依旧是安氏白虾(贡献率39.22%)和脊尾白虾(贡献率37.88%)。三门湾大型底栖动物群落在2017年的平均相似度为30.75%, 主要贡献者是红带织纹螺(贡献率24.79%)、锥螺(贡献率17.48%)、凹鳍孔鰕虎鱼(贡献率16.04%)和中国毛虾(贡献率14.93%); 三门湾底栖群落在2018年的平均相似度为29.17%, 主要贡献者是脊尾白虾(贡献率28.15%)。
杭州湾大型底栖动物群落在2017年与2018年的不相似度为62.70%, 安氏白虾是不相似度的主要贡献者, 贡献率为27.85%, 是唯一贡献率高于10%的物种。三门湾大型底栖动物群落在2017年与2018年的不相似度为81.95%, 锥螺是唯一贡献率超过10%的物种, 贡献率为11.13%。
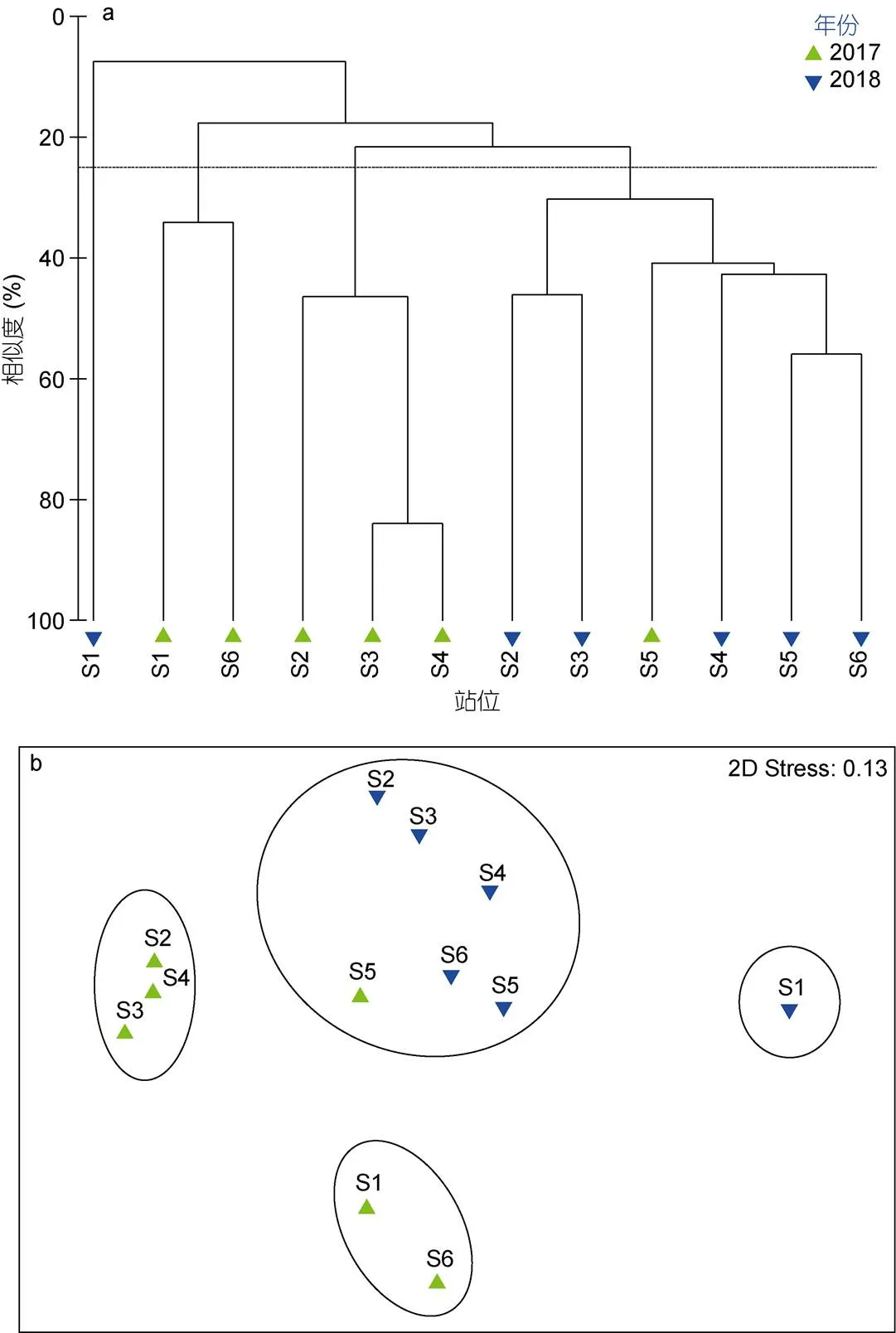
图4 三门湾大型底栖动物聚类分析(a)和 nMDS 排序(b)
2017—2018年大型底栖动物群落在杭州湾的平均相似度为29.08%, 主要贡献者是安氏白虾(贡献率57.75%)和脊尾白虾(贡献率26.34%); 大型底栖动物群落在三门湾的平均相似度为18.95%, 主要贡献者是中国毛虾(贡献率17.67%)、锥螺(贡献率16.33%)、脊尾白虾(贡献率16.18%)、红带织纹螺(贡献率10.31%)。2017—2018年大型底栖动物群落在杭州湾和三门湾的不相似度为88.70%, 安氏白虾(贡献率36.74%)和锥螺(贡献率10.79%)是主要贡献者。
3 讨论
3.1 杭州湾和三门湾大型底栖动物群落组成及变化分析
经过两年的调查, 本研究在杭州湾的10个站位和三门湾的6个站位共发现61种生物, 甲壳动物、鱼类和软体动物是主要成分, 底内生物的重要组成成分多毛类仅发现智利巢沙蚕1种, 可见阿氏拖网对底上动物和底游动物有良好的采集效果, 对底内动物的采集非常有限。2018年杭州湾的鱼类种类相比2017年增加一倍, 鱼类数量则增加6倍以上, 可能有三方面的原因, 一是杭州湾受钱塘江、长江冲淡水和外海水影响, 环境因子有着明显的年际变化(刘录三等, 2012), 温度、盐度、营养盐、深度等环境因子会对鱼类数量和群落空间结构产生显著的影响(宋秀凯等, 2010; 翟璐等, 2015; 徐勇等, 2017); 二是随着我国对海洋环境保护的力度不断加强和各项环保措施的积极推进, 杭州湾的生物多样性得到了一定的恢复(贾海波等, 2014); 三是脊尾白虾、安氏白虾等小型甲壳动物在杭州湾有极高的数量, 为鱼类提供了充足的食物(王淼等, 2019), 有利于鱼类数量的增长。

图5 杭州湾、三门湾大型底栖动物聚类分析(a)和 nMDS 排序(b)
三门湾的大型底栖动物群落组成变化比杭州湾复杂, 鱼类的变化则与杭州湾一致(种类数增加一倍, 数量增加7倍以上); 甲壳动物的种类数增加了50%, 数量增加了28.28%; 软体动物种类数不变, 数量却增加了375%, 超过甲壳动物成为数量最多的类群。鱼类和甲壳动物的变化和杭州湾鱼类变化的原因相类似, 软体动物的变化则较为特殊, 其数量增长主因是锥螺数量的剧增。锥螺对于盐度波动和低盐的环境有良好的适应性且具有较强的繁殖能力(Wu, 1981), 因此能够在海湾中实现个体数量的快速增长, 在生态系统中占据优势地位。
3.2 杭州湾和三门湾大型底栖动物优势种分析
杭州湾的优势种少, 2017年和2018年分别仅有2种和3种, 以长臂虾科Palaemonidae为主, 具有较高的优势度。物种优势度能在一定程度上反应群落的稳定性, 通常优势度低说明各物种在群落内的生态地位趋于平衡, 生物群落稳定(刘录三等, 2009)。安氏白虾在2017年的优势度达到了0.575, 如此高的优势度是生物群落的脆弱和生态失衡的表征。2018年与2017年相比, 杭州湾优势种增加了辐鳍鱼纲Actinopterygii的龙头鱼, 安氏白虾的优势度有所下降, 从优势种的角度看, 这些变化有益于群落稳定, 意味着该水域生态状况的改善。
三门湾是半封闭海湾, 环境相对稳定, 比杭州湾更适宜底栖动物的生长, 因此三门湾的优势种种类比杭州湾丰富。在三门湾优势度最高的物种是中国毛虾, 优势度为0.248, 远低于安氏白虾在杭州湾的优势度, 可认为三门湾的群落结构更加稳定。2018年与2017年相比, 优势种增加了辐鳍鱼纲的孔鰕虎鱼, 纵肋细纹螺和脊尾白虾取代了红带织纹螺和中国毛虾的优势地位, 总体上优势种的组成并未出现较大的变化。杭州湾和三门湾共同的优势种仅有脊尾白虾一种, 说明两个海域的底栖群落存在较大差异。值得注意的是, 中国毛虾在2017年优势度极高而在2018年未出现, 作为一种广盐、广温的物种(Xiao, 1993), 中国毛虾对环境的适应能力强, 其消失是由人类活动引起而非自然原因造成的可能性更高。
与历史资料进行比较(表3), 发现自2001年开始直到2018年, 长臂虾科始终是杭州湾大型底栖动物优势种的重要组成成分, 其优势地位十分稳定。杭州湾海域的人类活动频繁, 污染较为严重(贾海波等, 2014), 以长臂虾科为食的鱼类数量锐减, 给长臂虾科的种群发展提供了有利条件, 其广盐的特性也适宜在环境因子变化剧烈的河口生存。从时间尺度上看, 杭州湾优势种的种类出现减少的趋势, 种类最多的是2001年有9种, 最少的2017年仅剩2种, 优势种对生态系统功能有重要的控制作用(Smith, 2003), 其种类的减少显然会对该海域生态功能产生影响。相比杭州湾历史资料, 三门湾的历史资料更少, 且与本研究差异较大, 不存在相同的优势种。采样工具的不同是造成差异的主要原因, 本研究使用的阿氏拖网用于采集底上动物和底游动物, 而采泥器采集的多是底内动物, 表中杭州湾的历史研究采用不同的采样工具得到的优势种数据也有着明显的差异。底上动物和底游动物都是底栖动物的重要组成, 能够影响底栖群落结构, 增加生物多样性(Bradshaw, 2003), 底上动物和底游动物调查数据的补充对杭州湾和三门湾的底栖生态研究具有重要的意义。
表3 杭州湾和三门湾近20年来大型底栖动物优势种

Tab.3 The dominant species of macrobenthos in Hangzhou Bay and Sanmen Bay in recent decades
3.3 大型底栖动物群落结构特征及多样性分析
聚类分析和nMDS排序的结果表明杭州湾Q8、Q9、Q10站位的大型底栖动物群落与杭州湾其他站位的大型底栖动物群落差异较大, 将杭州湾与三门湾的数据一起分析, 发现这三个站位的大型底栖动物群落结构与三门湾站位有着更高的相似度。Q8、Q9、Q10站位靠近宁波市沿岸, 地理环境与三门湾更为接近, 底栖群落的结构往往与底质环境密切相关(Van Hoey, 2004; Zhou, 2007), 相似的底质环境容易形成相似的底栖群落。三门湾大型底栖动物群落在2017年和2018年两年间存在较大差异, 在聚类分析中三门湾不同年份的站位基本都不在一个聚类组里, 不同年份间高达81.95%的不相似度也给予了印证; 而杭州湾大型底栖动物群落在两年间变化不明显, 不同站位间的空间差异高于年份间的时间差异。张海生等(2007)的研究表明厄尔尼诺事件能对三门湾大型底栖群落产生明显的影响, 2018年正好发生了厄尔尼诺事件(包庆等, 2019), 给予了三门湾两年大型底栖动物群落差异一个可能的解释。
Shannon-Wienerr指数()、Pielou均匀度指数(')与Margalef物种丰富度指数()是常用的多样性指数(Diversity indices), 多用于判断群落变化、检测环境污染(Chainho, 2007; 罗先香等, 2009)。杭州湾10个站位的′、′、值显示该海域不同区域的群落生物多样性差异大, 说明杭州湾的环境污染情况复杂, 需要针对性的治理; 而三门湾的多样性指数分布均匀, 大型底栖动物群落受到的扰动较为平均, 可能是其相对封闭的地理环境所致。
将杭州湾和三门湾大型底栖动物多样性指数的均值与其他海湾的调查数据进行对比(表4)。从Margalef物种丰富度指数上看, 杭州湾和三门湾物种丰富度高于胶州湾、象山港和乐清湾, 仅低于大亚湾; 从Pielou均匀度指数上看, 杭州湾和三门湾的′值低于其他所列海湾,′值反映种间个体分布,′值小表明个体分布不均, 海域遭受污染(符芳菲, 2017); 从Shannon-Wiener指数上看, 三门湾生物多样性水平较高, 与海陵湾、胶州湾和大亚湾相近, 杭州湾多样性水平低, 仅高于象山港。综合来看, 大亚湾的生物多样性在所列海湾中最高, 生态环境最好, 三门湾处于中等水平, 杭州湾处于一个较低的水平。
表4 不同海湾海域的Margalef物种丰富度指数()、Pielou均匀度指数(′)和Shannon-Wiener指数(′)比较
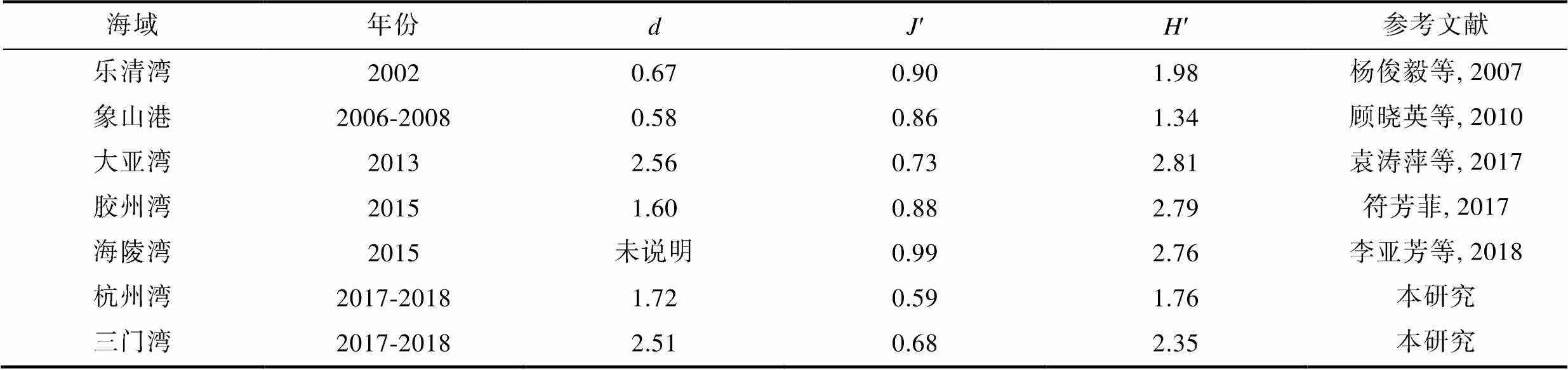
Tab.4 The variation of Margalef richness index (d), Pielou’s evenness index (J′) and Shannon-Wiener index (H′) of macrobenthos among different bays
4 结论
2017年8月和2018年8月在杭州湾和三门湾共发现大型底栖动物61种, 其中甲壳动物最多(22种), 其次是鱼类(20种)、软体动物(14种)、棘皮动物(2种)、刺胞动物(2种), 多毛类最少(1种)。杭州湾与三门湾大型底栖动物的组成相似, 都以甲壳动物、鱼类、软体动物为主, 甲壳动物的个体数最多。例外是, 三门湾在2018年出现大量锥螺, 使软体动物个体数超过甲壳动物。安氏白虾、脊尾白虾和龙头鱼是杭州湾的优势种, 两年间优势种的变化较小。三门湾的优势种比杭州湾丰富, 有锥螺、哈氏仿对虾、红带织纹螺、中国毛虾、脊尾白虾、孔鰕虎鱼、凹鳍孔鰕虎鱼和纵肋细纹螺8种。
分析杭州湾和三门湾的大型底栖动物群落结构特征, 杭州湾Q8、Q9、Q10站位底栖群落结构与杭州湾其他站位差异大, 更接近三门湾的站位; 三门湾的大型底栖动物群落在2017年和2018年有着明显差异。杭州湾不同区域的大型底栖动物群落的多样性差异大, 而三门湾大型底栖动物多样性相对均匀。海洋生态系统复杂, 受到众多因素影响, 推测杭州湾和三门湾大型底栖动物群落的变化是环境因子变化、厄尔尼诺事件、人类影响等综合作用的结果。
王 淼, 周 轩, 徐开达, 2019. 杭州湾北部安氏白虾的繁殖生物学特征. 动物学杂志, 54(4): 509—516
田 鹏, 李加林, 姜忆湄等, 2019. 海湾景观生态脆弱性及其对人类活动的响应——以东海区为例. 生态学报, 39(4): 1463—1474
包 庆, 吴小飞, 李矜霄等, 2019. 2018~2019年秋冬季厄尔尼诺和印度洋偶极子的预测. 科学通报, 64(1): 73—78
刘 迅, 王 莉, 顾晓英等, 2017. 浙江檀头山岛周围海域夏、秋季大型底栖动物群落结构特征. 海洋与湖沼, 48(3): 553—567
刘录三, 郑丙辉, 李宝泉等, 2012. 长江口大型底栖动物群落的演变过程及原因探讨. 海洋学报, 34(3): 134—145
刘录三, 孟 伟, 田自强等, 2008. 长江口及毗邻海域大型底栖动物的空间分布与历史演变. 生态学报, 28(7): 3027—3034
刘录三, 孟 伟, 李新正等, 2009. 辽东湾北部海域大型底栖动物研究: Ⅱ. 生物多样性与群落结构. 环境科学研究, 22(2): 155—161
寿 鹿, 曾江宁, 廖一波等, 2012. 杭州湾大型底栖动物季节分布及环境相关性分析. 海洋学报, 34(6): 151—159
李亚芳, 杜飞雁, 王亮根等, 2018. 粤西海陵湾养殖区邻近海域大型底栖动物生态学特征. 海洋与湖沼, 49(6): 1294—1307
杨俊毅, 高爱根, 宁修仁等, 2007. 乐清湾大型底栖生物群落特征及其对水产养殖的响应. 生态学报, 27(1): 34—41
宋秀凯, 刘爱英, 杨艳艳等, 2010. 莱州湾鱼卵、仔稚鱼数量分布及其与环境因子相关关系研究. 海洋与湖沼, 41(3): 378—385
张均龙, 史本泽, 赵 峰等, 2016. 中国海洋底栖生物学发展回顾与展望. 海洋科学集刊, (1): 194—204
张海生, 陆斗定, 朱小萤等, 2007. UK37沉积地层记录: 三门湾海表温度(SST)和El Niño现象及其对大型底栖动物生命活动的影响. 生态学报, 27(12): 4935—4943
罗民波, 2007. 第二届全国农业环境科学学术研讨会论文集. 天津: 中国农业生态环境保护协会, 499—506
罗先香, 杨建强, 2009. 海洋生态系统健康评价的底栖生物指数法研究进展. 海洋通报, 28(3): 106—112
周 红, 张志南, 2003. 大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用. 青岛海洋大学学报, 33(1): 58—64
袁涛萍, 李恒翔, 李 路等, 2017. 夏季大亚湾大型底栖动物群落结构. 热带海洋学报, 36(1): 41—47
贾海波, 唐静亮, 胡颢琰, 2014. 1992—2012杭州湾海域生物多样性的变化趋势及原因分析. 海洋学报, 36(12): 111—118
顾晓英, 陶 磊, 尤仲杰等, 2010. 象山港大型底栖动物群落特征. 海洋与湖沼, 41(2): 208—213
徐 炜, 曾晓起, 盛福利等, 2009. 北黄海大型底栖动物的拖网调查研究. 中国海洋大学学报, 34(S1): 19—24
徐 勇, 马 林, 李新正等, 2017. 春季长江口外海底层鱼类群聚特征及其与环境因子的关系. 海洋与湖沼, 48(6): 1383—1391
徐兆礼, 陈亚瞿, 1989. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系. 生态学杂志, 8(4): 13—15
符芳菲, 2017. 胶州湾大型底栖动物群落结构特征研究. 上海: 上海海洋大学硕士学位论文, 29—33
韩庆喜, 袁泽轶, 李宝泉等, 2012. 山东荣成临洛北湾夏季大型底栖动物群落生态学初步研究. 海洋科学, 36(9): 17—23
廖一波, 寿 鹿, 曾江宁等, 2011. 三门湾大型底栖动物时空分布及其与环境因子的关系. 应用生态学报, 22(9): 2424—2430
翟 璐, 徐宾铎, 纪毓鹏等, 2015. 黄河口及其邻近水域夏季鱼类群落空间格局及其与环境因子的关系. 应用生态学报, 26(9): 2852—2858
Bradshaw C, Collins P, Brand A R, 2003. To what extent does upright sessile epifauna affect benthic biodiversity and community composition? Marine Biology, 143(4): 783—791
Brey T, 2012. A multi-parameter artificial neural network model to estimate macrobenthic invertebrate productivity and production. Limnology and Oceanography: Methods, 10(8): 581—589
Chainho P, Costa J L, Chaves M L, 2007. Influence of seasonal variability in benthic invertebrate community structure on the use of biotic indices to assess the ecological status of a Portuguese estuary. Marine Pollution Bulletin, 54(10): 1586—1597
Fuhrmann M M, Pedersen T, Ramasco V, 2015. Macrobenthic biomass and production in a heterogenic subarctic fjord after invasion by the red king crab. Journal of Sea Research, 106: 1—13
Griffiths H J, Linse K, Barnes D K A, 2008. Distribution of macrobenthic taxa across the Scotia Arc, Southern Ocean. Antarctic Science, 20(3): 213—226
Han Q X, Wang Y Q, Zhang Y, 2013. Effects of intensive scallop mariculture on macrobenthic assemblages in Sishili Bay, the northern Yellow Sea of China. Hydrobiologia, 718(1): 1—15
Li X Z, Wang J B, Wang H F, 2005. Secondary production of macrobenthos from the East China Sea. Chinese Journal of Applied and Environmental Biology, 11(4): 459—462
Shojaei M G, Gutow L, Dannheim J, 2016. Common trends in German Bight benthic macrofaunal communities: Assessing temporal variability and the relative importance of environmental variables. Journal of Sea Research, 107: 25—33
Smith M D, Knapp A K, 2003. Dominant species maintain ecosystem function with non-random species loss. Ecology Letters, 6(6): 509—517
Van Hoey G, Degraer S, Vincx M, 2004. Macrobenthic community structure of soft-bottom sediments at the Belgian Continental Shelf. Estuarine, Coastal and Shelf Science, 59(4): 599—613
Wu R S S, Richards J, 1981. Variations in benthic community structure in a sub-tropical estuary. Marine Biology, 64(2): 191—198
Xiao Y, Greenwood J G, 1993. The biology of Acetes (Crustacea: Sergestidae). In: Ansell A D, Gibson R N, Barnes M. Oceanography and Marine Biology: An Annual Review. London: UCL Press, 31: 259—444
Yang H Y, Xue B, Jin L X, 2011. Polychlorinated biphenyls in surface sediments of Yueqing Bay, Xiangshan Bay, and Sanmen Bay in East China Sea. Chemosphere, 83(2): 137—143
Zhou H, Zhang Z N, Liu X S, 2007. Changes in the shelf macrobenthic community over large temporal and spatial scales in the Bohai Sea, China. Journal of Marine Systems, 67(3—4): 312—321
COMMUNITY COMPOSITION AND DIVERSITY OF MACROBENTHOS TRAWLED IN HANGZHOU BAY AND SANMEN BAY
YAN Run-Xuan1, HAN Qing-Xi1, WANG Xiao-Bo2
(1. School of Marine Sciences, Ningbo University, Ningbo 315211, China; 2. Marine Environmental Monitoring Centre of Ningbo, SOA, Ningbo 315012, China)
Based on the annual trawling macrobenthos from Hangzhou Bay and Sanmen Bay in the north of the East China Sea during August 2017 to August 2018, the community structure and diversity of macrobenthos in the two bays were studied. A total of 61 species of macrobenthos were collected from 10 stations of Hangzhou Bay and 6 stations of Sanmen Bay, among which the crustaceans were the most abundant macrobenthic taxa (22 species), followed by fish (20 species), molluscs (14 species), echinoderms (2 species), cnidarians (2 species), and polychaete (1 species). There were three dominant macrobenthic species in Hangzhou Bay and eight dominant species in Sanmen Bay.was the only common dominant species in the bays. Compared with those of 2017, the species and quantity of fish in Hangzhou Bay and Sanmen Bay increased significantly in 2018. The diversity index of different stations showed that the biodiversity in different areas of Hangzhou Bay was significantly different, while Sanmen Bay was relatively even. Clustering analysis and nMDS ordination for the macrobenthos presented that the community structure of macrobenthos in different stations of Hangzhou Bay was significantly different. The community structures of macrobenthos of three stations near the southern border of the Hangzhou Bay and close to the Sanmen Bay were similar to those from Sanmen Bay, and the benthic community of Sanmen Bay was quite different in 2017 and 2018. Therefore, we believed that the variations of benthic community in Hangzhou Bay and Sanmen Bay was related to the changes of environmental factors, human activities, and El Nino events.
Hangzhou Bay; Sanmen Bay; trawling macrobenthos; community composition; community structure
* 国家自然科学基金项目, 41676139。严润玄, 硕士研究生, E-mail: yanrunxuan@qq.com
韩庆喜, 副研究员, 硕士生导师; E-mail: hanqingxi@nbu.edu.cn; 王晓波, 高级工程师, E-mail: 34368002@qq.com
2019-12-23,
2020-02-11
Q958.8
10.11693/hyhz20191200272

