低氧下K562细胞向红系分化进程中GATA-1与miR-451a表达的相关性研究*
付成冰,刘 芳,牛志鹏,胡彩艳
(青海大学医学院 1高原医学研究中心,2生物化学教研室,青海西宁810000)
GATA结合蛋白1(GATA binding protein-1,GATA-1)是调控红系分化过程不可或缺的转录因子[1],它可通过调节微小 RNA(microRNA),如 microRNA-451a(miR-451a),实现对红系分化的精细调控。miR-451a主要富集在成熟红细胞内[2-3],其在红系的表达水平明显高于其它链系,且随着红系分化过程持续升高[4],动物和体外红系分化模型均证实miR-451a有助于红细胞成熟[5-6],提示miR-451a是调控红系分化的特异性microRNA。
低氧环境能促进骨髓造血干细胞向红系定向分化,结果使骨髓红系前体细胞增多[7-8]。低氧条件下大鼠骨髓CD71+细胞内GATA-1的表达显著高于对照组,表明低氧能诱发GATA-1的高表达[9]。然而,低氧条件下GATA-1与miR-451a的相关性及其在红系分化过程中的作用还不明确。本项工作以低氧条件下人慢性髓细胞性白血病K562细胞红系分化模型为研究对象[10],检测GATA-1和miR-451a在低氧下表达的变化趋势,并分析两者表达的相关性,为阐释GATA-1可能通过调控miR-451a参与促进低氧下红细胞分化过程提供实验依据。
材料和方法
1 试剂与仪器
K562细胞购自中国科学院上海细胞研究所。RPMI-1640培养液购自HyClone;胎牛血清购自四季青公司;氯化血红素(hemin chloride)购自北京索莱宝科技有限公司;总RNA提取试剂盒(DP419)、miRNA提取试剂盒(DP501)、miRNA逆转录试剂盒(KR211-02)和miRNA荧光定量PCR试剂盒(208054)均购自TIANGEN;RNA逆转录试剂盒(K1622)、BCA蛋白定量试剂盒和RNA荧光定量试剂盒(160025891)购自Thermo Fisher Scientific;兔抗人GATA-1单克隆抗体(ab181544)和α-tubulin鼠单克隆抗体购自Abcam;山羊抗兔IgG(SA00001-2)购自 Proteintech;CD235a流式抗体 APC-Cy7(349116)和同型抗体(400230)购自BioLegend。所用引物均由上海生工生物技术公司合成,序列见表1。GATA-1过表达慢病毒(LV-GATA1,记为Up)和GATA-1过表达阴性对照慢病毒(LVCON238,记为NC-Up)、GATA-1干扰慢病毒[LV-GATA1-RNAi,记为Down]和GATA-1干扰阴性对照慢病毒(LVCON077,记为NC-Down)均购自上海吉凯基因科技有限公司。三气培养箱(Binder);荧光显微镜(Zeiss);PCR扩增仪(Eppendorf);7500型荧光定量PCR仪(Applied Biosystems);流式细胞仪(Beckman);Amersham Imager 600化学发光成像分析仪(GE Healthcare)。
2 方法
2.1 细胞培养及分化模型的建立 K562细胞培养于含10%胎牛血清和1%双抗(青霉素和链霉素)的RPMI-1640培养液中,分为低氧(hypoxia)组和常氧(normoxia)组,以 5×107/L 的密度分别置于低氧(37℃、1%O2、94%N2、5%CO2、饱和湿度)和常氧(37℃、5%CO2、饱和湿度)培养箱。采用40 μmol/L hemin chloride诱导K562细胞分化至48和72 h。
2.2 Western blot检测GATA-1核蛋白的表达 提取细胞核蛋白,BCA法定量后取5 μg核蛋白进行10%SDS-PAGE;转膜后,5%脱脂奶粉封闭2 h,4℃孵育GATA-1抗体(1∶10 000)过夜;0.1%TBST清洗后,加II抗(1∶10 000),室温封闭1 h,洗膜、显影曝光。以α-tubulin为内参照,目的蛋白的相对表达量=目的蛋白条带灰度值/α-tubulin条带灰度值。
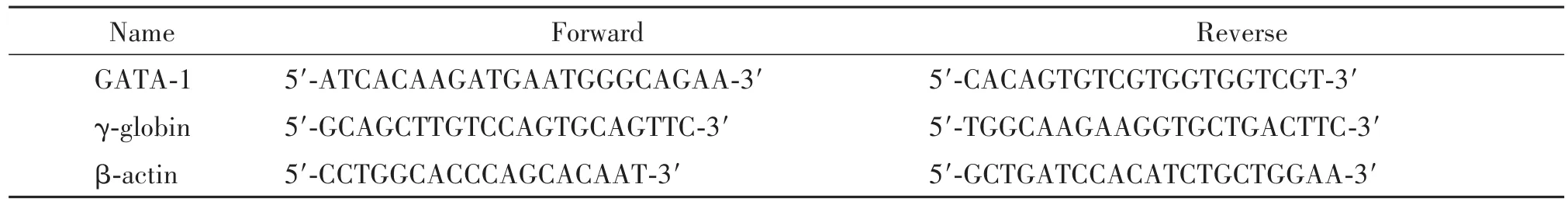
表1 RT-qPCR引物序列Table 1.The sequences of the primers for RT-qPCR
2.3 RT-qPCR检测γ-globin和GATA-1 mRNA及miR-451a的表达
2.3.1 γ-globin和GATA-1 mRNA表达的检测 提取细胞总RNA,逆转录成cDNA,以β-actin为内参照,采用2-ΔΔCt方法检测γ-globin和GATA-1的mRNA表达。扩增参数为:95℃ 2 min;95℃ 5 s,60℃ 30 s,40个循环。每个样本重复3次。
2.3.2 miR-451a表达的检测 提取细胞总miRNA,以Oligo(dT)18为引物逆转录成cDNA。以U6为内参照,采用2-ΔΔCt方法检测miR-451a的表达。扩增参数为:95℃ 15 min;94℃ 20 s,60℃ 34 s,40个循环。每个样本重复3次。
2.4 慢病毒感染 将对数生长期的K562细胞以5×107/L的密度接种于6孔板,取Up[滴度4×1011TU/L,感染复数(multiplicity of infection,MOI)=30]和NCUp(滴度 1×1012TU/L,MOI=30)感染 K562细胞,37℃、5%CO2、饱和湿度培养箱培养12 h后补加1 mL含10%胎牛血清的RPMI-1640培养液,培养至96 h,荧光显微镜下观察病毒载体中插入的GFP表达情况。Down(滴度4×1011TU/L,MOI=30)和NC-Down(滴度1×1012TU/L,MOI=30)的感染方法同上。
2.5 流式细胞术检测CD235a的表达 CD235a,又称血型糖蛋白A(glycophorin A,GPA),是红系细胞表面特异性标志物,其表达量随红系分化逐步增高[11]。收集诱导后的细胞,用预冷的PBS清洗2遍,以1×1010/L重悬细胞。取100 μL细胞悬液加入5 μL CD235a抗体,室温避光孵育15 min。PBS清洗后,弃上清,用500 μL PBS重悬细胞,上机检测。
2.6 细胞染色
2.6.1 联苯胺染色 收集细胞,离心弃上清,用PBS清洗2遍后,500 μL PBS重悬。加联苯胺染液15 μL,3%H2O210 μL,3 min后加1 μL硝普钠溶液。取10 μL细胞悬液均匀在载玻片上,每个视野下大约200个细胞,计算阳性细胞百分比。未分化的细胞不着色,分化的细胞呈深蓝色。
2.6.2 瑞氏-吉姆萨染色 将收集的细胞均匀涂抹在载玻片上,滴加染液A(0.8~1.0 mL)覆盖整个涂抹区域,染色1 min;再滴加染液B(体积是A液的2~3倍),用吸耳球吹匀,染色约10 min。冲洗残存染液,晾干后镜下观察并进行图片采集。
3 统计学处理
应用SPSS 19.0软件进行统计学分析,各组数据均用均数±标准差(mean±SD)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,采用Spearman进行相关性分析,以P<0.05为差异有统计学意义。
结 果
1 K562细胞红系分化模型的复制
RT-qPCR结果显示,常氧组γ-globin的mRNA表达在48 h与0 h相比无显著性差异(P>0.05),低氧组48 h其表达量显著高于0 h(P<0.05);两组γ-globin的mRNA表达在72 h表达均显著增高(P<0.05),并且在72 h低氧组显著高于常氧组(P<0.05),见图1A。与0 h相比,两组细胞联苯胺染色阳性率均显著升高(P<0.05),且48和72 h低氧组联苯胺染色阳性率均显著高于常氧组(P<0.01),见图1B。与0 h相比,两组细胞表面CD235a在48 h时表达均显著升高(P<0.05);72 h低氧组CD235a的表达显著高于常氧组(P<0.01),见图1C。
2 GATA-1和miR-451a的表达
Western blot检测结果显示,48 h低氧组GATA-1蛋白的表达量与常氧组相比无显著差异(P>0.05),72 h低氧组GATA-1蛋白的表达量显著高于常氧组(P<0.05);组内比较结果显示,低氧组GATA-1蛋白的表达量在72 h显著高于48 h(P<0.05),常氧组GATA-1蛋白的表达量在48和72 h无显著差异(P>0.05),见图2A。RT-qPCR结果显示,低氧组GATA-1 mRNA的表达量在72 h较48 h显著升高(P<0.05),且显著高于常氧组(P<0.05),常氧组在48和72 h无显著差异(P>0.05),见图2B。miR-451a在低氧组72 h时表达显著增高(P<0.05),且显著高于常氧组(P<0.05),常氧组miR-451a的表达在48和72 h无显著差异(P>0.05),见图2C。
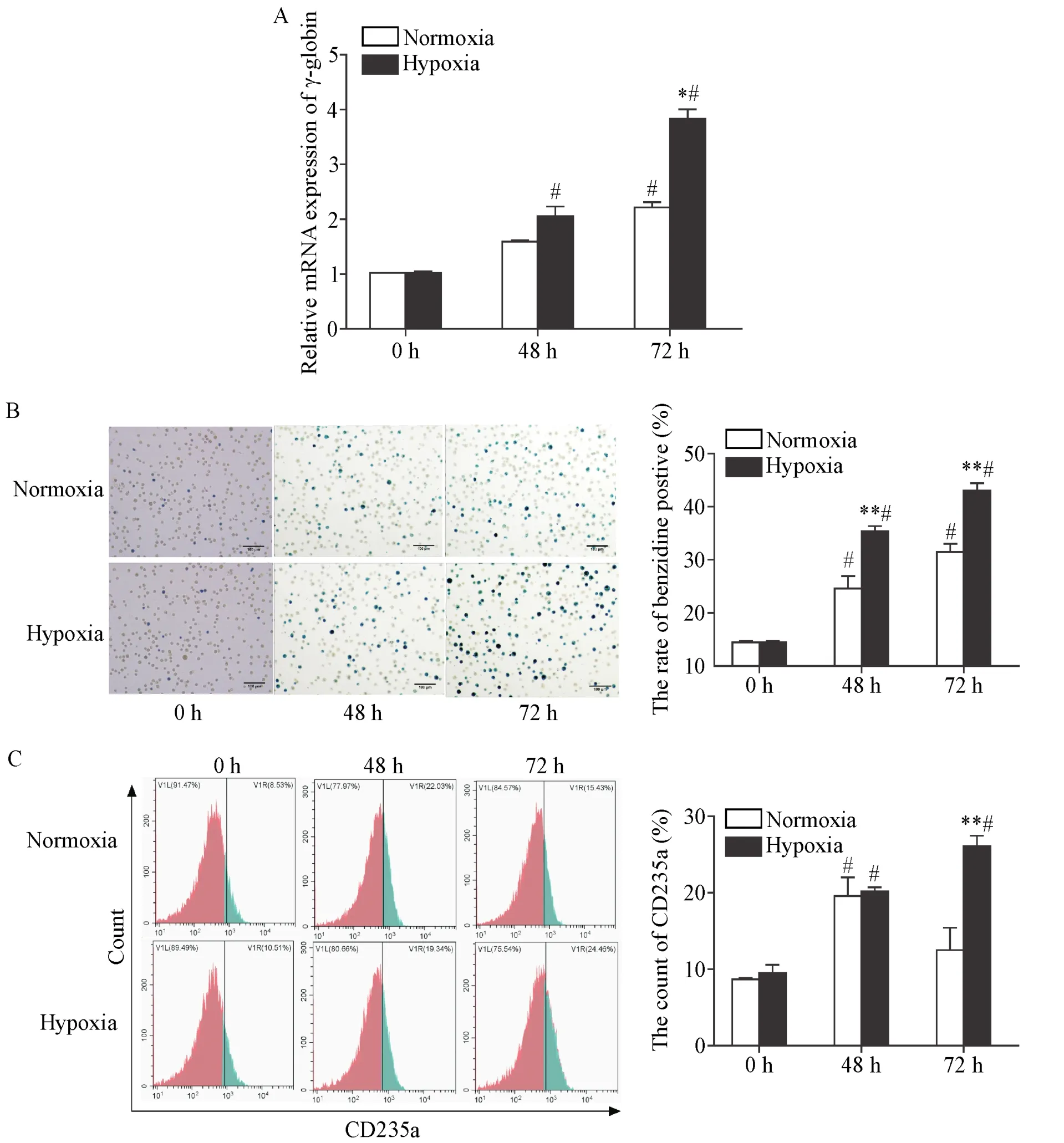
Figure 1.The erythroid differentiation model of K562 cells was replicaed.A:the mRNA expression of γ-globin was detected by RT-qPCR;B:the positive cells of benzidine staining at 48 h and 72 h(scale bar=100 μm);C:the expression of erythroid specific marker,glycophorin A(CD235a),was detected by flow cytometry.Mean±SD.n=3.*P<0.05,**P<0.01 vs normoxia group;#P<0.05 vs 0 h.图1 K562细胞向红系分化模型的复制
3 低氧条件下GATA-1和miR-451a表达的相关性分析
相关性分析结果显示,低氧组GATA-1的mRNA表达与miR-451a的表达呈正相关,相关系数为r=0.850(P<0.01),见图3。
4 低氧条件下过表达或干扰GATA-1的表达对红系分化的影响
4.1 过表达GATA-1可促进红系分化 与光学显微镜同一视野相比,荧光倒置显微镜显示,Up组90%以上细胞呈绿色荧光,见图4。Western blot检测过表达后GATA-1的表达量,结果显示,Up组出现双条带且表达量显著高于NC-Up组(P<0.05),见图5。低氧下Up组γ-globin的表达在48和72 h均显著高于NC-Up组,见图6A。同时,联苯胺染色结果也显示GATA-1过表达可显著增加联苯胺阳性率(P<0.05),见图6B。流式细胞术结果显示,低氧诱导72 h后Up组细胞表面CD235a的表达显著高于NC-Up组(P<0.05),见图6C。细胞形态实验结果显示,Up组在48和72 h时体积增大、核偏移和核缩小的细胞数目均显著多于NC-Up组(P<0.01),见图6D。

Figure 2.Expression of GATA-1 and miR-451a in the two groups.A:the protein expression of GATA-1 in the nucleus detected by Western blot(N:normoxia;H:hypoxia);B:the mRNA expression of GATA-1 detected by RT-qPCR;C:the expression of miR-451a detected by RT-qPCR.Mean±SD.n=3.*P<0.05 vs normoxia group;#P<0.05 vs 48 h.图2 GATA-1和miR-451a在两组细胞中的表达
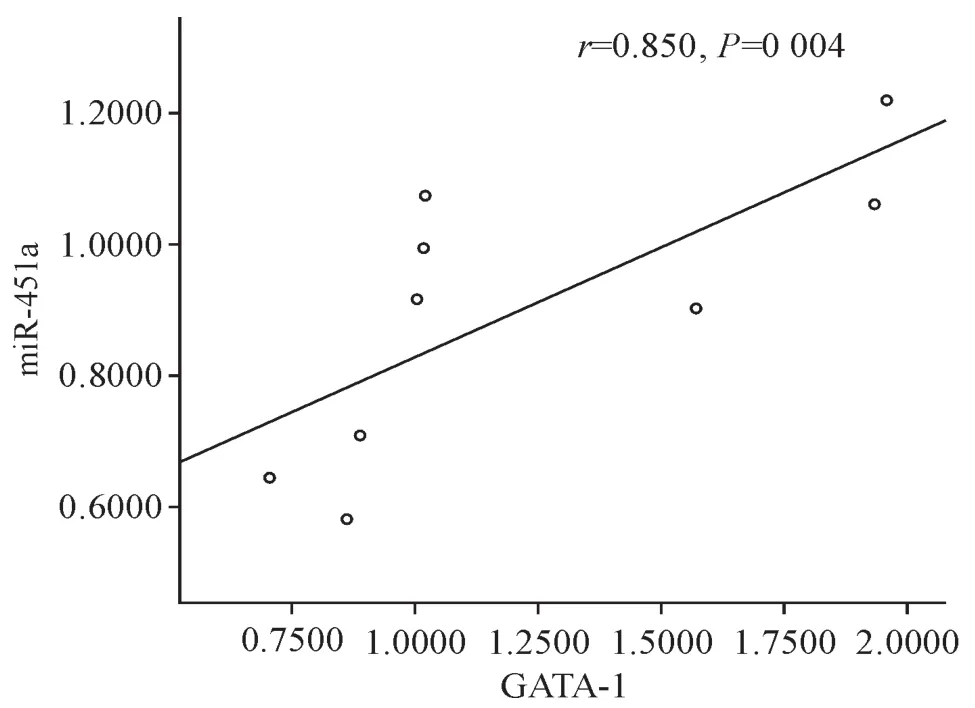
Figure 3.Correlation analysis between GATA-1 and miR-451a under hypoxia.图3 GATA-1与miR-451a在低氧条件下的相关性分析

Figure 4.The fluorescence detection of GATA-1 over-expression lentivirus 96 h after infection(scale bar=50 μm).A,B:NC-Up group;C,D:Up group.A,C:light microscopy;B,D:fluorescence microscopy.图4 GATA-1过表达慢病毒感染96 h后的荧光检测
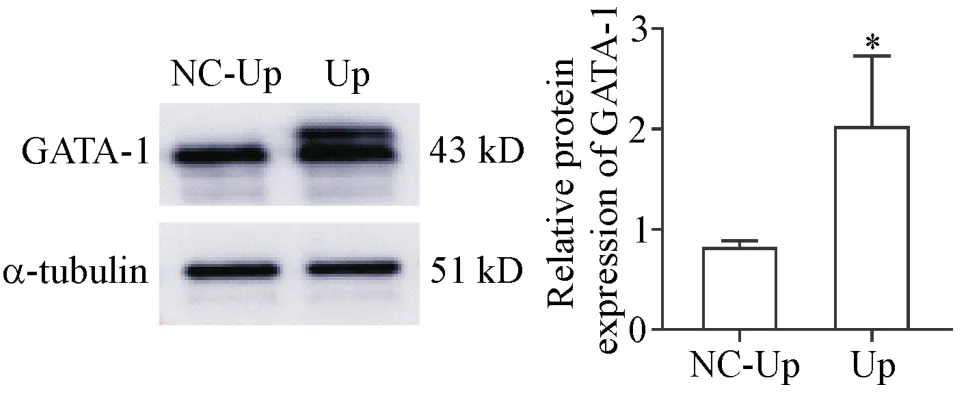
Figure 5.The protein expression of GATA-1 in UP group and NC-Up group.Mean±SD.n=3.*P<0.05 vs NC-Up group.图5 过表达慢病毒感染后GATA-1蛋白表达的检测
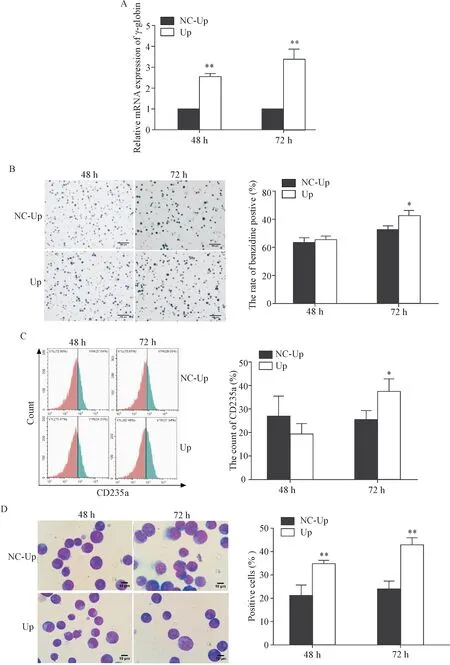
Figure 6.GATA-1 over-expression enhanced erythroid differentiation of the K562 cells under hypoxia condition.A:the relative mRNA expression of γ-globin detected by RT-qPCR;B:the results of benzidine staining(scale bar=100 μm);C:the expression of CD235a detected by flow cytometry;D:the results of Wright-Giemsa staining(scale bar=10 μm).Mean±SD.n=3.*P<0.05,**P<0.01 vs NC-Up group.图6 低氧下过表达GATA-1后促进红系分化
4.2 干扰GATA-1可抑制红系分化 与光学显微镜同一视野相比,荧光倒置显微镜显示,Down组大于90%的细胞呈绿色荧光,见图7。Western blot检测干扰后GATA-1的表达量,Down组显著低于NC-Down组(P<0.05),见图 8。与NC-Down组相比,低氧下Down组γ-globin mRNA的表达水平在72 h显著降低(P<0.05),见图9A。联苯胺染色结果也显示干扰GATA-1可显著降低联苯胺阳性率(P<0.05),见图9B。流式细胞术结果显示,Down组在诱导72 h后细胞表面的CD235a表达水平显著低于NC-down组(P<0.05),见图9C。细胞形态实验结果显示,与NCDown组相比,Down组在72 h时体积增大、核偏移和核缩小的细胞数目显著减少(P<0.01),见图9D。

Figure 7.The fluorescence detection of GATA-1 knock-down lentivirus 96 h after infection(scale bar=50 μm).A,B:NC-Down group;C,D:Down group.A,C:light microscopy;B,D:fluorescence microscopy.图7 GATA-1干扰慢病毒感染96 h后荧光检测
5 低氧条件下过表达或抑制GATA-1后miR-451a的表达检测
5.1 过表达GATA-1可促进miR-451a表达 RT-qPCR检测GATA-1过表达后miR-451a的表达,结果显示,低氧下诱导48 h后Up组miR-451a的表达量与NC-Up组相比无显著差异(P>0.05),72 h时Up组miR-451a的表达量显著高于NC-Up组(P<0.05),见图10。
5.2 干扰GATA-1可抑制miR-451a表达 RT-qPCR检测GATA-1抑制后miR-451a的表达,结果显示,低氧下诱导48 h后Down组miR-451a的表达量与NCDown组相比无显著差异(P>0.05),72 h时Down组miR-451a的表达量显著降低(P<0.05),见图11。
讨 论
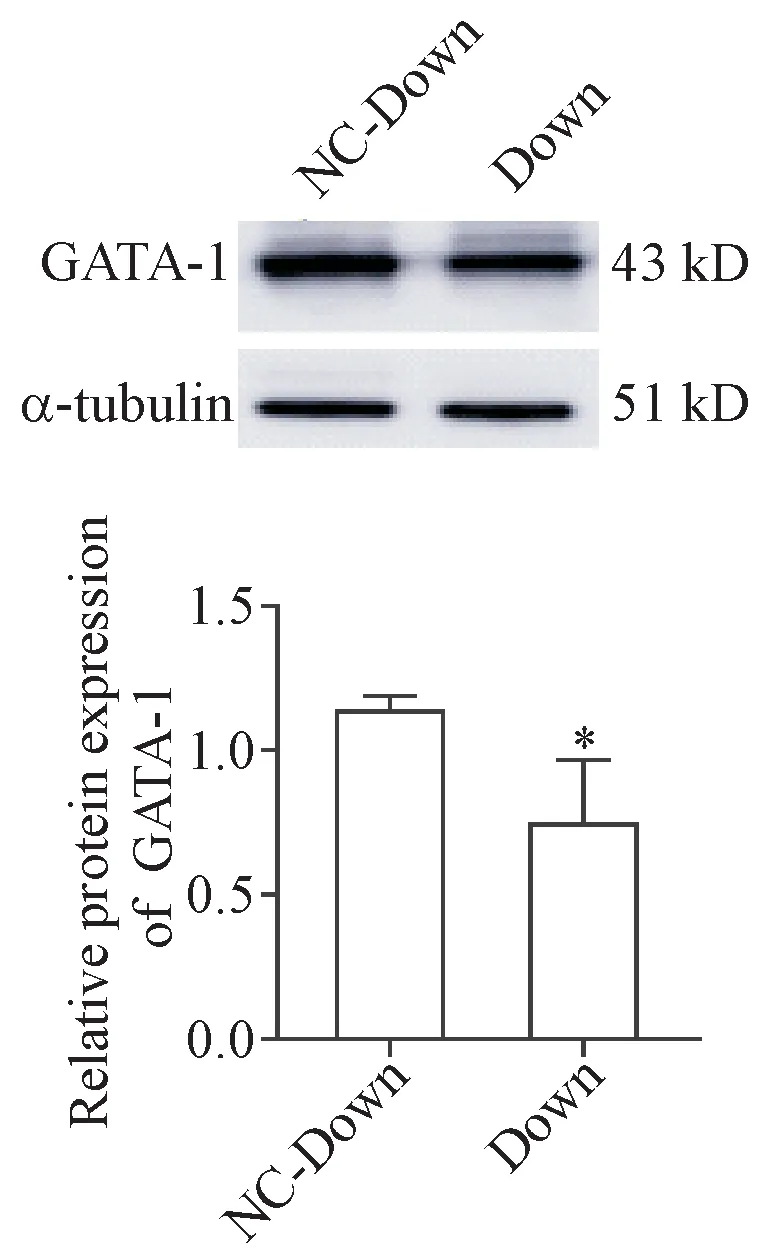
Figure 8.The protein expression of GATA-1 in Down group and NC-Down group.Mean±SD.n=3.*P<0.05 vs NCDown group.图8 干扰慢病毒感染后GATA-1蛋白表达的检测
GATA-1作为红系核心转录因子,主要通过靶向激活β-珠蛋白基因[12]、促红细胞生成素及其受体(erythropoietin/erythropoietin receptor,Epo/EpoR)[13]和microRNAs等的表达,促进红系分化。miR-451a的表达受GATA-1调控。在K562细胞红系分化模型中,GATA-1可激活miR-144/451基因簇上游区164 bp、570 bp和1 281 bp三个保守位点[14],促进 miR-451表达。在人的17号染色体上,GATA-1可结合miR-144/451基因簇上游3.8 kb位点,激活RNA聚合酶Ⅱ对miR-451的转录[15]。利用基因芯片技术比较红系分化中miRNAs表达谱和GATA-1缺失的原红细胞系G1E在GATA-1恢复后miRNA的表达,显示miR-451a在正常红系分化过程中表达逐渐上调,且受到GATA-1的正向调控[16],表明GATA-1正向调控miR-451具有促红系分化作用。鼠的胚胎干细胞过表达miR-451a后,其细胞内血红蛋白含量增高并伴有细胞表面 CD235a和TER-119 表达升高[5],提示miR-451过表达能促进鼠胚胎干细胞向红系分化。miR-451在脐血来源的CD34+造血干祖细胞红系分化的早期阶段开始表达,持续到晚幼红阶段并处于高表达,其可作用于GATA-2的3′-非翻译区(3′-untranslated region,3′-UTR),下调GATA-2的表达继而促进红细胞成熟[17-18]。研究显示,低氧下GATA-1表达增高。利用质谱分析大鼠NRK-49F细胞在低氧下核蛋白表达变化时,显示GATA-1的表达显著增高[19],提示GATA-1受低氧调控。低氧下肺泡II型细胞内GATA-1表达显著升高,诱导血红蛋白表达升高[20]。进一步研究证实,低氧诱导因子1(hypoxia-inducible factor-1,HIF-1)在低氧下可上调K562细胞和CD34+细胞内GATA-1的表达,促进红系分化[21],满足细胞在低氧下的需氧要求。本实验结果也显示,低氧组K562细胞中GATA-1的表达随诱导时间延长显著增加并且在72 h其表达量显著高于常氧组。但miR-451a在低氧下是否影响红系分化鲜有报道。本研究结果显示,miR-451a的表达虽然在常氧组48 h和72 h无显著变化,但在低氧组其表达显著增加且表达量在72 h时显著高于常氧组,提示低氧能够诱导miR-451a表达促进红系分化。但GATA-1对miR-451a的调控关系在低氧下红系分化过程中的作用还不清楚。
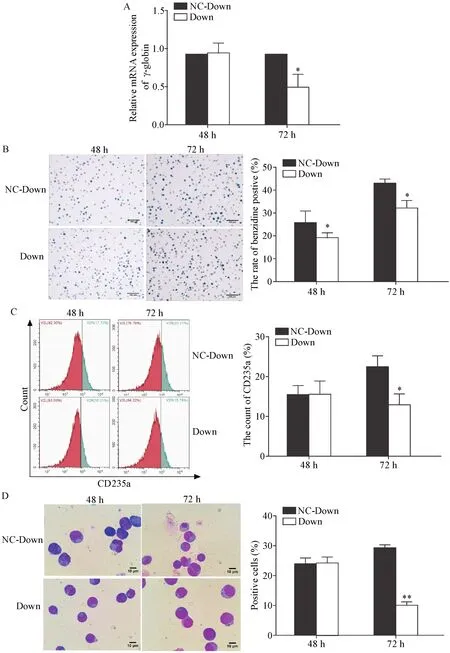
Figure 9.GATA-1 knock-down inhibited erythroid differentiation of the K562 cells under hypoxia condition.A:the relative expression of γ-globin detected by RT-qPCR;B:the results of benzidine staining(scale bar=100 μm);C:the expression of CD235a detected by flow cytometry;D:the results of Wright-Giemsa staining(scale bar=10 μm).Mean±SD.n=3.*P<0.05,**P<0.01 vs NC-Down group.图9 低氧下干扰GATA-1后抑制红系分化
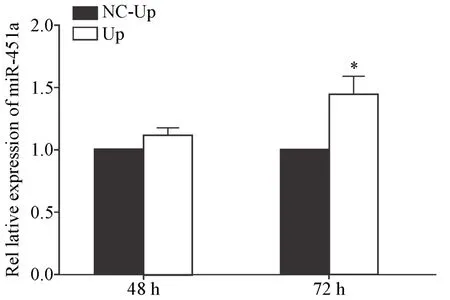
Figure 10.GATA-1 over-expression increased the expression of miR-451a under hypoxia.The expression of miR-451a was detected by RT-qPCR.Mean±SD.n=3.*P<0.05 vs NC-Up group.图10 低氧下过表达GATA-1可促进miR-451a表达
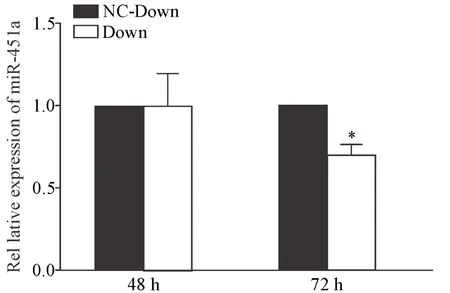
Figure 11.GATA-1 knock-down decreased the expression of miR-451a under hypoxia.The expression of miR-451a was detected by RT-qPCR.Mean±SD.n=3.*P<0.05 vs NC-Down group.图11 低氧下干扰GATA-1可抑制miR-451a表达
依据文献报道,本课题组复制低氧下K562细胞红系分化模型。γ-globin和CD235a的表达均表现为随诱导时间延长显著增加,表明低氧K562细胞红系分化模型复制成功。低氧组γ-globin的mRNA表达显著高于常氧组,这一结果与Kaneko等[22]研究结果相符合。利用联苯胺染色法检测血红蛋白的表达可用来评价红系分化程度[23]。联苯胺染色结果显示低氧组细胞阳性率显著高于常氧组,与γ-globin结果相一致,说明低氧有助于γ-globin表达。GATA-1与miR-451a间的相关性分析表明,低氧组GATA-1与miR-451a呈现正相关关系,提示低氧下GATA-1与miR-451a之间的正相关性与K562细胞红系分化有关。采用慢病毒感染实验验证其相关性。低氧下GATA-1过表达能够增强红系分化指标的表达,同时瑞氏-吉姆萨染色作为分析红细胞典型特征变化的方法[24],其结果显示Up组体积增大、核偏移和核缩小的细胞数目比NC-Up组显著增多,提示低氧下GATA-1过表达有利于K562细胞红系分化。低氧下干扰GATA-1表达可减弱红系分化指标的表达,同时瑞氏-吉姆萨染色显示Down组体积增大、核偏移和核缩小的细胞数目显著减少,提示低氧下干扰GATA-1表达能抑制红系分化。低氧下过表达GATA-1后miR-451a在72 h显著高于对照组,而干扰GATA-1后miR-451a在72 h显著低于对照组,提示低氧下GATA-1可正向调控miR-451a的表达。
综上所述,本研究通过K562细胞红系分化模型,分析低氧下GATA-1与miR-451a的表达情况和相关关系,提示低氧可诱导GATA-1表达增高,进而加强miR-451a的表达,这种正相关关系参与低氧促红系分化过程。

