成年小鼠背部皮肤角质形成细胞的原代培养及其与乳鼠角质形成细胞的对比性研究*
邓 颖,王雪儿,张 琳
(南方医科大学基础医学院组织胚胎学教研室,广东广州510515)
皮肤是人体面积最大的器官,由表皮和真皮构成,以皮下组织与深层组织相连。表皮是皮肤的浅层,分为厚皮和薄皮。厚皮自下而上分为基底层、棘层、颗粒层、透明层和角质层。角质形成细胞(kerati-nocytes,KC)是皮肤表皮的主要构成细胞,占表皮细胞的90%以上。表皮由基底层到角质层的结构变化反映了角质形成细胞增殖、迁移、分化等新陈代谢过程[1]。小鼠作为常用的皮肤发育和皮肤疾病动物模型,在皮肤科学研究中发挥重要作用。小鼠背部皮肤与腹部皮肤占小鼠全身皮肤总面积的90%以上,因为小鼠背部皮肤具有完整的分层结构,在生理以及解剖状态更接近于人体皮肤,因此研究者们往往选用小鼠背部皮肤进行体内实验。
然而,目前科学研究所使用的角质形成细胞主要为人源性的细胞系和细胞株。2017年,Zhang等[2]尝试利用小鼠尾部皮肤进行了角质形成细胞的分离培养。但是,小鼠背部皮肤与尾部皮肤在收缩能力、胶原以及表皮层数、毛囊分布、黑色素沉着等方面都存在着差异[3-4]。值得一提的是,目前关于皮肤创伤愈合、皮肤毛囊周期、皮肤光损伤及光老化等研究使用的小鼠皮肤模型几乎均来自于成年小鼠背部皮肤[5-6]。然而,目前尚未见到良好的成年小鼠背部皮肤角质形成细胞分离方法。因此,构建有效且高生长率的小鼠皮肤角质形成细胞,尤其是成年小鼠背部皮肤角质形成细胞原代分离培养方法尤为重要。
本研究首先利用4种方法分离成年小鼠背部皮肤表皮与真皮,探索成年小鼠表皮与真皮最适宜的分离条件;其次,分离表皮角质形成细胞,通过调整种板密度和种板方式,建立有效且高生长率的成年小鼠背部皮肤角质形成细胞原代分离培养方法;再次,对乳鼠皮肤角质形成细胞和成年小鼠皮肤角质形成细胞的增殖、集落形成效率与凋亡情况进行检测,探讨二者生物学功能的差异。
材料和方法
1 动物
由南方医科大学实验动物中心[动物许可证号为SCXK(粤)2016-(1029)]提供出生1日的C57BL/6J乳鼠(P1 MICE)以及出生12周龄的健康雄性SPF级C57BL/6J小鼠(12W MICE),饲养于南方医科大学实验动物中心SPF级动物房,室内温度22~25℃,相对湿度为40%~60%,小鼠自由饮水饮食。
2 实验试剂与仪器
胰蛋白酶消化液(含0.25%胰酶和0.02%EDTA)、75%乙醇、碘伏、DPBS 溶液(Gibco);Dispase II(Sigma);内含生长因子、hydrocortisone、transferrin、epinephrine、GA-1000、BPE、rhEGF、insulin 的 KBMGOLD培养基(LONZA);15 mL离心管、50 mL离心管、3 cm培养皿、48孔细胞培养板和96孔细胞培养板(NEST);Cell-light EdU Apollo488(锐博生物);CCK-8试剂(Bimake);TUNEL Bright Red apoptosis detection kit(Vazyme);结晶紫染色液(碧云天)。移液枪和无菌常用手术器械、细胞培养箱(Thermo);超净工作台(Airtech);相差显微镜(Leica);离心机(Sigma);酶标仪(Biotek)。
3 主要方法
3.1 成年小鼠背部皮肤表皮与真皮的分离 取同一只成年小鼠背部皮肤分为2 cm×2 cm的4个小块,用4种不同消化分离方式分离表皮-真皮,具体方法如下:12周龄C57BL/6J小鼠,断颈处死,经脱毛处理后,分别置于75%乙醇、碘伏、75%乙醇中浸泡1 min,取成年小鼠整块背部皮肤,修剪成约2 cm×2 cm正方形,彻底分离皮下组织、血管。含双抗DPBS漂洗3次。表皮在上,真皮在下,平铺置于3 cm小皿内,分别采用如下所述4种方法进行表皮-真皮消化分离:(1)中性蛋白酶消化法:沿组织边缘加入1.5 mL自配中性蛋白酶,4℃消化22 h;(2)胰蛋白酶消化法:沿组织边缘加入1.5 mL 0.25%胰蛋白酶,4℃消化22 h;(3)中性蛋白酶+胰蛋白酶联合消化法:沿组织边缘加入750 μL自配中性蛋白酶与750 μL 0.25%胰蛋白酶,4℃消化22 h;(4)中性蛋白酶+胰蛋白酶二步消化法:沿组织边缘加入1.5 mL自配中性蛋白酶,4℃消化22 h。观察到皮肤表面浮起,使消化酶没过真皮,尽量保持表皮干燥。消化后,分离表皮,剪碎,加入200 μL 0.25%胰蛋白酶消化2 min,用胰酶抑制剂终止消化。
3.2 乳鼠背部皮肤表皮与真皮的分离 出生1日的C57BL/6J乳鼠在断颈后用75%酒精消毒2次,移入超净工作台内,PBS泡洗去除小鼠皮肤表面残余酒精,取乳鼠背部皮肤。将其修剪成约2 cm×2 cm正方形,平铺置于3 cm小皿内,以中性蛋白酶消化法进行表皮-真皮分离。
3.3 角质形成细胞的分离与原代培养 取消化后的皮肤,在含有消化酶的小皿内分离表皮与真皮。取表皮组织置于一3 cm小皿内,漂洗(为避免漂洗液的不同造成的后续结果差异,所有分组均采用胰酶抑制剂漂洗),剪碎,悬液过滤,1 000 r/min离心5 min,弃上清,用含0.06 mmol/L Ca2+的KBM培养基吹打,制成细胞悬液,接种于培养皿上,0.5 h后补液。24 h后,换用含0.03 mmol/L Ca2+的KBM培养基。
3.4 角质形成细胞的鉴定 细胞固定、封闭后,加入角蛋白14(keratin 14,K14)I抗4℃孵育过夜。添加荧光 II抗孵育 20 min,Hoechst(1∶1 000)染核 10 min。镜下观察,显微镜拍照。
3.5 EdU法检测角质形成细胞的增殖 角质形成细胞以每孔1.6×104的密度接种于48孔板,培养3 d后,EdU标记细胞并进行细胞固定以及Apollo染色。最后,Hoechst染核。镜下观察统计。胞核染为绿色荧光为EdU阳性细胞。镜下每例随机选取5个高倍视野,利用ImageJ软件计数阳性细胞的百分率。
3.6 CCK-8法检测角质形成细胞的活力 角质形成细胞以每孔3.2×103的密度接种于96孔板。48 h换液。在不同时间段加入100 μL的含0.03 mmol/L Ca2+的培养基与CCK-8试剂10∶1的混合液,每次测量设置1个本底孔,孵育4 h。孵育前用DPBS洗2遍。孵育后用酶标仪测量在450 nm的吸光度(A)值,测量值减去本底值为实际值。
3.7 TUNEL检测角质形成细胞的凋亡 角质形成细胞以每孔1.6×104的密度接种于48孔板,细胞培养3 d后,固定透膜,用Equihibration Buffer平衡25 min,TdT孵育缓冲液37℃孵育1 h。Hoechst染核。镜下观察统计。胞核显示红色荧光为TUNEL阳性细胞。镜下每例随机选取5个高倍视野,利用ImageJ软件计数阳性细胞的百分率。
3.8 结晶紫染色法检测角质形成细胞的集落形成率 将角质形成细胞以每皿1.6×105的密度接种于3 cm培养皿中培养3 d,应用结晶紫染色方法,镜下观察细胞的集落形成情况并计数,仅计算集落的细胞数大于10的细胞团。利用ImageJ软件统计皿内5个最大集落的面积并进行统计学分析。
4 统计学方法
实验数据用SPSS 22.0软件进行数据分析,采用GraphPad Prism 7.0作图,计量资料采用均数±标准差(mean±SD)表示,两组间比较采用独立样本t检验,多组间比较使用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 4种不同消化方式对成鼠背部皮肤角质形成细胞原代分离培养的影响
1.1 4种不同消化方式分离成年小鼠背部皮肤的消化时间对比 观察分离成年小鼠真皮与表皮时表皮的状态。用4种不同分离方式4℃分离表皮与真皮,可见中性蛋白酶消化14 h、胰蛋白酶消化16 h、中性蛋白酶与胰蛋白酶联合消化20 h时,表皮与基底层的连接开始松散,部分表皮能从基底层分离。
在22~24 h时,采用4种不同的消化分离方法均可见表皮与基底层较为完整地分离。此时表皮较薄,呈半透明状,能依靠水的张力平铺在DPBS上,且有一定的韧性。
胰蛋白酶消化法消化超过24 h以及中性蛋白酶、联合消化法消化超过30 h后,表皮能完整分离。但此时表皮无法平铺于DPBS上,质柔软,并失去韧性,见表1。

表1 4种不同消化方式分离成年小鼠背部皮肤的消化时间对比Table 1 Comparison of digestive time for back skin isolated from adult mice by 4 different digestive methods
1.2 4种不同消化方式获得成年小鼠背部表皮角质形成细胞的数量对比 利用4种不同分离方式分离2 cm×2 cm的皮肤组织,过滤获得角质形成细胞悬液,1 000 r/min离心5 min,可以观察到用中性蛋白酶与胰蛋白酶二步消化法所得到的细胞量最大,见图1A。
1.3 4种不同消化方式获得成年小鼠背部表皮角质形成细胞增殖能力的对比 CCK-8法检测4种分离方法所获得的原代角质形成细胞的活力。原代种板24 h时,二步消化法获得的细胞活力最高,联合消化法最低。随着培养时间的延长,这一趋势维持不变。在原代种板60 h时,二步法获得的细胞活力仍然保持在最高,接下来是中性蛋白酶消化法与胰酶消化法,联合消化法最低。由此可见二步法所得细胞的活力最强,联合消化所得细胞的活力最弱,见图2A。
EdU法验证细胞集落内4种不同消化方式所得细胞的增殖能力。二步法与中性蛋白酶消化法所得细胞增殖效率最高,其次是胰蛋白酶消化法和联合消化法。二步消化法与联合消化法之间细胞增殖能力的差异存在统计学显著性(P<0.05),见图2B。

Figure 1.The changes of keratinocyte numbers obtained from adult mouse back skin by 4 different methods.A:the amount of cells obtained after centrifugation(scale bar=5 mm);B:cell identification by immunofluorescence staining(scale bar=100 μm).图1 4种不同的消化方式影响成年小鼠背部皮肤角质形成细胞的获得数量
1.4 4种不同消化方式获得成年小鼠背部表皮角质形成细胞集落形成的对比 培养3 d后,统计4种不同分离方式所培养的角质形成细胞所形成的集落数量以及大小。二步消化法以及胰酶消化法所形成的集落量最多,联合消化法所获得的集落量最低(P<0.05)。然而,胰酶消化法所获得的较大集落(直径大于1 mm)量却显著减少,中性蛋白酶消化法所获得的较大集落量仅次于二步消化法。联合消化法所获得的集落量与另外3种方法的差异存在统计学显著性(P<0.05)。在统计集落面积时,我们得到了与上述一致的结果,二步法获得的集落面积最大,联合消化法所获得的集落面积最小(P<0.05),见图3。
2 不同培养条件对成鼠背部皮肤角质形成细胞原代分离培养的影响
2.1 不同种板条件对成鼠背部皮肤角质形成细胞原代分离培养的影响 为了探讨不同种板条件对成鼠背部皮肤角质形成细胞原代分离培养的影响,本研究利用某种分离方法后,分离角质形成细胞,分别采用普通平铺种板和水滴状种板2种形式进行种板,其中,利用水滴状种板方法种板并在0.5 h后补液,细胞贴壁36 h后结晶紫染色观察,水滴状种板细胞比传统平铺种板细胞贴壁更快,集落形成更多(P<0.05),见图4。
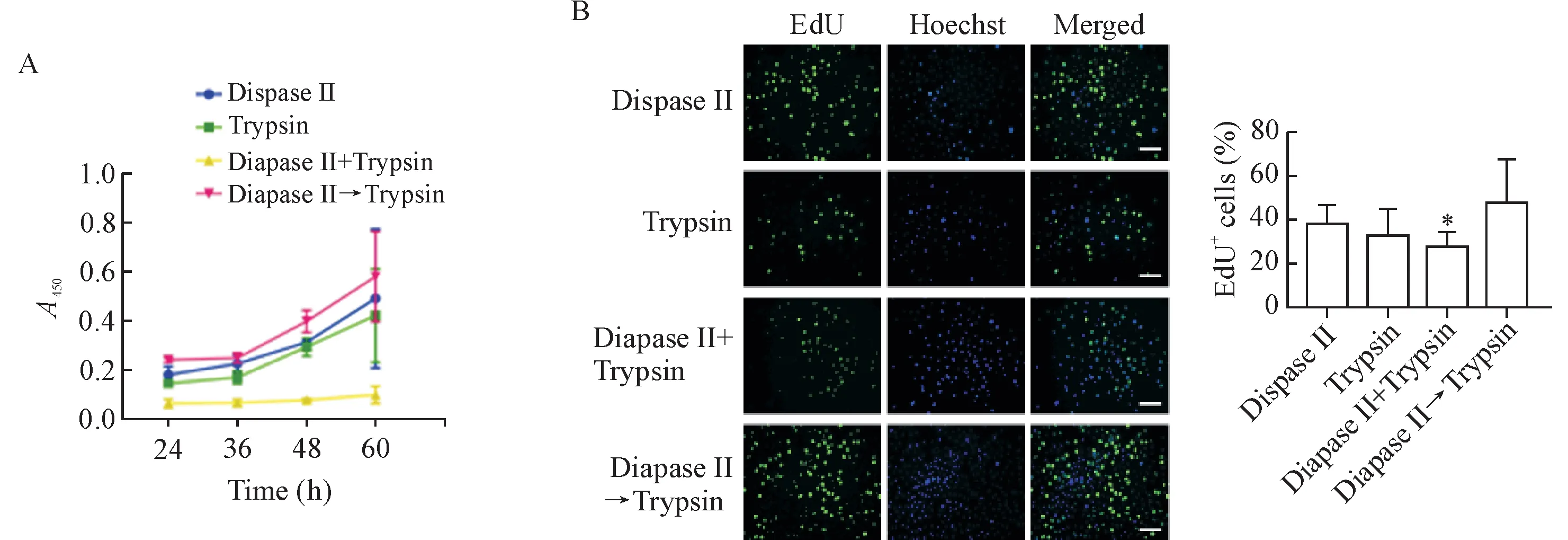
Figure 2.Four different methods affected the proliferation of keratinocytes from adult mouse back skin.A:the changes of the cell viability measurede by CCK-8 assay;B:the changes of cell proliferation detected by EdU assay.The scale bar=100 μm.Mean±SD.n=5.*P<0.05 vs Dispase II→Trypsin group.图2 4种不同的消化方式影响成年小鼠背部皮肤角质形成细胞的增殖能力
2.2 乳鼠与成年小鼠最适宜种板密度的对比 乳鼠与成年小鼠以不同种板密度种板,乳鼠以3.2×104/cm2密度种板增殖效率较高。而以6.4×104/cm2密度种板时,CCK-8实验结果显示此时的细胞活力低于以3.2×104/cm2密度种板的细胞活力。
而成年小鼠以1.6×104/cm2密度种板时细胞活力较高。以3.2×104/cm2密度种板时,CCK-8实验结果显示此时的细胞活力低于以1.6×104/cm2密度种板的细胞活力。而以6.4×104/cm2密度种板时,细胞不贴壁,且细胞活力下降,见图5。
3 乳鼠与成年小鼠角质形成细胞生物学功能的对比
3.1 乳鼠与成鼠角质形成细胞的细胞形态对比 在原代种板24 h后,可见乳鼠角质形成细胞特征性鹅卵石样细胞以及集落形成,且细胞集落融合度已较高,但有较多杂细胞,主要为黑素细胞,以及少量皮肤组织。随着细胞培养天数增加,杂细胞数量逐渐减少。在第3~4天时乳鼠角质形成细胞细胞融合度即可达90%以上。培养初期凋亡细胞较少,细胞融合度较高时才开始有凋亡细胞脱落。
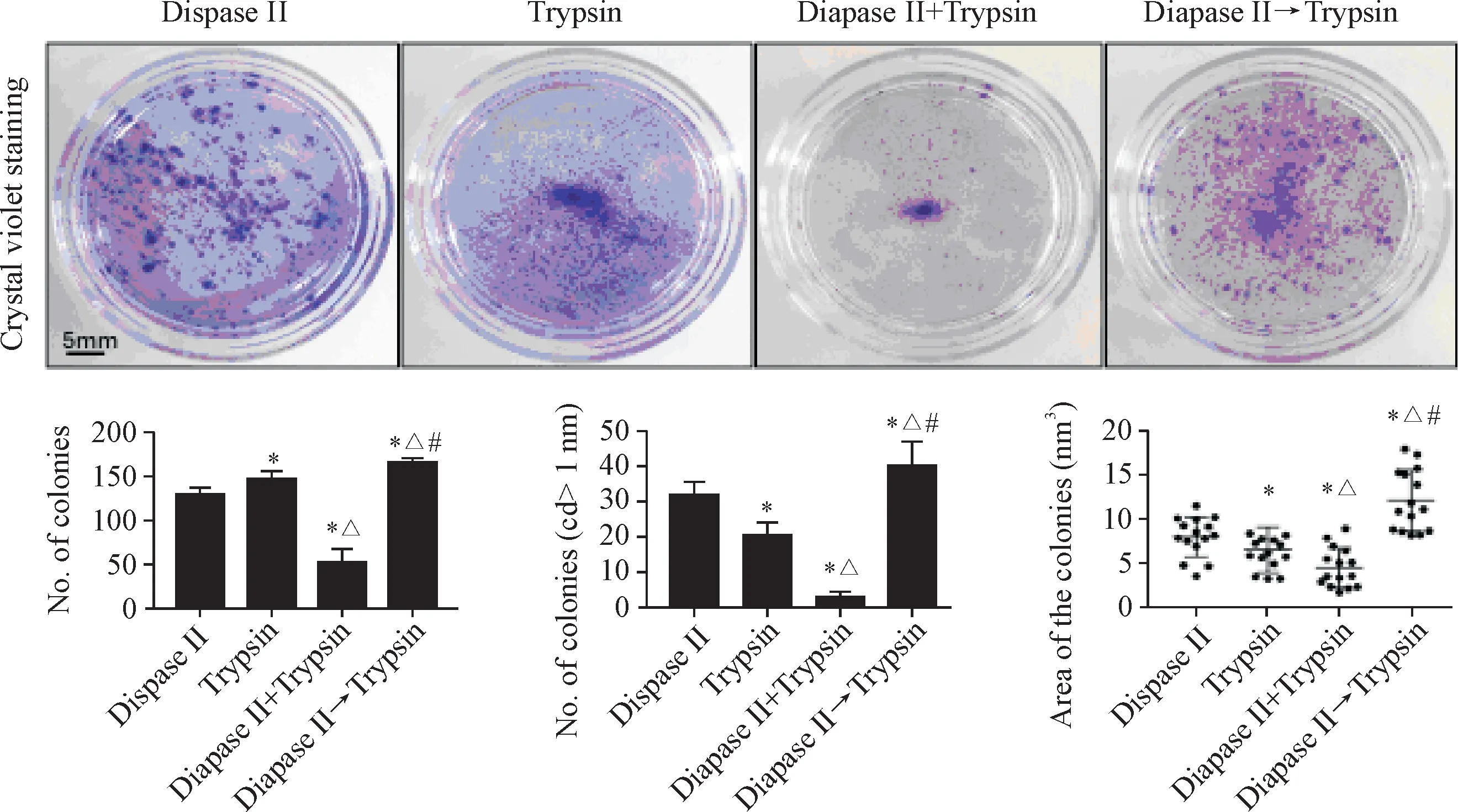
Figure 3.Four different methods affected the colony formation ability of the keratinocytes from adult mouse back skin.Statistical bar charts represent the number of colonies(n=5),the number of larger colonies(n=5),and the area of the colonies(n=15),respectively.Mean±SD.*P<0.05 vs Dispase II group;△P<0.05 vs Trypsin group;#P<0.05 vs Dispase II+Trypsin group.图3 4种不同分离方式影响成年小鼠背部皮肤原代角质形成细胞的克隆集落形成
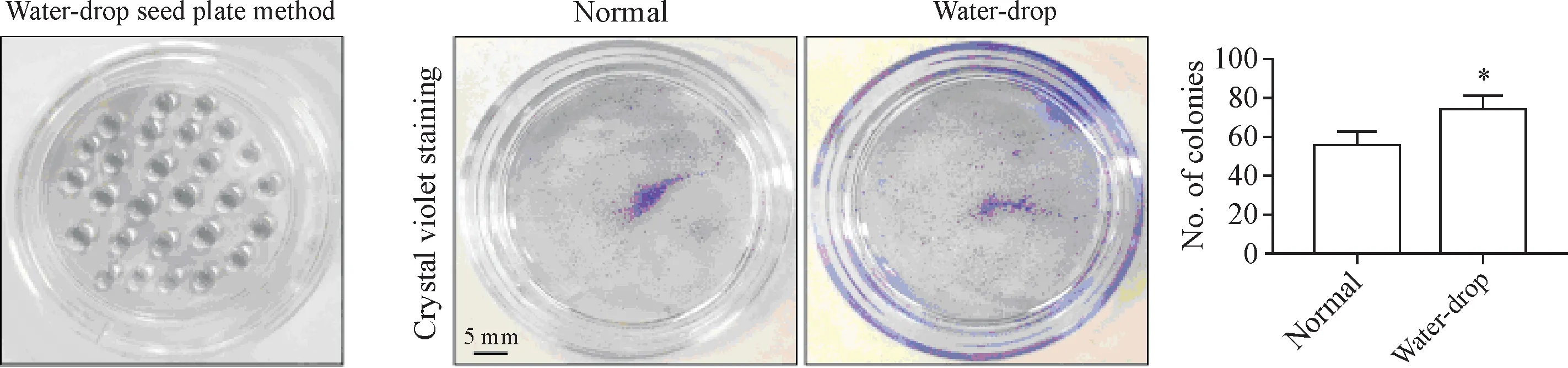
Figure 4.Two different plate patterns affected the colony formation ability of the keratinocytes from adult mouse back skin.Mean±SD.n=5.*P<0.05 vs normal group.图4 2种不同种板方式影响成年小鼠背部皮肤原代角质形成细胞的克隆集落形成
在原代种板24 h后,成年小鼠角质形成细胞中杂细胞较多,可见大量未贴壁,圆形较小的角质形成细胞,但同时可见角质形成细胞特征性鹅卵石样集落。集落较少,且集落较小。培养初期便有相较于乳鼠明显多的凋亡细胞。随着原代培养时间延长,杂细胞数量逐渐减少,集落数量逐渐增多,集落面积增大,同时集落之间开始互相融合。细胞融合度达60%时便有大量凋亡细胞脱落。在原代培养第7~10天时,集落融合度较高,镜下几乎无杂细胞,集落内细胞连接紧密,可见部分分化的角质形成细胞,镜下呈扁平、椭圆状,核较大,较未分化角质形成细胞圆,面积较大,见图6。
3.2 角质形成细胞的鉴定 K14是基底层角质形成细胞的阳性标记物。镜下可见培养细胞K14免疫荧光染色显示为阳性,证实培养细胞为基底层角质形成细胞,见图1B。
3.3 乳鼠与成年小鼠角质形成细胞的增殖能力的对比 CCK-8实验结果显示,在原代种板12 h内,乳鼠与成鼠角质形成细胞活力的差异没有统计学显著性,而24 h后,乳鼠与成鼠原代角质形成细胞细胞活力的差异逐渐增大,这一趋势一直维持到原代种板60 h(P<0.05),见图7A。
EdU重复实验验证了在培养第4天时,乳鼠角质形成细胞集落内的EdU阳性细胞率大于成年小鼠(P<0.05),见图7B。
3.4 乳鼠与成年小鼠角质形成细胞集落形成效率的对比 培养3 d后,乳鼠角质形成细胞已有大量集落形成,集落量、较大集落量、以及集落面积都大于成年小鼠角质形成细胞细胞集落,且差异有统计学意义(P<0.05),见图8。
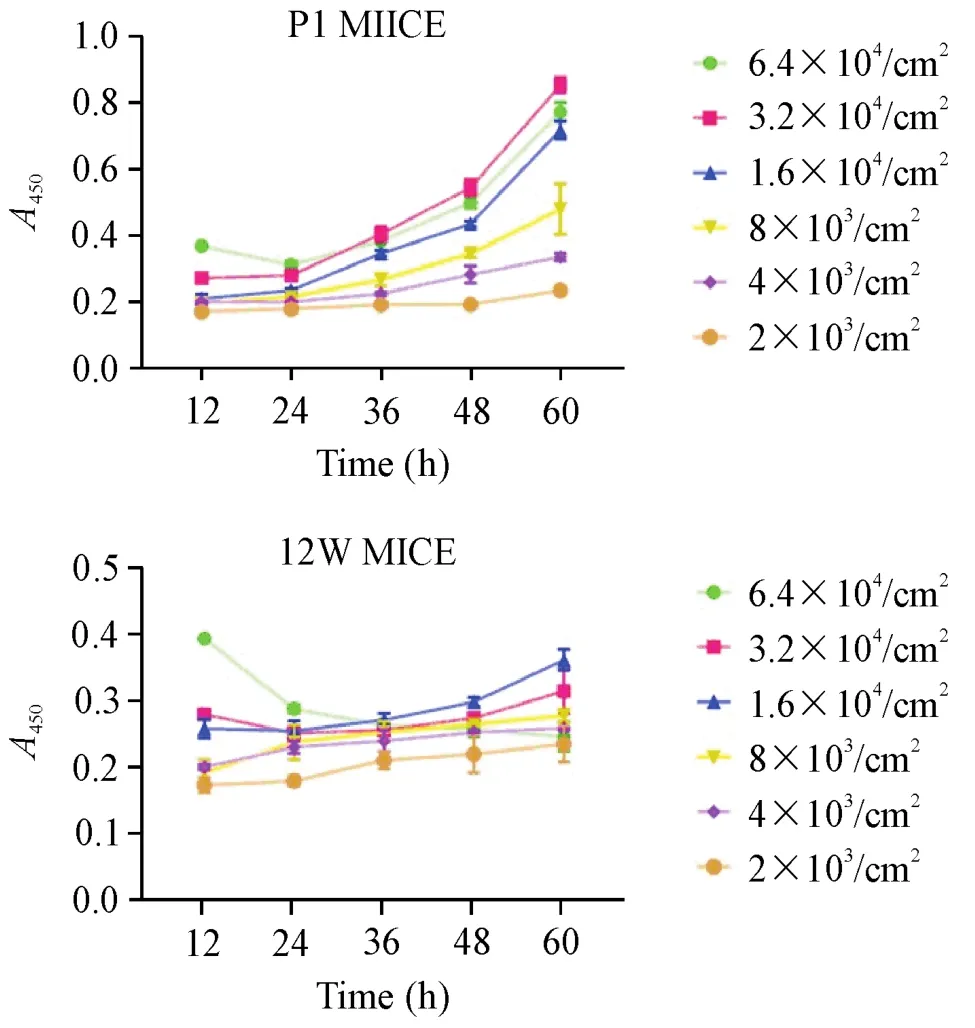
Figure 5.The cell viability of keratinocytes from neonatal mice and adult mice after planting with different densities.Statistical line charts represent the results of CCK-8 assay in different time periods.Mean±SD.n=5.图5 乳鼠与成年小鼠的角质形成细胞以不同密度进行原代种板后活力的变化
3.5 乳鼠与成年小鼠角质形成细胞细胞凋亡的对比 TUNEL实验检测乳鼠与成年小鼠角质形成细胞集落内凋亡细胞率,结果显示差异无统计学显著性。暂未发现乳鼠与成年小鼠角质形成细胞在细胞凋亡方面存在差异(P>0.05),见图9。
讨 论
1 消化条件对表皮-真皮分离和角质形成细胞原代分离培养的影响
在本研究组培养成年小鼠背部皮肤角质形成细胞之前,目前尚未存在良好的成年小鼠背部皮肤真表皮分离方法。有研究尝试利用手术刀对成年小鼠背部皮肤刮擦,从而分离表皮以进行角质形成细胞的培养[7],但存在获得的细胞量较少、无法获得完整的基底层细胞、容易使细胞破裂失去贴壁与增殖能力,以及混入大量杂细胞等缺点。
我们通过不同消化方式(中性蛋白酶消化法、胰蛋白酶消化法、二步消化法、联合消化法)以及时间的摸索,发现用4种不同的消化方法,4℃消化22 h左右能够成功分离成年小鼠背部表皮与真皮,是最适宜的成年小鼠背部表皮与真皮的分离条件。同时,利用4种不同分离方式分离表皮与真皮后,通过分离表皮组织获得角质形成细胞,并对其功能状态进行对比研究发现二步消化法获得的细胞在增殖、集落形成等方面最优,其次为中性蛋白酶消化法与胰蛋白酶消化法,最后是联合消化法。
皮肤组织长期置于胰酶之中会降低基底层角质形成细胞的增殖能力,目前这一现象在大部分人源性角质形成细胞的原代培养中也有发现[8]。中性蛋白酶通过消化分离基底层胶原,使表皮与真皮完整分离。同时短时间的胰酶消化有助于单个细胞的分离。因此,二步法能获得较多且活性较好的细胞。
2 不同培养方式对角质形成细胞培养的影响
水滴状种板方法能让细胞更快速沉降、贴壁,同时在一定程度上避免细胞的聚边效应,实现均匀种板,使细胞集落均匀分布于培养皿内,随着培养时间增加,集落内细胞逐渐增殖,集落面积逐渐增大、融合。

Figure 6.The morphological comparison of keratinocytes from neonatal mice and adult mice.The scale bar=100 μm.图6 乳鼠与成年小鼠原代培养角质形成细胞的细胞形态对比
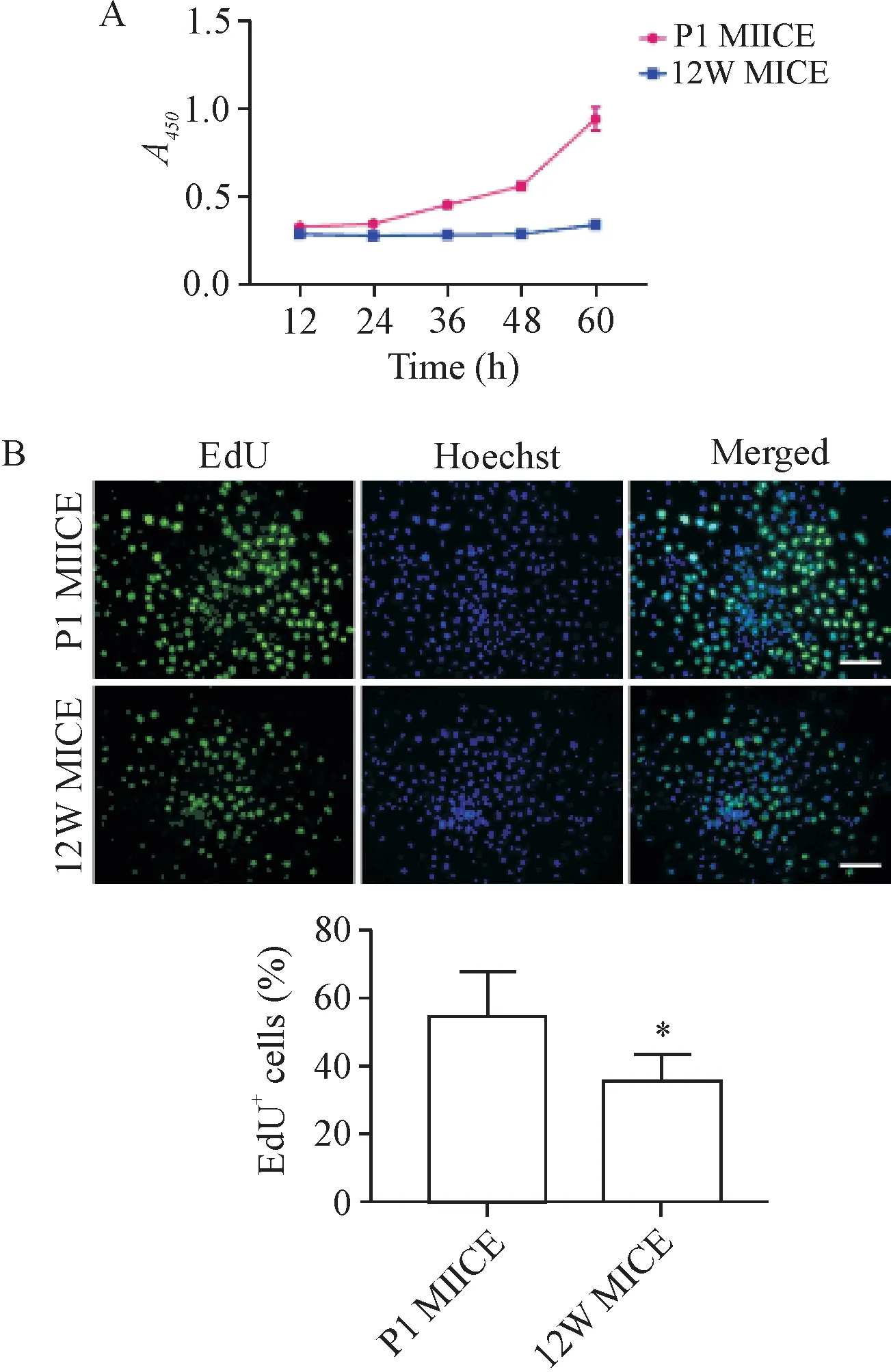
Figure 7.Comparison of proliferation of keratinocytes between neonatal mice and adult mice.A:the changes of cell viability measured by CCK-8 assay;B:the changes of cell proliferation detected by EdU assay.The scale bar=100 μm.Mean±SD.n=5.*P<0.05 vs P1 MICE group.图7 乳鼠与成年小鼠原代角质形成细胞增殖情况的对比
角质形成细胞原代培养的细胞状态还可能与Ca2+浓度、添加剂(如生长因子)、湿度、温度、CO2浓度、生长基质、维生素、营养物质等有关。其中,Ca2+浓度是调节角质形成细胞状态的主要影响因素之一[9]。Ca2+浓度过低,培养的角质形成细胞无法有效贴壁、增殖。Ca2+浓度过高,角质形成细胞迅速分化,失去原有增殖分裂能力[10]。在Ca2+浓度为0.03 mmol/L的无血清培养基中,角质形成细胞能保持较高的增殖能力并表现出基底细胞的形态。而在Ca2+浓度高于0.1 mmol/L时,便会开启细胞的终末分化模式[11]。因此,目前进行正常角质形成细胞培养基的Ca2+浓度通常维持在0.1 mmol/L以下[12]。在皮肤组织层面,表皮Ca2+浓度梯度、Ca2+通道能调节角质形成细胞的分化程度,改变皮肤表皮的pH值、屏障功能,并进一步调控皮肤衰老[13-14]。
3 不同种板密度对乳鼠与成年小鼠角质形成细胞细胞增殖差异的探讨
人正常细胞,包括人角质形成细胞在培养的过程中,随着培养时间增加,细胞量增多,集落面积增大,集落融合,会观察到接触抑制的现象[15-16]。
Watt等[17]在人源性表皮基底层角质形成细胞中发现,基底层角质形成细胞的细胞增殖、分化等功能与细胞形状存在紧密的联系。在细胞失去与周围细胞或者基质的连接时,细胞便会停止增殖,并开启终末分化。除了癌细胞,在人类大部分正常细胞中,都存在着接触抑制的现象。这种现象有助于抑制肿瘤的形成,维持细胞数量的稳态。角质形成细胞之间通过钙黏蛋白连接,钙黏蛋白通过收缩在一定程度上调控角质形成细胞的增殖[18]。
我们发现不仅在细胞培养过程中细胞增殖能力随着细胞密度增大逐渐减弱,而且在角质形成细胞最初原代种板时,若种板密度过大都会直接导致细胞无法贴壁以及无法增殖。不仅无法形成鹅卵石状集落,也无法形成单个椭圆形贴壁细胞。而细胞种板量较少时,单个细胞虽然能贴壁与增殖,但贴壁与增殖率较正常密度种板细胞显著降低。因此,寻找一个适宜的中间种板密度范围成为我们目前所关注的焦点。同时,我们发现乳鼠与成年小鼠的角质形成细胞都存在高密度种板-增殖抑制(甚至不增殖)与低密度种板-增殖抑制的现象。但实验结果显示乳鼠与成年小鼠对于种板密度的敏感性也存在着差异。乳鼠角质形成细胞在种板密度为3.2×104/cm2到6.4×104/cm2时,细胞增殖抑制;而成年小鼠则在一个更低的种板密度时表现出增殖抑制现象。这可能是因为随着角质形成细胞的衰老,胞膜表面钙黏蛋白表达下调,钙黏蛋白与肌动蛋白稳态失衡造成的。具体机制有待我们下一步的探讨。
4 成年小鼠和乳鼠角质形成细胞的对比
皮肤组织的衰老分为光老化与自然衰老。光老化过程中,真皮与表皮的厚度与结构发生变化,真皮的胶原组织、脂肪层与血管基质结构与数量改变[19]。角质形成细胞在UVB的照射下变圆、皱缩、肿胀、细胞凋亡。并且这种变化与UVB的辐射剂量呈正相关[20]。而在个体自然衰老的过程中,表皮细胞连接减弱,基底层细胞增殖、分化减弱。而衰老的角质形成细胞的贴壁能力、增殖能力与克隆团形成效率都较年轻的角质形成细胞明显减弱。因此,在分离不同年龄小鼠角质形成细胞时,应注意皮肤组织与细胞不同的处理方式。成年小鼠的皮肤较乳鼠厚,而表皮较乳鼠薄。若获得细胞量较少,可在组织剪细后,振荡组织悬液或适当延长细胞悬液离心时间。注意在振荡组织悬液时,不可一次振荡过久或震荡太过,否则细胞贴壁能力以及细胞活性下降,造成细胞无法贴壁或无法增殖。
基底层角质形成细胞主要有平行增殖与向上分化两种命运。当基底层细胞离开基底层时,它会停止增殖并开始向上分化为棘层、颗粒层、透明层以及角质层[21]。
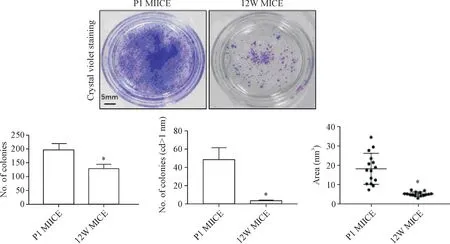
Figure 8.Comparison of colony formation efficiency between neonatal mouse keratinocytes and adult mouse keratinocytes.Statistical bar charts represent the number of colonies(n=5),the number of larger colonies(n=5),and the area of the colonies(n=15),respectively.Mean±SD.*P<0.05 vs P1 MICE group.图8 乳鼠与成年小鼠原代角质形成细胞克隆集落形成对比
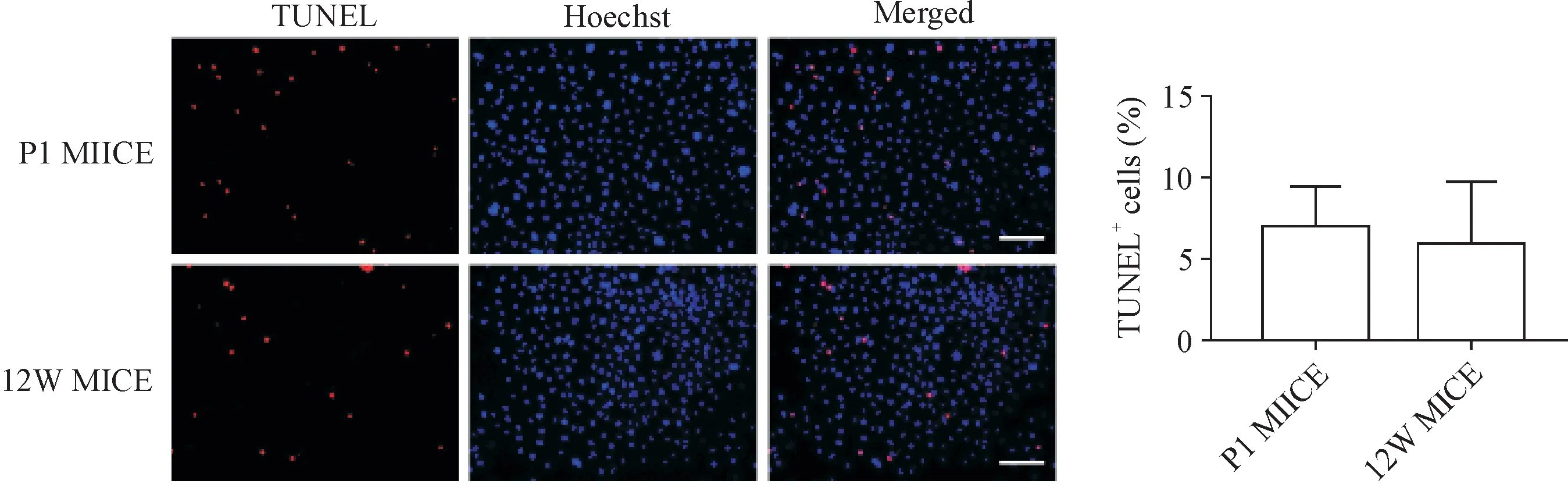
Figure 9.Comparison of apoptosis in the keratinocytes between neonatal mice and adult mice.Statistical bar charts represent the rates of TUNEL positive cells in a single colony.The scale bar=100 μm.Mean±SD.n=5.图9 乳鼠与成年小鼠原代角质形成细胞凋亡情况对比
成年小鼠皮肤厚度远厚于乳鼠,主要因为成年小鼠有较厚的富含脂肪、毛细血管的皮下结缔组织。然而,乳鼠的表皮较成年小鼠厚。出生1 d的乳鼠表皮层数已基本完整。在我们的实验中,我们发现,乳鼠与成年小鼠角质形成细胞在细胞黏附、集落形成、增殖等方面都存在显著差异。在肉眼观察时,成年小鼠角质形成细胞细胞总体凋亡量较乳鼠角质形成细胞多。但在进行TUNEL实验并进行定量分析后,结果显示成年小鼠角质形成细胞集落内细胞凋亡率与乳鼠角质形成细胞的凋亡率差异无统计学显著性。
目前,小鼠角质形成细胞的培养还受到许多的局限,原代培养易受到黑色素细胞、成纤维细胞等杂细胞的污染。同时,角质形成细胞的生长受到表皮生长因子、成纤维细胞生长因子、神经生长因子和胰岛素样生长因子家族以及肝细胞生长因子的影响,此外粒细胞-巨噬细胞集落刺激因子和内皮素-1通过转化生长因子β、维生素D3和干扰素γ来抑制它们的生长。它们能够调节表皮角质形成细胞的增殖、分化,并且调节皮肤的炎症与免疫反应[22]。同时,目前角质形成细胞传代后增殖效率显著下降,且传代次数有限,都是相关领域所面对的重大难题。
为了增加角质形成细胞的增殖与贴壁效率,许多科研工作者们在原代或传代种板前根据实验需求进行铺板。目前常用方式有3T3细胞、成纤维细胞等作为滋养层,或利用胶原蛋白I、基质胶、纤维连接蛋白、玻璃粘连蛋白等进行预铺板[23]。随着基础研究的不断发展,小鼠角质形成细胞的原代培养与传代培养体系在不断地完善。在未来,角质形成细胞培养体系的成熟不仅能够给皮肤相关科研提供有力模型,也将给临床治疗带来帮助,发挥重大作用。

