PRSS35在鸡卵泡膜细胞中的表达与卵泡液雌激素含量的关系
孟金柱,陆雨芳,赵成刚,张羽强,赵园园
(1.铜仁学院,贵州铜仁 554300;2.贵州梵净山同心生态养殖有限公司,贵州铜仁 554300)
蛋鸡的卵泡发育具有明显的等级优先性,根据直径大小及其功能,把卵泡划分为等级卵泡和等级前卵泡两大类[1]。等级卵泡,也称为排卵前卵泡,从大到小排列为F1、F2、F3、F4、F5…,直径最大能达到40mm[2]。等级前卵泡按照直径分为:1~2mm的小白卵泡(SWF)、3~5mm的大白卵泡(LWF)、6~8mm的小黄卵泡(SYF)和9~12mm的大黄卵泡(LYF)[3]。研究发现,直径为6~8mm的小黄卵泡是卵泡在选择过程中能否优先进入等级的转择点,只有进入小黄卵泡库的卵泡才有可能被选择发育成为排卵前卵泡。然而,只有5% 的大白卵泡可以发育成为小黄卵泡[4]。
在蛋鸡卵泡发育过程中,由下丘脑分泌的促性腺激素释放激素(GnRH)通过促进垂体分泌促卵泡素(FSH)和促黄体素(LH)刺激卵巢分泌雌激素和孕激素,来调控卵母细胞的增殖,进而导致排卵[5]。卵泡中的颗粒细胞和包围在颗粒细胞外层的卵泡内膜细胞都参与了激素的合成及分泌,其中颗粒细胞负责合成分泌孕激素(P4),而卵泡内膜细胞是合成及分泌雄激素和雌激素(E2)的主要部位[6]。在等级前卵泡中,E2对促进颗粒细胞增殖及卵泡发育成熟具有重要的作用[7];当卵泡接近成熟时,卵泡内膜细胞中的芳构化酶活性会降低, E2的分泌会逐渐减弱,相反,颗粒细胞分泌的P4会增加[8]。
丝氨酸蛋白酶(PRSS)是蛋白酶家族中的重要成员,Miyakoshi 等[9]发现,PRSS35在小鼠卵巢颗粒细胞、黄体以及早期妊娠子宫内表达,推测 PRSS35在雌性生殖过程中发挥重要作用,特别是在卵母细胞发育、排卵、着床和蜕膜化等过程[10]。进一步研究表明,PRSS35mRNA 只在发育卵泡的膜层、排卵前和排卵卵泡的颗粒细胞,以及正在形成及消退的黄体中有表达[11-12],可能与卵母细胞的受精潜力有关。且PRSS35的表达具有高度特异性,推测PRSS35可能参与小鼠卵泡发育及排卵过程并促进卵泡发育、诱导排卵[13-14]。而关于PRSS35在禽类卵泡中的功能研究及作用机制鲜见报道。因此,本研究通过免疫组织化学技术对PRSS35在蛋鸡卵泡中的表达进行定位,利用实时荧光定量PCR(RT-PCR)和Western blot技术对PRSS35mRNA和蛋白在卵泡内膜细胞中的相对表达情况进行分析,同时采用ELISA技术对卵泡液中的E2进行测定,旨在探明PRSS35在蛋鸡卵泡中的表达位置及其在不同大小卵泡中的表达与E2分泌的关系,为进一步研究PRSS35在卵泡发育中的功能及作用机制奠定基础。
1 材料与方法
1.1 试验动物及样品采集
在贵州梵净山同心生态养殖有限公司(贵州铜仁)选取5只150 日龄健康的土母鸡宰杀后,分别剪下卵巢上的小白卵泡、大白卵泡、小黄卵泡和大黄卵泡,抽取卵泡液用于E2含量的测定,刮取卵泡内膜细胞用于总RNA和总蛋白提取。选取部分大白卵泡和小黄卵泡,放入体积分数为4% 的多聚甲醛溶液中固定24 h,用于PRSS35在大白卵泡和小黄卵泡组织中的表达定位。
1.2 试验方法
1.2.1 PRSS35的组织定位 参照于雪静[15]免疫组织化学研究的方法,将大白卵泡和小黄卵泡的石蜡切片经脱蜡、阻断、抗原修复、封闭后,分别滴加兔抗PRSS35一抗(1∶100稀释),以滴加正常兔血清作对照,4 ℃过夜孵育,然后复温,二抗孵育(鼠抗兔IGg),DAB显色,苏木精复染,脱水,透明,封片;最后置于显微镜(Leica,德国)下采集照片并分析。
1.2.2 总RNA提取及RT-PCR分析 使用Trizol法分别提取小白卵泡、大白卵泡、小黄卵泡和大白卵泡膜细胞的总RNA,通过反转录试剂盒(北京全式金)反转录为cDNA,反应条件为: 42 ℃孵育15 min,85 ℃加热5 s。使用GAPDH作为内参基因,通过NCBI在线设计引物(表1)并交由上海生工生物有限公司合成。
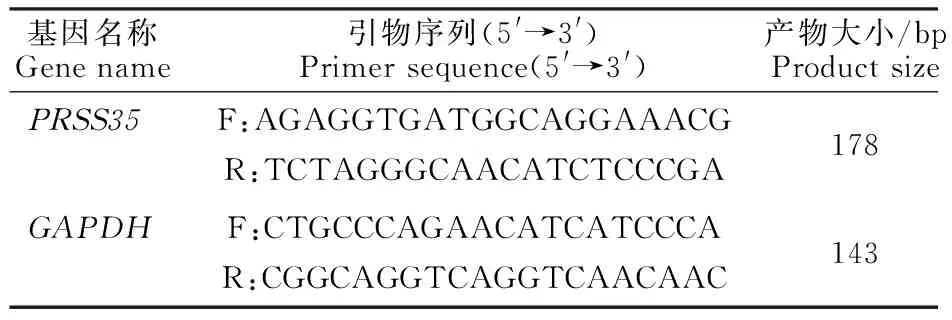
表1 供试引物序列Table 1 Tested primer sequence
RT-PCR按照北京全式金产品Transstart○RTip Green qPCR SuperMix使用说明书推荐的 20 μL反应体系进行,采用LightCycler 480平台设置条件:94 ℃预变性1 min;94 ℃ 10 s,60 ℃ 30 s,72 ℃ 10 s,45个循环。结果使用2-△△CT法计算PRSS35的相对表达量。
1.2.3 总蛋白提取及Western blot分析 使用上海碧云天生物技术有限公司的RIPA裂解液(强)分别提取小白卵泡、大白卵泡、小黄卵泡和大白卵泡膜细胞的总蛋白,参照毕锡麟[16]的方法进行Western blot,所用一抗为兔抗PRSS35 (1∶1 000稀释),以GAPDH为对照,4 ℃孵育14 h,TBST清洗3次,每次10 min;HRP-山羊抗兔为二抗(1∶2 000稀释),TBET清洗3次,每次10 min;最后置于凝胶成像系统拍照并分析。
1.2.4 卵泡液中E2的含量测定 使用E2ELISA试剂盒(上海蓝基)分别测定小白卵泡、大白卵泡、小黄卵泡、大黄卵泡卵泡液中E2的含量。采用5个样本重复,每个样本进行3个技术重复,分别向酶标板上的空白孔中依次加入 50 μL 0 ng/mL、0.25 ng/mL、0.5 ng/mL、 1 ng/mL、2.5 ng/mL和5 ng/mL的标准品,其余孔中依次加入待测样品,按照试剂盒使用说明书将反应液配置好以后,置于酶标仪中读取OD(Optical density)值,根据标准品的质量浓度所对应的OD值建立标准曲线,将所获得的OD值转换为质量浓度值。
2 结果与分析
2.1 PRSS35蛋白在蛋鸡卵泡内的表达
通过免疫组织化学技术对PRSS35在蛋鸡卵泡中的表达进行定位,显微镜下观察发现(图1),阴性对照组未发现有特异性着色,试验组卵泡颗粒细胞层、膜细胞层和卵丘细胞均呈现棕黄色。表明PRSS35蛋白在蛋鸡卵泡的颗粒细胞层、膜细胞层和卵丘细胞中均有表达。
2.2 PRSS35 mRNA在蛋鸡不同大小卵泡膜细胞中的表达差异
采用QRT-PCR检测PRSS35 mRNA在蛋鸡不同大小卵泡膜细胞中的表达情况,结果表明(图2),PRSS35 mRNA在小黄卵泡膜细胞中的含量显著高于其他卵泡(P<0.05),而小白卵泡、大白卵泡和大黄卵泡膜细胞之间PRSS35 mRNA的含量差异不显著(P>0.05)。
2.3 PRSS35蛋白在蛋鸡不同大小卵泡膜细胞中的表达差异
采用QRT-PCR检测PRSS35 蛋白在蛋鸡不同大小卵泡膜细胞中的表达情况,结果表明(图3),PRSS35蛋白在小黄卵泡膜细胞中的含量显著高于其他卵泡(P<0.05),而小白卵泡、大白卵泡和大黄卵泡膜细胞之间差异不显著(P> 0.05)。
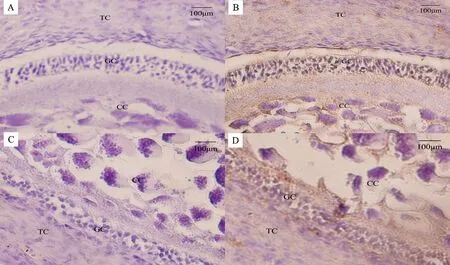
A.大白卵泡阴性对照; B.大白卵泡试验组;C.小黄卵泡阴性对照;D.小黄卵泡试验组;GC.颗粒细胞层;TC.膜细胞层;CC.卵丘 细胞
A.Negative control of large wihte follicles; B.Experiment group of large wihte follicles; C.Negative control of small yellow follicles; D.Experiment group of small yellow follicles; GC.Granulosa cells layer; TC.Theca cells layer; CC.Cumulus cells
图1 PRSS35在蛋鸡卵泡中的表达(×200)
Fig.1 Expression of PRSS35 in chicken ovary follicles (×200)
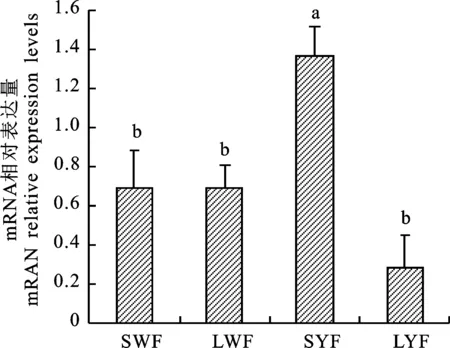
小写字母表示差异显著(P<0.05)。下同
Lowercase letters indicate significant difference (P<0.05).The same below
图2 不同大小卵泡颗粒细胞内
PRSS35 mRNA的相对表达水平
Fig.2 Relative expression of PRSS35 mRNA
in follicle theca cells at different sizes
2.4 蛋鸡不同大小卵泡卵泡液中E2的含量
E2测定结果表明(图 4),E2在小黄卵泡卵泡液中的含量显著地高于其他卵泡(P<0.05),小白卵泡和大白卵泡显著高于大黄卵泡(P< 0.05)。
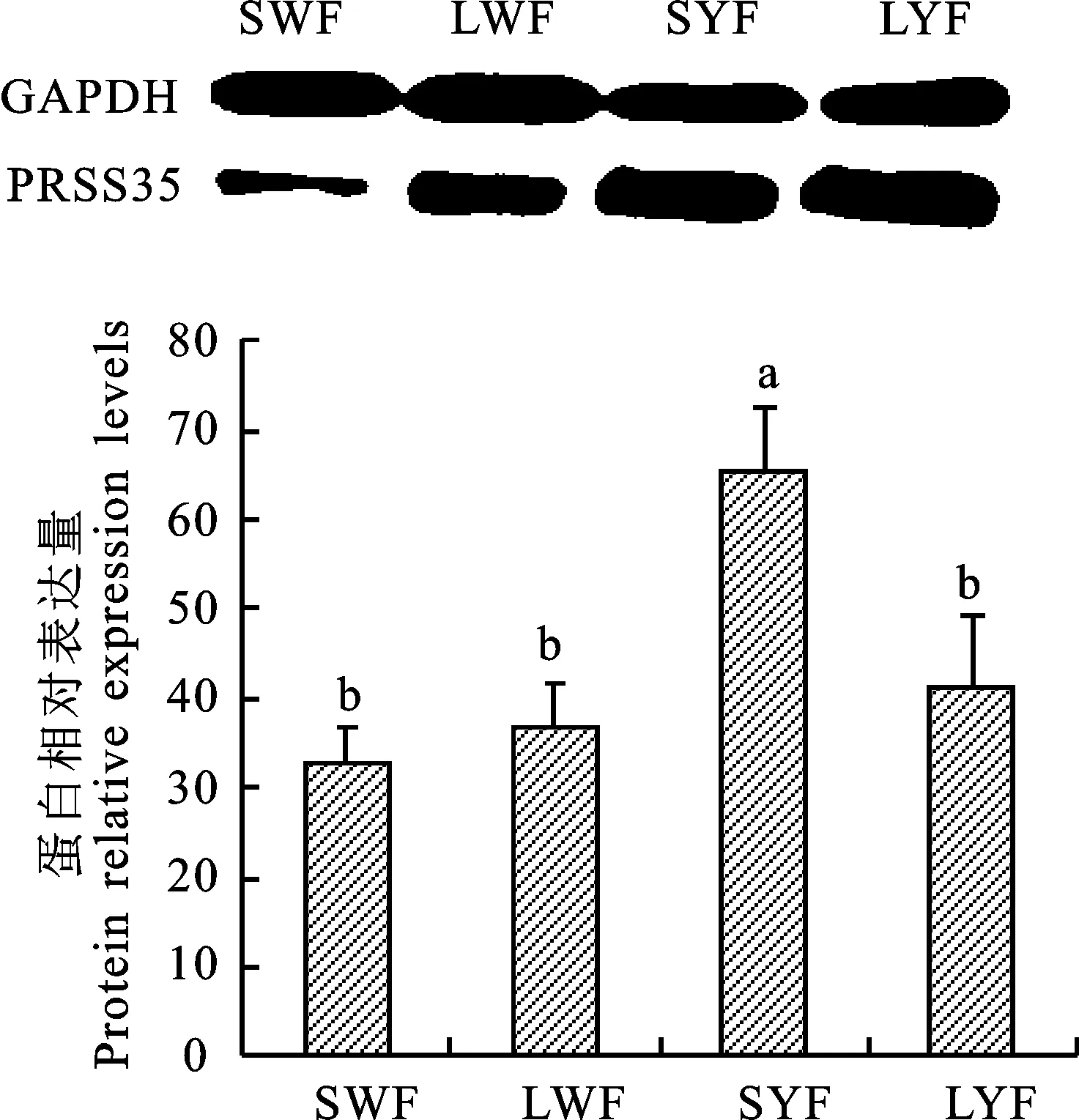
图3 不同大小卵泡膜细胞内PRSS35蛋白的相对表达水平Fig.3 Relative expression of PRSS35 in follicle theca cells at different sizes

图4 不同大小卵泡卵泡液中E2的含量Fig.4 E2 concentrations in follicle fluids at different sizes
3 讨 论
蛋鸡的卵泡在多种激素和生长因子的共同调控下,促进颗粒细胞和内膜细胞的增殖和分化及子宫内膜细胞和卵母细胞的成熟[17]。在这个过程中,只有大约1% 的卵泡能够排卵,直径为6~8 mm的小黄卵泡是卵泡在选择过程中优先进入等级还是走向闭锁的转择点:此阶段大部分卵泡会走向闭锁,另一小部分卵泡则发育成为大黄卵泡[4],只有进入小黄卵泡库的卵泡才有可能被选择发育成为排卵前卵泡[18]。等级前卵泡的发育会直接影响卵泡的选择、成熟及排卵,进而影响产蛋规律[19]。本研究中QRT-PCR和Western blot试验结果均显示,PRSS35 mRNA和蛋白在小黄卵泡中的含量显著高于其他卵泡(P<0.05),表明PRSS35可能是蛋鸡等级前卵泡发育过程中的重要调控因子,可能参与卵泡的选择。
在动物体内,丝氨酸蛋白酶(Serine protease)作为一种重要蛋白水解酶类,通过丝氨酸蛋白酶抑制剂(Serine protease inhibitor)来调节细胞分化、组织重建、血管形成、胚胎发育和病原侵入等过程[20]。研究发现,PRSS35在小鼠卵泡颗粒细胞、黄体妊娠早期的子宫中有表达,推测其可能在小鼠卵泡发育过程中发挥重要作用[21]。Sheng等[22]研究表明,PRSS35只在卵巢组织中有表达,证明其可能与卵母细胞的活力相关,从而影响其受精能力。此外,Patrik 等[14]认为,PRSS35在小鼠发育的卵泡膜细胞层表达,且在排卵卵泡颗粒细胞中表达较高;同时,在形成和退化的黄体中也有表达,推测PRSS35可能参与排卵以及黄体的形成和退化过程,关于PRSS35在家禽中的研究鲜见报道。本试验通过对等级前大白卵泡和小黄卵泡2种卵泡进行免疫组织化学研究的结果显示,PRSS35在蛋鸡大白卵泡和小黄卵泡2种卵泡的颗粒细胞层、膜细胞层和卵丘细胞中均有 表达。
在哺乳动物卵泡中,雌激素的合成和分泌是受多种激素和细胞因子共同调节的[23]。促黄体素(LH)通过与卵泡膜细胞上的LH受体结合后,会激活cAMP-蛋白激酶,将胆固醇转化为雄激素,雄激素再被转运到颗粒细胞,在促卵泡素(FSH)与多种生长因子的共同介导下,使颗粒细胞进一步分化,从而具备合成芳构化酶的能力,最终把雄激素转化为雌激素,而膜细胞则负责为颗粒细胞合成E2提供前体物质(雄激素)[24]。与哺乳动物不同,在禽类卵泡中相对简单, 颗粒细胞中的胆固醇裂解酶将胆固醇裂解为孕激素后被转运到膜细胞内,LH与卵泡膜细胞上的受体结合以后,使ATP转化为cAMP,进而激活芳香化酶将孕激素转化为E2[25],而合成的E2又可以反馈到颗粒细胞中,从而抑制颗粒细胞合成P4,进一步调节卵泡的发育、成熟及排卵[26]。卵泡液中E2的含量会直接影响卵泡的选择、排卵或闭锁。本研究通过ELISA法对不同大小等级前卵泡卵泡液中的E2含量进行测定,表明E2在小黄卵泡卵泡液中的含量显著高于其他卵泡卵泡液(P<0.05),且E2含量在小白卵泡和大白卵泡卵泡液中显著高于大黄卵泡(P<0.05)。推测PRSS35在小黄卵泡中可能会促进膜细胞合成分泌E2,从而参与卵泡的选择。
4 结 论
本研究发现PRSS35在蛋鸡卵泡的颗粒细胞层、膜细胞层和卵丘细胞均有表达;PRSS35 mRNA和蛋白在小黄卵泡中的含量显著高于其他卵泡(P<0.05),E2在小黄卵泡卵泡液中的含量显著高于其他卵泡卵泡液(P<0.01),在小白卵泡和大白卵泡卵泡液中显著高于大黄卵泡(P< 0.05),推测PRSS35在小黄卵泡中可能会促进卵泡内膜细胞分泌E2,从而影响卵泡的选择。

