常压室温等离子体与5-溴尿嘧啶复合诱变及快速选育腺苷高产菌株
杨心萍,宋词,张伟豪,刘艳,2,王洲,2,薛正莲,2*
1(安徽工程大学 生物与化学工程学院,安徽 芜湖,241000) 2(微生物发酵安徽省工程技术研究中心,安徽 芜湖,241000)
腺苷是一种遍布人体细胞的重要内源性核苷酸,可直接进入心肌经磷酸化生成腺苷酸,参与心肌能量代谢[1-2]。因其在心血管系统中有很重要的生化代谢和调节功能而被人们熟知[3]。微生物发酵法生产腺苷具有生产成本低、反应条件温和、原材料广泛等优点。目前腺苷菌株主要通过诱变选育方式得到,高效的诱变技术及筛选方法无疑可大大提高获得高产菌株的效率。
由清华大学自主研发的新型常压室温等离子体(atmospheric room temperature plasma, ARTP)微生物快速突变技术具有安全性高、操作简单、突变率高等优势[4-7]。ARTP可以快速地突变细菌、真菌等多种微生物,是可以快速高效地获得高产菌株的新型诱变剂[8-10]。大量的研究表明,ARTP诱变与其他诱变相结合的方式可以提高突变率[9,11-13]。本文选用化学诱变剂5-BU,其作用机理是作为碱基类似物,与正常碱基结构相似,在DNA复制过程中,取代正常碱基渗入DNA分子[14]。目前关于ARTP与5-BU结合的诱变方式还鲜有报道。
孔板发酵实现快速选育在发酵行业中有很多成功的应用[15-17]。与传统的摇瓶发酵方式相比,孔板具有发酵体积小、筛选效率高等优势。边缘孔现象在酶联免疫反应中较为常见,表现为边缘孔显色较中间孔颜色更深[18-19]。在孔板培养好氧微生物的过程中出现的边缘孔效应,还未见报道。本研究使用48孔板对枯草芽孢杆菌进行发酵,对孔板均一性进行考察,以提高菌株筛选的准确性。
本研究运用ARTP与5-BU相结合的方式,对48孔板均一性进行考察,使用SG抗性平板以及48孔板发酵的方式,筛选得到遗传稳定的腺苷突变菌株。以期该复合诱变方法能选育腺苷高产菌株,也为其他产核苷类物质菌株的选育提供了参考。
1 材料与方法
1.1 菌株
枯草芽孢杆菌(B-0),本实验室保藏。
1.2 仪器及试剂
UV-5500PC紫外可见分光光度计,上海元析仪器有限公司;ARTP-IIS ARTP育种机,北京思清源生物科技有限公司。化学药品均为国产分析纯。
1.3 培养基
固体培养基(g/L):葡萄糖10,蛋白胨10,酵母膏10,牛肉膏10,尿素5,NaCl 2.5,琼脂20,115 ℃灭菌30 min,pH 7。
种子培养基(g/L):葡萄糖10,蛋白胨10,酵母膏10,牛肉膏3,尿素5,KCl 2,泡敌0.3,115 ℃灭菌30 min,pH 7。
发酵培养基(g/L):葡萄糖106.25,玉米浆30,多糖茸精6,KH2PO41,MgSO4·7H2O 2.5,尿素3,KCl 2,(NH4)2SO43,MnSO4·H2O 0.05,柠檬酸4.5,味精4,泡敌0.3,115 ℃灭菌30 min,pH 7。
抗性培养基:在固体培养基上添加0.8~1.2 g/L SG制成抗性培养基,SG过滤除菌。
1.4 腺苷含量的测定
取适量发酵液于2 mL离心管中,煮沸5 min,8 000 r/min离心5 min后,使用浓度为 0.1 mol/L HCl溶液,采用10倍梯度稀释法,稀释至适当的浓度,于260 nm处测定吸光度。
1.5 发酵培养条件
孔板发酵中,使用已灭菌的镊子夹取已灭菌的牙签挑取单菌落,接入发酵液中;摇瓶发酵中,采用体积分数8%的种子液接入发酵液中。培养条件均为37 ℃,240 r/min,培养3 d。
1.6 抗性浓度的选择
选取0、0.1、0.2、0.3、0.4、0.5、0.6、0.7和0.8 g/L的SG分别制备平板,每个质量浓度制备3个平板。取稀释后的100 μL对数期菌液涂布于各个平板上,37 ℃培养3 d后观察生长情况。
1.7 ARTP诱变处理
取1 mL对数期的菌悬液,离心去上清后使用生理盐水垂悬,稀释至106~108CFU/mL,完成菌悬液的制备。将小铁片灼烧后放至室温,均匀平铺10 μL菌悬液。在ARTP机器放电功率为120 W,照射距离2 mm,气流量为10 SLM的条件下,对小铁片上的菌悬液分别进行0、15、30、45、60、75和90 s的诱变处理,诱变结束后充分振荡洗脱,适当稀释后,分别涂布于普通平板和抗性平板,每组3个平行,培养2~3 d后观察生长情况。
1.8 5-BU诱变处理
取1 mL对数期的菌悬液,离心去上清后使用生理盐水垂悬,37 ℃振荡饥饿培养8 h,使其尽量消耗自身的营养物质。称取0.02 g 5-BU,加入10 mL去离子水,50 ℃低温热溶[20]。将5-BU 加入完全固体培养基内,使其最终质量浓度为10、20、30、40、50和60 μg/mL。将饥饿培养8 h的菌悬液适当稀释后,分别涂布于含有0.88 g/L SG和不含有SG的5-BU平板上,使其在生长的过程中被诱变,每组3个平行,培养2~3 d后观察生长情况。
1.9 ARTP与5-BU复合诱变处理
将5-BU溶液与SG溶液分别加入固体培养基中,加入后的最终质量浓度分别为20 μg/mL与0.88 g/L。将ARTP诱变处理60 s后的菌悬液,适当稀释后,涂布于普通平板和含有5-BU及SG的平板,培养2~3 d后观察生长情况。
1.10 致死率、正突变率计算
经过1.6、1.7、1.8节中的方法处理后,根据菌株在不同平板上的生长情况,按照公式(1)、(2)分别计算不同处理时间下枯草芽孢杆菌的致死率与正突变率。

(1)

(2)
式中:U,未经处理的对照组平板上生长的菌落数;S,各处理剂量下平板上生长的菌落数;P,在含有0.88 g/L SG的抗性平板上生长的菌落数。
1.11 突变菌株遗传稳定性检测
将筛选得到的突变菌株连续传代培养10代,分别检测每代菌株发酵液中腺苷产量,以确定突变菌株的遗传稳定性。
1.12 数据处理
采用Origin 2018绘图,IBM SPSS Statistics 25 数据分析。
2 结果与分析
2.1 孔板均一性考察
2.1.1 48孔板边缘孔效应验证
在应用48孔板进行诱变菌株复筛时,发现高产菌株集中于48孔板边缘位置。将此类“高产菌株”进行摇瓶发酵后,发现产量并未有明显提升。这意味着孔板发酵过程中可能存在边缘效应。如图1所示,选择24孔板中3个位置,即1号长边缘孔、2号短边缘孔,3号中间孔。选择同一株菌进行发酵后,比较孔板中3个位置的腺苷含量,进行3组平行实验,结果如表1所示。

图1 48孔板位置示意图Fig.1 48-well plate location diagram
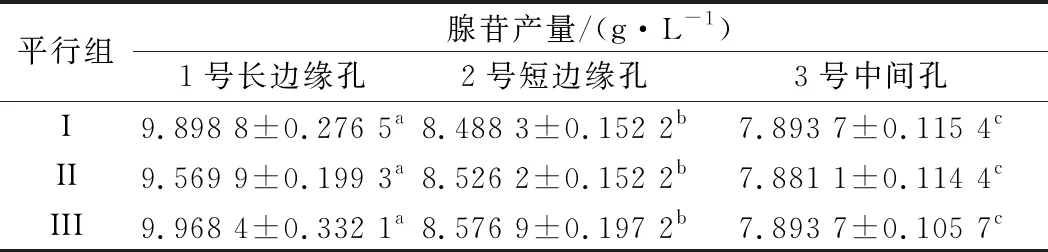
表1 48孔板不同位置腺苷产量Table 1 48-well plate adenosine yield at different positions
注:同行数据后不同小写字母代表不同类型孔间存在显著性差异(P<0.05)
3个位置孔中腺苷产量表现出明显差异。对比发酵72 h不同孔间发酵液剩余量,发现边缘孔剩余发酵液体积明显低于中间孔体积。说明边缘效应的出现可能与孔间水分蒸发不均有关。
2.1.2 孔板边缘效应的消除
实验结果表明采取空置边缘孔及使用封口膜紧密缠绕孔板盖与孔板的接口处,这2种方法均不能消除孔板边缘效应,而将孔板边缘孔位置填充2 mL的无菌水或发酵液,可有效消除边缘孔效应。选择同一株菌进行48孔板发酵后,对其产量进行分析,结果如表2所示,t值为0.003,小于显著性水平α=0.05条件下的临界值,故中间24孔孔间差异不显著,可以排除在复筛过程中孔板间的系统误差。

表2 48孔板孔间差的t-Test结果Table 2 t-Test result of difference between wellsin a 48-well plate
2.2 不同接种方式对腺苷产量的影响
采用单菌落接种发酵液的方式,可以减少种子培养过程,缩短筛选周期。将同一株菌,采用平板与种子液2种方式活化,将活化后的菌种接入发酵培养基,发酵结束后分别测定产量。如表3所示,t值为0.518,小于显著性水平α=0.05条件下的临界值,表明采用平板菌落及种子液2种接种方式差异不显著。故在48孔板发酵中,采用单菌落直接接种以提高筛选效率。

表3 单菌落与种子液2种接种方式的t-Test结果Table 3 t-Test results of single colony and seed liquidinoculation methods
2.3 48孔板发酵与摇瓶发酵腺苷产量之间的相关性
随机选择诱变过程中得到的30株突变株,分别采用250 mL挡板摇瓶与48孔板发酵的方式,将得到的腺苷产量进行线性拟合后,y=1.014 9x-3.704 8,R2=0.921 3(图2),表示2种发酵方式下的腺苷产量具有良好的线性关系,可以使用48孔板代替摇瓶发酵,提高筛选效率。

图2 48孔板与250 mL摇瓶发酵腺苷产量的相关性Fig.2 Correlation between 48-well plate and 250 mL baffled shake flask fermentation yield
2.4 SG抗性浓度的选择
SG作为腺苷的结构类似物,初筛过程中可以筛选掉大部分负突变菌株,提高筛选效率。按照1.6中的方法对SG临界浓度进行确定,结果如图3所示。当SG质量浓度为0.7 g/L时,平板菌株呈现微弱生长,当质量浓度为0.8 g/L时,平板上未见生长菌落。因此,0.8 g/L SG为菌株的临界耐受浓度。将抗性浓度提升10%作为诱变初筛浓度,即SG抗性质量浓度为0.88 g/L。

a~i,SG质量浓度分别为0、0.1、0.2、0.3、0.4、0.5、0.6、0.7和0.8 g/L图3 不同SG质量浓度平板筛选突变株Fig.3 Screening mutants with different SG concentrations
2.5 ARTP诱变最佳剂量确定
按照1.7中的方法进行诱变处理后,如图4所示,ARTP对枯草芽孢杆菌有较强的致死能力,当照射60 s时,致死率达到88.24%,正突变率为36.36%,因此,后续复合诱变处理时间选定60 s。

图4 ARTP诱变时间与枯草芽孢杆菌的致死率和正突变率的关系Fig.4 Relationship between ARTP mutagenesis time and lethal and positive mutation rates
2.6 5-BU诱变最佳剂量确定
5-BU作为碱基诱变剂[14,21],均匀混入培养基中,使菌株在生长的过程发生突变。按照1.8中的方法进行诱变处理后,当质量浓度为20 μg/mL,致死率与正突变率达到最高,分别为88.24%与18.18%,故20 μg/mL为最佳诱变剂量。

图5 5-BU诱变浓度与枯草芽孢杆菌的致死率和正突变率的关系Fig.5 Relationship between 5-BU mutagenesis time and lethal and positive mutation rates
2.7 ARTP与5-BU复合诱变
如图6所示,5-BU与ARTP单独诱变时,诱变正突变率分别为18.18%和36.36%,复合诱变后,正突变率提升至50%。使用1.9中的方法进行复合诱变,对菌株进行6轮诱变处理后,结果如图7所示,在第6轮诱变中,筛选到1株高产菌株,产量为11.99 g/L,较出发菌株提升34.67%。SG抗性浓度达1.1 g/L,较初始SG浓度提升37.5%。将得到的腺苷高产菌株命名为B-6。

图6 三种诱变方式的正突变率比较Fig.6 Comparison of positive mutation rates among three mutagenesis methods

图7 六轮ARTP诱变复筛结果Fig.7 Results of 6 rounds of ARTP mutagenesis rescreening
2.8 高产菌株的遗传稳定性考察
对突变株B-6进行遗传稳定性实验,结果如图8所示,经过10代连续划线培养并发酵,对发酵液中腺苷产量进行测定,腺苷含量为11.85 g/L左右。结果表明突变株B-6具有较好的稳定性,能高效生产腺苷。

图8 突变株B-6产腺苷的遗传稳定性Fig.8 Genetic stability of adenosine-producing mutant B-6
3 结果与讨论
建立高效、准确的选育方法是菌株诱变选育的关键。廖丹等[22]在荧光素酶报告基因实验中,发现使用48孔板时存在边缘孔效应,且用磷酸盐缓冲液填充可以削弱边缘效应。本研究通过对48孔板边缘孔效应的考察,发现用48孔板培养枯草芽孢杆菌B-0时也存在边缘孔效应,通过2 mL无菌水填充可以有效地消除边缘孔效应。
ARTP诱变作为一种新型高效的诱变剂[4],与5-BU结合表现出良好的诱变效果。本研究中,采用ARTP与5-BU复合诱变的方式,并结合SG的抗性筛选,正突变率可达到50%,经过6轮诱变后,最终得到1株腺苷高产菌株B-6,48孔板中产量为11.94 g/L,较出发菌株B-0(产量为7.8 g/L)提升34.67%,经10代传代培养后,腺苷产量稳定,可以用于后续的进一步研究。

