基于线粒体功能紊乱药物干预抑郁症的研究进展
罗 杰,纪雅菲,方 洋,曾九僧,刘 蓉,曾 南
(成都中医药大学药学院,四川 成都 611137)
抑郁症是一种常见的情感性障碍精神疾病,以显著而持久的情绪低落或兴趣丧失为主要症状,其诱因复杂。抑郁症的致残率和致死率较高,并可危及生命[1],逐渐成为发病率>15%的主要精神疾病之一[2]。目前,关于抑郁症的发病机制有单胺递质假说[3-4]、下丘脑-垂体-肾上腺轴功能失调假说[5-6]和炎症(免疫)反应假说[7-8]等,且抗抑郁药物的研发及抑郁症治疗的基础研究大多基于上述假说。抑郁症的发病机制是涉及多系统多环节的复杂过程,近年来大量研究发现,抑郁症的发病与脑区的线粒体功能紊乱有关,并提出抑郁症发病的线粒体病变相关假说[9],同时也发现很多抗抑郁药可通过干预线粒体功能紊乱来发挥作用。本文针对线粒体功能紊乱与抑郁症发病机制的关联,对药物的干预影响和临床治疗应用等内容进行综述。
1 线粒体功能紊乱与抑郁症发病机制的关系
线粒体通过氧化磷酸化产生众多ATP,为机体提供活动所必需的能量。线粒体的内膜含电子传递链(electron transport chain,ETC),ETC包含5种蛋白质复合物(Ⅰ,Ⅱ,Ⅲ,Ⅳ和Ⅴ),其中3种(Ⅰ,Ⅲ和Ⅳ)可通过内膜泵出质子,产生在复合物Ⅴ(ATP合酶)上合成ATP所需的质子梯度,直接参与ATP的合成,线粒体基因编码13个ETC相关蛋白[10]。除产生能量外,线粒体同时广泛参与活性氧(reactive oxygen species,ROS)代谢、钙信号介导的细胞凋亡以及神经可塑性等生理过程调控[11]。研究表明,精神病、情感障碍和焦虑等疾病的发生均可能与线粒体功能紊乱有关[12]。线粒体功能紊乱包括ATP合成减少、呼吸链功能障碍、结构异常和细胞凋亡的过度发生[13]。
1.1 线粒体氧化应激
电子转移过程中,O2-由线粒体呼吸链复合物Ⅰ和Ⅲ产生,经超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx-Px)和细胞质中的过氧化氢酶(catalase,CAT)作用转化为水[14],以降低机体氧化水平。
抑郁症的发生与压力应激事件相关,压力事件使机体长期处于慢性应激状态,应激导致机体(脑组织是主要靶点)氧化还原平衡状态紊乱,产生氧化应激状态,表现为体内ROS水平升高。氧化应激已被证实广泛参与精神疾病的发生,高水平活性氮(reactive nitrogen species,RNS)或ROS通过强烈的氧化活性损害酪氨酸残基酶功能,导致单胺类神经递质和其他胺类化合物生成减少[15],同时能通过炎症和凋亡等生理途径参与抑郁症的发生发展[16]。ROS具有作为核苷酸结合寡聚化结构域样受体家族pyrin结构域蛋白3(nucleotide binding oligomerization domain-like receptor family pyrin protein 3,NLRP3)炎症小体的上游激活信使而参与激活免疫和炎症过程的作用[17-18]。炎症诱发抑郁症假说在相关神经药理学研究中得到证实,如Meta分析显示,抑郁症患者外周血白细胞介素6(interleukin-6,IL-6)和IL-1β等炎症因子水平均高于健康人群,抑郁症患者尸检发现其脑内小胶质细胞活性得到增强,脑实质中的IL-6和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)水平升高[19-21]。总之,氧化应激-炎症-抑郁症三者之间存在密不可分的联系。
线粒体是ROS的主要产生部位之一[22],高水平的ROS是线粒体氧化应激的标志之一。线粒体解偶联蛋白2(mitochondrial uncoupling protein 2,UCP2)通过增加星形胶质细胞ROS的水平激活NLRP3炎症小体,使IL-1β释放增加而加重慢性温和刺激诱导的小鼠抑郁样行为[23],使用ROS的清除剂能逆转UCP2敲除带来的负面效应。在嗅球摘除抑郁模型小鼠海马部位观察到短期线粒体膜电位损伤,随后持续长达8周的ROS水平升高、谷胱甘肽(glutathione,GSH)水平降低以及海马中IL-1,IL-6和TNF-α表达升高,提示该抑郁模型中存在长期的氧化应激损伤和炎症反应[24]。临床研究显示,重度抑郁症(major depression,MD)患者的血浆丙二醛(malondialdehyde,MDA)和8-羟基脱氧鸟苷[25]水平及血红细胞对氧化的敏感性显著高于健康人群,SOD活性与抑郁程度呈正相关[26],即抑郁症患者表现出明显的氧化损伤。
1.2 线粒体能量发生障碍
应激与压力介导了大脑神经元的可塑性和超微结构发生改变,为适应环境避免上述改变,则需要更多的能量代谢支撑,线粒体则是重要的能量提供单位[27]。大脑仅存储少量糖原,神经元细胞中的能量来源几乎完全依赖于线粒体的氧化磷酸化,因此神经元细胞的生长、生存极易受到线粒体能量发生水平的影响[28]。研究显示,抑郁症患者的情绪低落、学习生活能力下降和容易疲劳等主要临床症状表现,均可能与线粒体ATP产生减少、细胞ATP利用度降低有关[29]。
影像学研究发现,抑郁症患者脑部能量代谢水平较低[30-31]。精神分裂症和抑郁症患者尸检发现,其脑部组织(额叶皮质、纹状体和黑质)线粒体密度和数量降低[32]。MD患者在常规或非耦合呼吸、备用呼吸能力、耦合效率和ATP周转相关的呼吸等体现线粒体呼吸能力的指标上显著低于正常对照者,且线粒体呼吸能力与注意力不集中、容易疲劳等抑郁症状的严重程度呈负相关[33]。对40例MD患者基因表达谱研究发现,MD患者外周血单核细胞线粒体生物发生相关的基因如过氧化物酶体增殖物活化受体γ辅助活化因子1α(peroxisome proliferatoractivated receptor γ coactivator 1α,PGC-1α)〔结合NRF1后调节线粒体转录因子A 1(mitochondrial transcription factor A 1,TFAM1),进一步调控线粒体转录,影响线粒体氧化能力〕、Tfam和核转录因子E2相关因子1(nuclear transcription-E2 related factor 1,Nrf1)表达下调,抗氧化酶基因表达上调,提示线粒体生物发生的假说和抗氧化基因参与了抑郁症的发病机制[34]。动物实验发现,腹腔注射皮质酮诱发的抑郁样小鼠,同位素标记法测定其脑部能量代谢发现其额叶皮质、颞叶和海马脑区的葡萄糖代谢能力显著低于正常小鼠,上述区域内的线粒体活性低于正常水平[35],给予抗抑郁药物治疗后能逆转以上情况。慢性不可预测轻度应激抑郁症模型动物皮质、小脑部位线粒体呼吸链复合物Ⅰ,Ⅲ和Ⅳ处于抑制状态[36],海马部位出现线粒体肿胀、SOD活性降低、线粒体融合蛋白mitofusin1和mitofusin2表达水平降低,线粒体能量发生出现障碍[37]。慢性温和应激模型小鼠海马、皮质和下丘脑部位的线粒体膜电位消失,线粒体的呼吸链电子传递与氧化磷酸化的耦合紧密度降低,ATP合成能力受损,线粒体出现肿胀、空泡或凝结等超微结构损伤[38]。
研究证实,抑郁症或抑郁模型中出现了线粒体能量发生障碍。此外,抑郁症伴随的炎症反应亦能影响线粒体的能量发生。促炎细胞因子TNF-α可通过激活线粒体酪氨酸激酶调控细胞色素c氧化酶亚基Ⅰ上的酪氨酸磷酸化,抑制线粒体的氧化磷酸化功能[39]。暴露于急性氯胺酮的小鼠出现IL-6表达升高,IL-6介导NADPH氧化酶的增加[40]。低浓度一氧化氮自由基可特异性地、可逆地抑制细胞色素c氧化酶,较高浓度一氧化氮自由基及其衍生物(过氧亚硝酸盐、二氧化氮或亚硝基硫醇)会导致不可逆的呼吸链电子传递抑制而影响线粒体的能量发生[41-42]。
1.3 线粒体DNA异常
线粒体基因组含有编码氧化磷酸化系统13个蛋白质、22个tRNA和2个rRNA的37个基因,线粒体DNA(mitochondrial DNA,mtDNA)作为母体遗传DNA对线粒体的功能发挥具有至关重要的作用[43]。线粒体基因的差异表达可直接导致线粒体功能紊乱,人线粒体RT2型PCR阵列板分析线粒体基因发现,MD患者的背侧前额叶皮质部位线粒体基因表达中有16个基因差异表达。SLC25A27,SLC25A12和STARD33个基因下调,其中SLC25A27和SLC25A12的产物UCP4能下调ROS的水平;SLC25A30,TIMM8B,SOD2,BCL2,UCP2,SLC25A23,MIPEP,TP53,SLC25A31,UCP1,CDKN2A,BBC3和SFN共13个基因上调,其中SLC25A23介导Ca2+流入,调节神经元中的ATP水平[44],SLC25A31编码腺嘌呤核苷酸转位酶,有助于向线粒体提供ADP并向细胞质中释放ATP[45]。以上差异表达的基因涉及线粒体功能障碍的多个方面,对于其基因改变的背后机制尚未得到解释,但或许可从以下证据获得部分信息。
Meta分析显示,MD患者前额叶皮质部位的mtDNA序列变异性高于健康观察者,且患者的mtDNA等位基因表现出明显的异质性,部分等位基因的异质性参与了典型与非典型抑郁症的症状划分[46]。抑郁症患者前额叶皮质中mtDNA水平和线粒体缺失表现亦显著不同于正常对照者[47]。以抑郁症患者和皮质酮引发的抑郁样模型小鼠为分析对象发现,抑郁症患者和小鼠海马中mtDNA的数量呈增加表现,且端粒DNA在抑郁症中表现出缩短状态。作者认为端粒DNA平均长度和mtDNA水平的变化一定程度上反映了在感知或预期压力时机体改变的代谢策略[48]。Polg1(Polg1基因突变参与了孟德尔遗传性线粒体疾病-慢性进行性眼外肌麻痹)的显性失活突变体的转基因小鼠能诱导抑郁样症状,Polg1突变小鼠的室丘脑旁核(paraventricular nucleus of thalamus,PVT)部位呈现高水平的Δ-mtDNA积累,且PVT线粒体中琥珀酸脱氢酶(succinate dehydrogenase,SDH,线粒体呼吸链复合物Ⅱ)和细胞色素c氧化酶的表达水平低于正常小鼠,表明Δ-mtDNA在PVT脑区细胞的积累引发细胞水平的线粒体功能障碍[49]。同时,mtDNA拷贝数的异常也被作为区分双向情感障碍和重度抑郁症的诊断学标志[50]。
1.4 线粒体缺陷
线粒体未折叠蛋白质响应(mitochondria unfolded protein response,UPR mt),是一种激活核编码线粒体伴侣蛋白热休克蛋白60(heat shock protein 60,Hsp60)和Hsp70稳态响应模式,以促进线粒体基质积聚的未折叠和错误折叠蛋白构象正常化,是线粒体缺陷导致的线粒体应激反应。慢性束缚应激诱导的抑郁样模型小鼠皮质中可检测到UPR mt相关分子Hspa9、Hspd1(线粒体伴侣蛋白)、Ubl5、Abcb10(ATP结合转运蛋白)和ClpP水平增加,且UPR mt相关分子表达水平与抑郁样行为学指标相关[51]。目前关于线粒体缺陷与抑郁症联系的报道相对较少,尚无直接证据证明UPR mt诱导抑郁症发生,且诱发线粒体缺陷的原因亦不明确,有待进一步深入研究。

图1 线粒体功能紊乱与抑郁症的关系.NLRP3:核苷酸结合寡聚化结构域样受体家族pyrin结构域蛋白3;NO-:一氧化氮负离子;OH-:羟基自由基;ROS:活性氧;IL-6:白细胞介素6.➝:促进;:抑制;:导致.
综上,线粒体功能紊乱直接或间接地影响抑郁症的发生(图1)。其中,线粒体损伤介导的ROS水平升高引起的机体氧化应激-炎症反应,线粒体三羧酸循环、呼吸链电子传递的抑制、mtDNA紊乱诱导的能量发生障碍及线粒体自身缺陷等被认为是线粒体功能紊乱诱导或加重抑郁症发生的主要作用机制。
2 传统抗抑郁药物对线粒体功能的调节作用
目前,临床使用的一线抗抑郁药物主要集中在选择性5-羟色胺再摄取抑制剂、选择性去甲肾上腺素再摄取抑制剂、单胺氧化酶抑制剂和三环类抗抑郁药等[52]。经典抗抑郁药物除影响单胺类递质及其相关的酶和受体外,尚有其他潜在的作用机制,包含干预线粒体的功能。神经递质的跨膜转运和酶活性的抑制均需要ATP提供能量,线粒体功能的稳定对现有抗抑郁药物的药效发挥存在一定影响。研究表明,传统抗抑郁药物似乎对线粒体功能的影响表现出双向性,部分抗抑郁药物对线粒体功能呈现保护作用,但部分研究者得出相反结果,提示药物的作用表现复杂。
体外实验发现,三环类抗抑郁药物丙咪嗪、5-羟色胺再摄取抑制剂地西帕明、阿米替林和西酞普兰及去甲肾上腺素再摄取抑制剂米氮平能抑制猪脑线粒体中的呼吸链复合物Ⅰ表达[53]。氟伏沙明(选择性5-羟色胺再摄取抑制剂)治疗14 d后,大鼠皮质、海马和小脑的柠檬酸合酶、苹果酸脱氢酶及复合物Ⅰ,Ⅱ-Ⅲ和Ⅳ的活性降低,作者认为该结果可能与药物不良反应有关[54]。此外,发现具有相似化学结构的药物对线粒体的影响表现出不同的作用,如沃替西汀(选择性5-羟色胺再摄取抑制剂)治疗1周后可显著增加突触线粒体数量,同时上调线粒体发生相关基因DRP1的表达,但同类药物氟西汀治疗7 d后无效果[55]。
基于产前应激致抑郁模型,丙咪嗪和氟西汀均表现出良好的抗抑郁作用,并发现氟西汀治疗能显著提高海马组织蛋白酶D(维持细胞稳态)、抑微管装配蛋白(stathmin-1,微管去稳定蛋白)和DJ-1(调节线粒体生物发生,氧化防御)蛋白的表达,丙咪嗪则对影响海马线粒体富集的次级蛋白质(冠蛋白1A、丝切蛋白1和COP9)表达有明显上调作用,同时增加线粒体呼吸链复合物Ⅲ的基因表达[56]。另一项研究显示,地昔帕明和氟西汀亚慢性治疗21 d,两者均升高正常大鼠海马非突触线粒体内细胞色素氧化酶和谷氨酸脱氢酶活性。其中,地昔帕明能增加突触重链线粒体中的苹果酸脱氢酶活性,降低总NADH-细胞色素c还原酶和细胞色素氧化酶活性。在非突触线粒体中,氟西汀还增加了琥珀酸脱氢酶活性,在突触内轻链线粒体中,氟西汀可诱导琥珀酸脱氢酶活性的降低[57]。基于社会孤立抑郁模型,氟西汀能上调模型大鼠海马部位线粒体转运、跨膜运输相关的依赖性阴离子通道蛋白1(voltagedependent anion channel protein 1,VDAC1)和VDAC2转运蛋白、磷酸盐和苹果酸载体蛋白的表达,提高能量发生中糖酵解相关的己糖激酶1蛋白表达,降低丙酮酸激酶的表达,逆转应激诱导三羧酸循环的柠檬酸合酶和苹果酸脱氢酶表达的降低,改善细胞的跨膜转运和线粒体能量代谢障碍[58]。非典型抗抑郁药物噻萘普汀能上调产前应激诱导的抑郁样模型大鼠海马SDH及NADH脱氢酶铁硫蛋白4的表达[59]。
综上,临床应用广泛的典型抗抑郁类药物在研究中显示其抗抑郁功效与影响线粒体功能相关,提示线粒体功能保护在抑郁症治疗、抗抑郁药物研发中具有潜在的研究价值。在近年来的新型抗抑郁药物研究和抗抑郁治疗研究中也初步证实了这一观点(见表1)。
3 基于改善线粒体功能的抑郁症治疗新策略
3.1 药物修复和改善线粒体功能
3.1.1 新型抗抑郁药物
一项针对线粒体功能是否影响抑郁症治疗作用的研究发现,与安慰剂组相比,线粒体辅助治疗药物(N-乙酰半胱氨酸、辅酶Q10等抗氧化剂复合物)辅助治疗后,虽未表现出明显的抗抑郁疗效,但能有效改善抗抑郁药物治疗的延迟效应以及戒断症状,证明改善线粒体的功能在抑郁症的治疗中不容忽视[60]。采用辅酶Q10对慢性束缚应激模型大鼠进行治疗,能剂量依赖性地恢复海马CAT、GPx和GSH水平,降低海马组织MDA、NO和8-羟基-2′-脱氧鸟苷水平,逆转抑郁样症状[61-62]。ω3不饱和脂肪酸、维生素C和锌等抗氧化剂也表现出相似的作用[63]。
使用G蛋白偶联雌激素受体的激动剂(G-1)治疗因雌激素诱导的抑郁模型大鼠,发现G-1能逆转模型大鼠海马部位UCP2,SOD和Bcl-2蛋白表达的降低,增加脑部线粒体膜电位,提示G-1可通过提高抗氧化能力、保护线粒体功能、降低神经元细胞凋亡发挥抗抑郁作用[64]。新型抗抑郁药物5-(4-羟基-3-甲氧基亚氨基)-2-硫代-4-噻唑烷酮对皮质酮诱导的抑郁样大鼠皮质、颞叶、海马区的葡萄糖能量代谢低下有显著改善作用,能增加线粒体向神经元的顺行运输,增加神经递质释放所需能量[35]。催产素对母体分离应激小鼠有良好的抗抑郁作用,能提高模型小鼠海马ATP和GSH水平,降低ROS表达,发挥线粒体保护功能,同时抑制炎症反应[65]。
快速抗抑郁药氯胺酮给药2 h即能显著升高小鼠ATP水平,增加氧化磷酸化相关复合物Ⅰ的活性,同时降低ROS的水平,减轻氧化应激对蛋白的损伤,这可能是氯胺酮发挥快速抗抑郁作用的机制之一[66]。降血脂药阿托伐他汀也被证实可通过保护线粒体膜电位,下调NO和ROS水平,降低氧化应激损伤,改善谷氨酸诱发的神经兴奋性毒性,发挥抗抑郁作用[67]。
3.1.2 中药成分
西洛他唑(雷公藤红素)能预防慢性束缚应激诱导的抑郁模型大鼠海马线粒体复合物Ⅰ-Ⅳ活性降低,改善线粒体功能障碍,同时激活Nrf2抗氧化信号通路发挥抗抑郁作用[68]。白藜芦醇对脂多糖刺激诱导的小鼠抑郁样行为有对抗作用,该作用与逆转小鼠海马线粒体氧化应激和ATP产生降低有关[69]。罗马洋甘菊精油(主要成分α-蒎烯)能减弱Wistar Kyoto大鼠的抑郁样行为表现,与其上调海马和皮质中涉及氧化磷酸化的蛋白(细胞色素c氧化酶亚基6C2、7A2和ATP合酶亚基e)表达,保护线粒体功能有关[70]。柚皮苷和舍曲林联合治疗能对抗多柔比星诱导的抑郁样行为,柚皮苷及柚皮苷+舍曲林均能显著保护线粒体复合物Ⅰ-Ⅲ活性,减轻氧化应激,且联合应用表现出更佳疗效[71]。黄芩苷[72]、没食子酸[73]、中药配方(人参、当归、远志、酸枣仁等组成)[74]等中药活性成分或中药复方提取物对不同抑郁模型动物表现出抗抑郁作用,并具有良好抗氧化作用,其抗氧化作用与改善线粒体功能相关。
3.2 非药物治疗
除药物能通过直接改善线粒体功能缓解抑郁症状外,其他一些非药物治疗方式(激光照射、运动训练、外源性线粒体移植)亦能间接干预线粒体功能,有望成为抗抑郁治疗的新策略。研究发现,对空间限制性小鼠和Abelson辅助整合位点1敲除诱导的抑郁样小鼠,采用低水平激光治疗后,小鼠前额叶皮质中ATP生物合成和线粒体复合物Ⅳ表达水平显著升高,抑郁样症状得到缓解[75]。近红外光的磷磁性共振能激活细胞色素c氧化酶[76]表达。产前暴露于糖皮质激素诱导的大鼠抑郁样行为,可以通过早期的平板运动干预获得预防、治疗效果,抑郁行为的改善受海马线粒体功能改善的影响[77]。注射外源性的线粒体能显著改善脂多糖诱导的小鼠抑郁样行为,作用机制可能与恢复ATP的产生功能及降低星形胶质细胞和小胶质细胞的活化有关[78]。电针配合帕罗西汀治疗慢性不可预测的轻度应激抑郁模型大鼠,蛋白质组学结果显示,电针作为辅助治疗能改善大鼠海马突触和线粒体蛋白表达,表现出线粒体保护作用,获得良好疗效[79]。
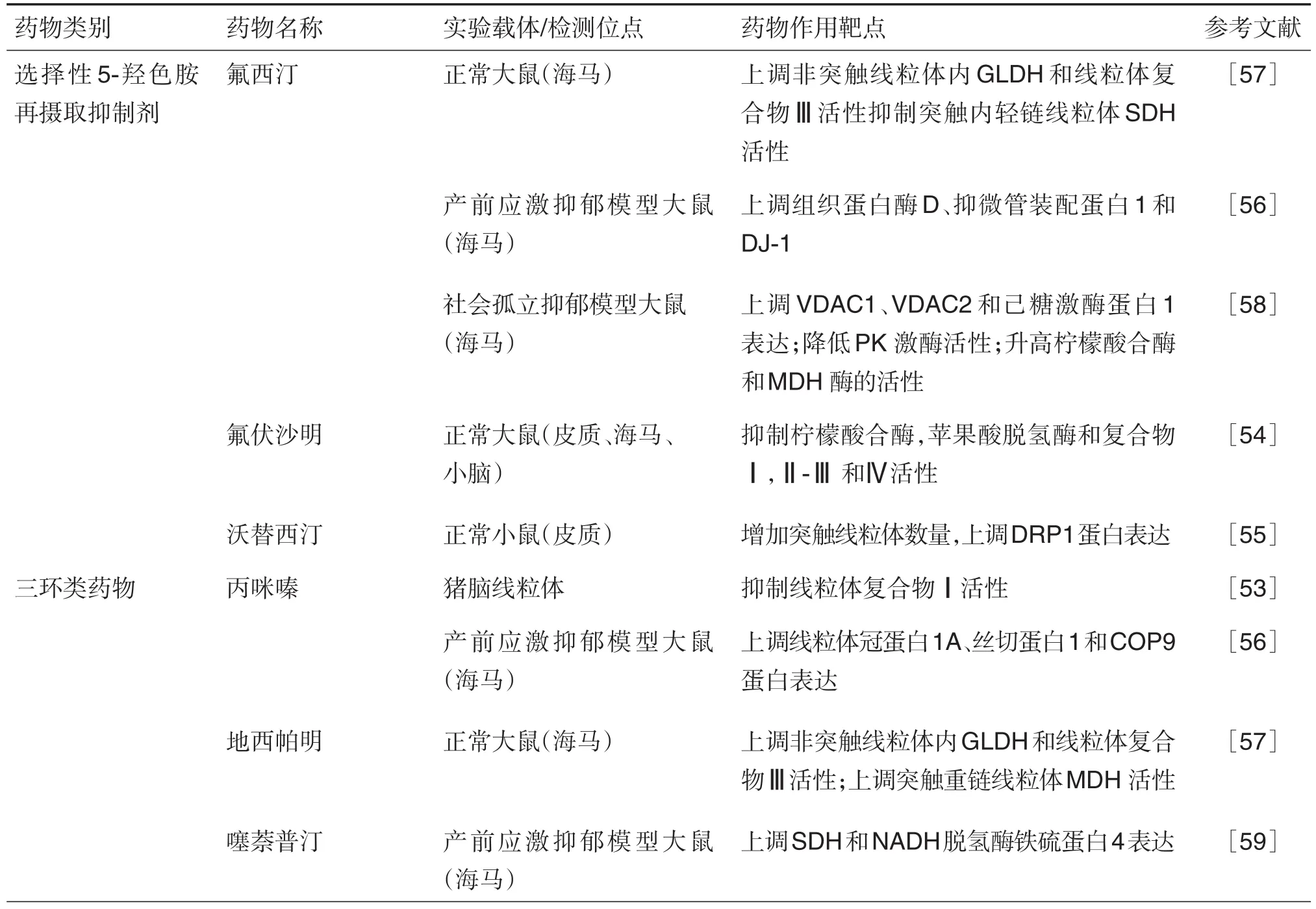
表1 抗抑郁药物对线粒体功能紊乱的影响

续表1
综上,线粒体在能量代谢、氧化应激和遗传调控等方面所呈现的线粒体功能紊乱与抑郁症的发病和治疗关系密切。现代研究表明,经典抗抑郁药物、非经典抗抑郁药物及其他治疗手段,均可从干预线粒体功能紊乱角度发挥一定的抗抑郁作用或辅助治疗效应,对抗抑郁药物的筛选、开发及现有药物的深入研究具有良好的学术借鉴意义。
4 结语
抑郁症作为常见精神疾病之一,其发病机制复杂,与遗传、神经生化、神经内分泌和炎症反应等因素相关,致使其治疗难度增加。线粒体作为机体一种供能细胞器,具有合成ATP为细胞提供能量、三羧酸循环、氧化磷酸化和储存钙离子等众多生理功能。现代研究已证实,线粒体功能紊乱与抑郁症的发病和治疗关系密切,并与抑郁症其他病理机制相互影响。本文主要从能量代谢、氧化应激和遗传调控等方面阐释线粒体功能紊乱与抑郁症发生发展病理机制的关联,同时总结了一些治疗药物和治疗手段的干预作用,以期为治疗抑郁症药物的研发及抑郁症临床联合用药治疗方案的实施提供参考依据。但回顾文献总结,以下问题仍值得进一步关注。
首先,在研究经典抗抑郁药物对线粒体功能的影响中,部分研究结果表现出矛盾或差异调控,如结构相似药物氟西汀和沃替西汀表现出不同作用,氟西汀呈现的对线粒体功能的差异调控。提示应注意机体不同脑区线粒体在功能上可能具有差别,可寻找与抑郁症发生最为密切的靶点部位,从而提高治疗药物选择性,减少副作用;并且,在实验研究中应注意对药物量效关系及不同抑郁模型动物自身线粒体功能紊乱差异的基础研究,有助于抗抑郁药干预线粒体功能研究的深入及实用性。其次,研究发现一些临床用于治疗其他疾病的药物因具有影响氧化应激的作用,可通过干预线粒体功能紊乱而发挥一定抗抑郁作用,由此提示,对这些药物的深入研究,可为临床抑郁症伴随和(或)并发其他疾病患者(如高脂血症)的治疗提供具有多重效应的药物,从而减少联合用药带来的不良反应。最后,基于抑郁症中线粒体功能紊乱,建议在今后抗抑郁新药或快速抗抑郁药的研发中,可从药物能否兼具线粒体保护功能及抑制氧化应激伴随的炎症-凋亡作用,以及能否调控线粒体氧化磷酸化系统,改善三羧酸循环和电子呼吸链相关的酶活性等为切入点,对候选药物(包括中药成分)进行筛选,寻找以改善线粒体功能为治疗靶点的新型抗抑郁症药物。

