蛹虫草菌种复壮方法探讨
宁宝云 薛姗姗 刘 慧 刘 康 郝继伟
(临沂大学生命科学学院,山东临沂276000)
蛹虫草(Cordyecps militaris)又名北虫草,为虫草菌科(Cordycipitaceae)虫草属(Cordyceps)的子囊真菌[1],具有极高的营养价值和药用价值。目前,蛹虫草已经实现工厂化、规模化生产[2]。蛹虫草菌种存在易衰老、退化等问题,导致菌种生产不稳定,影响蛹虫草规模化生产[3]。
当前,通常采用组织分离法、孢子分离法、虫体回接法和基内菌丝分离法等复壮退化蛹虫草菌种[4-6]。据王殿振等[7],张鑫等[8]研究,活蚕蛹回接法是一种复壮退化蛹虫草菌种理想方法,但此法存在周期长,操作过程烦琐,成本高等缺点,不宜频繁应用。组织分离法也是一种常用食用菌菌种繁殖方法,且具有操作简单等优点。笔者进一步深入研究两种方法,并探索出一种菌种复壮方法综合应用的新模式,从而保证优良蛹虫草菌种的可持续生产。
1 材料与方法
1.1 供试材料
供试蛹虫草菌株为SC-20,来自盛成农业科技有限公司;蚕蛹为网购的活蚕蛹。
1.2 培养基配方及制备
1.2.1 母种培养基
200 g马铃薯(去皮),20 g葡萄糖,5 g蛋白胨,1.5 g磷酸二氢钾,1 g硫酸镁,20 g琼脂,定容至1 000 mL,pH自然。配制好培养基,分装入180 mm×18 mm试管中,装液量为每管15 mL,121℃灭菌30 min后,摆斜面冷却备用。
1.2.2 液体培养基
母种培养基配方中除去琼脂粉即为液体培养基配方。配制方法同上,将液体培养基分别装入250 mL的锥形瓶中,每瓶装入量150 mL,121℃灭菌30 min后,冷却备用。
1.2.3 出草培养基
出草用大米培养基:大米20g,按固液比(质量体积比)1∶1.5,加入营养液(葡萄糖2%,磷酸二氢钾0.15%,硫酸镁0.1%)。培养基装入300 mL栽培瓶中,121℃灭菌60 min后备用。
1.3 试验方法
1.3.1 转接次数试验
将试验菌种记为F0,转接到固体斜面培养基上记为F1,在25℃的培养箱中培养7d后,转接到固体斜面培养基上记为F2,依次转接到F6。每代繁殖8管,除其中1管用于继续转接传代外,其余分别用于菌种保藏、退化性状测定试验(培养第7天记录每代菌丝生长速度,然后继续培养并观察转色时间以及管内出草现象等)以及制作液体菌种或出草试验等。
1.3.2 复壮方法比较试验
根据菌种扩繁代数试验结果,以未采取任何复壮方法菌种为对照,将尚未出现退化现象菌种与已出现明显退化现象的菌种分别采用组织分离法与活蚕蛹回接复壮法比较复壮效果。
1.3.2.1 组织分离复壮法
将选择的传代菌种,接种到大米培养基上培养。培养基上长出蛹虫草子座10 d后,选择形态典型、长势健壮的子座,剪取上部组织,先用70%酒精消毒再用无菌水冲洗5s,无菌滤纸吸干水后,剪成1 mm左右小段,无菌环境中接种到斜面上。22℃培养10 d后,接种于大米培养基上培养、出草。5次重复。
1.3.2.2 活蚕蛹复壮法
将选择的传代菌种接种到液体培养基,温度22℃、转速150 r/min,振荡培养5 d,得液体菌种备用。选取健康活柞蚕蛹,用70%~75%酒精擦洗蚕蛹体表消毒,再用无菌水反复冲洗,置于无菌环境中晾干;用无菌注射器抽取0.3 mL液体菌种注入活蚕蛹胸腔,置已消毒的培养瓶中,送入培养室内16~18℃培养。长出子座后,采用组织分离法培养斜面菌种,接种于大米培养基上培养、出草。
1.3.3 分离组织试验
采用活蚕蛹复壮菌种培养的子实体组织:子座生长前期(出草第10天)子座(对照),中期(出草第20天)子座,后期(出草第30天)子座,分别剪取子座上部的组织培养。组织块处理及接种培养方法同1.3.2.1。
1.4 数据分析
试验数据采用DPS统计软件分析,新复极差法多重比较。

图1 F1管内出草

图2 F2管内出草

图3 F3管内出草
2 结果与分析
2.1 回声接次数试验结果
菌种转接次数试验结果见图1、图2、图3和表1。由表1可以看出,菌丝日均生长量随转接次数的增加而逐步下降,但F1、F2与F3间无显著差异,F4及以后各代显著下降。
转色:F1、F2与F3间转色效果无明显差异,F4及以后各代转色效果差;菌丝长势:F1、F2、F3菌丝长势良好,F4、F5、F6菌丝长势差。
出草:F1和F2菌种蛹虫草出草好,F3菌种出草能力减弱,F5和F6菌种没有出草。
由此可见,蛹虫草菌种转接2次无退化现象,转接3次稍有退化现象,转接3次以上退化明显。
2.2 不同复壮方法效果
在菌种转接次数试验基础上,分别选择性状未退化菌种(F2)与已明显退化菌种(F4),采用组织分离法与活蚕蛹复壮法进行比较复壮效果。试验结果见表2。
由表2结果可知,组织分离法与活蚕蛹回接复壮法复壮F2,出草试验活蚕蛹回接法鲜草产量最高,其次是组织分离法、对照最低,但三者间无显著差异。由此也可以看出,组织分离法可保持菌种优良典型性状,降低菌种潜在的退化风险,但复壮效果不如蚕蛹回接法。

表1 蛹虫草菌种转接次数试验结果
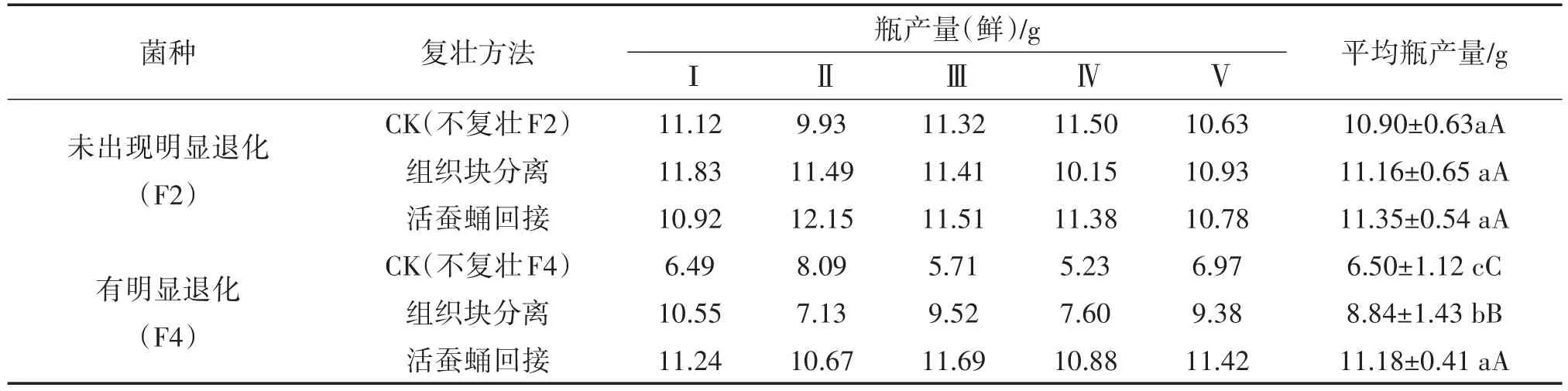
表2 两种复壮方法复壮效果(产量)比较
由表2同样可以看出,对明显退化菌种(F4)活蚕蛹回接复壮效果显著好于组织分离法。因此,蛹虫草菌种一旦出现退化现象,活蚕蛹回接复壮方法是最佳选择,与以往研究结果一致。
组织分离法对试验菌种的复壮效果,均不如活蚕蛹回接法,分析原因:一是虫体回接可以使虫生真菌对昆虫的毒力得到回复,原有的生物学性状也得以稳定[9];二是与组织分离法选取子座的质量有关,子座质量直接影响复壮效果。因此,生产中长期采用组织分离法分离菌种,因选择子座良莠不齐,极易导致菌种退化。
2.3 分离组织试验结果
由表3结果可知,组织分离法复壮蛹虫草菌种,分离组织采用生长前、中期的子座组织复壮效果好,且菌种质量稳定。

表3 分离组织试验结果
3 小结及复壮方法综合应用探讨
试验结果表明,优良蛹虫草菌株在转接2次仍会较好保留原有性状,转接3次或以上会逐渐出现退化现象,如转色越来越困难、菌丝生长变慢、管内出草不明显甚至不出草等;活蚕蛹回接复壮法对退化菌种的复壮效果明显好于组织分离法,但组织分离法有良好的延缓菌种退化的作用。

图4 活蚕蛹回接法与组织分离法相结合的蛹虫草菌种综合复壮生产模式
菌种的退化原因有很多,如核型的改变[10]、基因突变[11-12]、胞内有害物质的积累[13]以及无性繁殖体感染病毒[14]等。菌种的过度传代、长期保藏、长期无性繁殖等均会诱发退化,最终往往是多种因素共同作用导致菌种的退化。因此,菌种退化初期,表现不明显,只有多种引起退化因素积累到一定程度时,才会表现出明显退化性状(产量下降,甚至不出草)。而蛹虫草菌种一旦退化,采用复壮效果好的活蚕蛹回接法复壮,因周期较长,会影响蛹虫草工厂化生产。
为此,笔者提出了活蚕蛹回接法与组织分离法相结合的蛹虫草菌种综合复壮生产模式,其工艺流程见图4。该模式避免了菌种的连续扩繁传代,可保持菌种的及时复壮更新,并可持续生产出质量稳定的优良菌种,保证蛹虫草工厂化生产的稳定。

