固相萃取和分散固相净化-串联质谱测定茶鲜叶和干茶中的农药残留
杨洁,周利,余焕,孙荷芝,王新茹,张新忠,杨梅,陈宗懋,罗逢健
固相萃取和分散固相净化-串联质谱测定茶鲜叶和干茶中的农药残留
杨洁1,2,周利1*,余焕1,2,孙荷芝1,王新茹1,张新忠1,杨梅1,陈宗懋1,罗逢健1*
1. 中国农业科学院茶叶研究所农产品质量安全研究中心,浙江 杭州 310008;2. 中国农业科学院研究生院,北京 100081
建立了茶鲜叶和干茶中9种农药的残留分析方法。样品中的残留农药经乙腈提取,Florisil/GCB固相萃取柱和PSA/GCB分散固相联合净化,超高效液相色谱串联质谱(UPLC-MS/MS)和气相色谱质谱联用(GC-MS)测定。在0.005~1.000 mg·kg-1的添加水平下,目标农药在鲜叶和干茶中的平均回收率在70.3%~103.9%,相对标准偏差(RSD)<20.0%。在0.005~2.000 mg·kg-1浓度范围,目标农药在鲜叶和干茶基质中的线性关系良好,>0.995 4。定量限(LOQ)为0.005 mg·kg-1。实际样品检测结果表明,该方法灵敏度高,重现性好,能够满足农药多残留检测的要求。
农药多残留;超高效液相色谱串联质谱;气相色谱质谱联用;茶;固相萃取;分散固相净化
茶树生长在湿热的环境中,病虫草害较易发生,化学防治仍是其防治的方法之一[1]。在茶树生长期内,通常需要施用化学农药以保障茶叶产量和质量。由于农药抗性和农药产业的发展,茶园常用农药也需更新换代[2]。研究表明,鱼藤酮[3]、甲氧虫酰肼[4-5]、嘧菌酯[6]等对茶园危害严重的茶尺蠖、假眼小绿叶蝉、斑点病等病虫害具有较好的防治效果,具有在茶园登记应用的潜力。联苯菊酯早在1988年就在我国登记使用,对茶叶中的多种害虫有较好的防治效果[7]。茚虫威、虫螨腈、苯醚甲环唑、氟啶虫酰胺、吡唑醚菌酯是近年茶园中登记农药品种。
上述农药在茶叶中的前处理方法包括分散固相萃取法(dSPE,Dispersive solid-phase extraction)[8-12]、固相萃取法(SPE,Solid-phase extraction)[13-15]、加速溶剂萃取法[16]和凝胶渗透色谱法[17]等。其中常用的SPE柱有TPT柱[18]、Carb-NH2柱[19-20]、PSA柱[21-22]和Florisil柱[13,23]等,通常使用物质的回收率和对基质的净化效果来判定SPE柱的适用性[24]。
我国茶叶农药多残留分析方法国家标准GB/T 23204—2008《茶叶中519种农药及相关化学品残留量的测定气相色谱-质谱法》和GB/T 23200.13—2016《茶叶中448种农药及相关化学品残留量的测定液相色谱-质谱法》中,均采用乙腈提取、TPT固相萃取柱净化、质谱仪测定茶叶中的农药多残留,但是上述两个国家标准中均无茶叶中氟啶虫酰胺分析方法。茶叶中富含的茶多酚、生物碱、色素和糖[25]等内含物质易与目标农药形成共流出物,对目标化合物的分析造成干扰[26],因此茶叶中农药残留分析对样品前处理要求较高。本试验通过比较TPT柱、Carb-NH2柱、Florisil+GCB混合柱和Florisil+GCB混合柱-分散固相萃取4种方法对茶鲜叶和干茶基质的回收率、净化效果和试验时间成本的差异,建立了茶鲜叶和干茶中9种农药的Florisil/GCB固相萃取柱结合PSA/GCB分散固相净化的样品前处理方法,并应用于实际样品测定。
1 材料与方法
1.1 仪器与试剂
Varian 450GC-300MS气相色谱-质谱联用仪(美国Varian公司);Waters ACQUITY UPLC H-Class超高效液相色谱-Waters Vevo TQ-SMicro三重四极杆串联质谱仪,配有MassLynx 4.1处理软件(美国Waters公司);3K-15冷冻离心机(德国Sigma公司);Vortex Genie 2型涡旋振荡器(美国Scientific Industries);R-210旋转蒸发仪(德国IKA公司);玻璃柱管(200 mm×10 mm,杭州常盛科教器具厂);0.22 µm Filter Unit滤膜(天津博纳艾杰尔科技有限公司)。
农药标准物质(德国CNW Technologies Gmb H公司,纯度>99.0%)。乙腈、正己烷、丙酮(色谱纯,德国默克公司);甲酸(色谱纯,上海安谱实验科技股份有限公司);无水硫酸镁、无水硫酸钠、无水乙酸钠(分析纯,上海凌峰化学试剂有限公司);无水氯化钠(分析纯,广东光华科技股份有限公司);超纯水(杭州娃哈哈有限公司);GCB(120~400目)、PSA(40~60 µm)、Cleanert TPT净化柱(1 g/6 mL)、Cleanert PestiCarb-NH2净化柱(1 g/6 mL)(天津博纳艾杰尔科技有限公司);Florisil吸附剂(60~100目,温州市化学用料厂)。
1.2 标准溶液配制
分别称取9种化合物标准品各0.01 g,用乙腈(色谱纯)溶解并定容至10 mL,分别配制成1 000 mg·L-1标准储备溶液,–20℃保存。将上述标准储备液用乙腈逐级稀释成2.00、1.00、0.50、0.20、0.05、0.005 mg·L-1系列混合标准工作溶液。
1.3 样品的提取与净化
准确称取2.0 g粉碎后的鲜叶或干茶样品(精确至0.01 g)于50 mL离心管中(干茶中加入1 mL水混匀静置10 min),加入20 mL乙腈,涡旋震荡1 min,静置15 min,再加入1 g无水氯化钠和1 g无水硫酸镁,涡旋震荡1 min,8 000 r·min-1离心5 min后,取10 mL上清液于鸡心瓶中,旋转蒸发至近干,待净化。4种净化方式如下:
1.3.1 TPT柱净化
用10 mL乙腈-苯(乙腈∶苯=3∶1)预淋洗TPT柱,25 mL乙腈-苯(乙腈∶苯=3∶1)分5次润洗鸡心瓶后上柱,接收流出液,旋转蒸发浓缩至近干后吹干,加入1 mL乙腈溶解残渣,过0.22 µm尼龙微孔滤膜后转移至进样小瓶,待进样分析。
1.3.2 Carb-NH2柱净化
用10 mL乙腈-苯(乙腈∶苯=3∶1)预淋洗Carb-NH2净化柱,25 mL乙腈-苯(乙腈∶苯=3∶1)分5次润洗鸡心瓶后上柱,接收流出液,旋转蒸发浓缩至近干后吹干,加入1 mL乙腈溶解残渣,过0.22 µm尼龙微孔滤膜后转移至进样小瓶,待进样分析。
1.3.3 Florisil+GCB混合柱净化
用5 mL丙酮-正己烷(丙酮∶正己烷=1∶1)预淋洗自制的Florisil+GCB混合柱,用15 mL丙酮-正己烷(丙酮∶正己烷=1∶1)分3次润洗鸡心瓶后上柱,接收流出液,旋转蒸发浓缩至近干后吹干,用1 mL乙腈定容,过0.22 µm尼龙微孔滤膜后转移至进样小瓶,待进样分析。
自制Florisil+GCB混合柱:在玻璃层析柱中,从下至上依次装入脱脂棉,1 g无水硫酸钠,2.05 g混匀的Florisil和GCB(质量比为2∶0.05),1 g无水硫酸钠。Florisil吸附剂使用前在650℃下烘5 h,放入干燥器冷却,使用时,按照超纯水∶吸附剂=7∶100的比例加入超纯水混匀静置4 h后使用。
1.3.4 Florisil+GCB混合柱和dSPE联合净化
将1.3.3章节中定容后的乙腈溶液转移到盛装有30 mg PSA和30 mg GCB的2 mL离心管中,涡旋震荡30 s,12 000 r·min-1离心1 min,过0.22 µm尼龙微孔滤膜后转移至进样小瓶,待进样分析。
1.4 添加回收率试验
在茶鲜叶和空白样品中,分别添加标准混合溶液,制备添加水平为0.005、0.05、1 mg·kg-1的茶鲜叶添加样品,和添加水平为0.005、0.05、0.5 mg·kg-1的成茶添加样品,每个添加水平5个重复,涡旋混匀后过夜放置,按照1.3.4章节进行提取净化。
1.5 仪器条件
1.5.1 超高效液相色谱-串联质谱条件
液相色谱条件:色谱柱ACQUITY UPLCBEH C18(2.1 mm×100 mm×1.7 µm);流动相A为乙腈(含1‰甲酸),流动相B为超纯水,进样量5 µL,流速0.25 mL·min-1,柱温40℃,流动相洗脱程序:0~0.5 min(A 5%~30%),0.5~3 min(A:30%~70%),3~5 min(A:70%~85%),5~6 min(A:85%~99%),7~8 min(A:99%~5%),8~9 min(A:5%)。离子源模式ESI+,多反应监测MRM模式;离子源温度150℃;脱溶剂气温度350℃;毛细管电压3.5 kV;脱溶剂气N2;碰撞气Ar;目标化合物质谱参数见表1。
1.5.2 气相色谱-串联质谱条件
气相色谱条件:色谱柱VF-5ms(30 m×0.25 mm×0.25 µm,美国安捷伦公司);升温程序80℃保持1 min,以20℃·min-1的速率升至200℃,以6℃·min-1的速率升至266℃,以1.5℃·min-1的速率升至280℃,保持5 min。
质谱条件:离子源温度230℃;传输线温度280℃;进样口温度250℃;载气为高纯氦气,纯度≥99.999%;离子化方式:EI;监测模式为选择离子监测SIM,目标化合物质谱参数见表2。
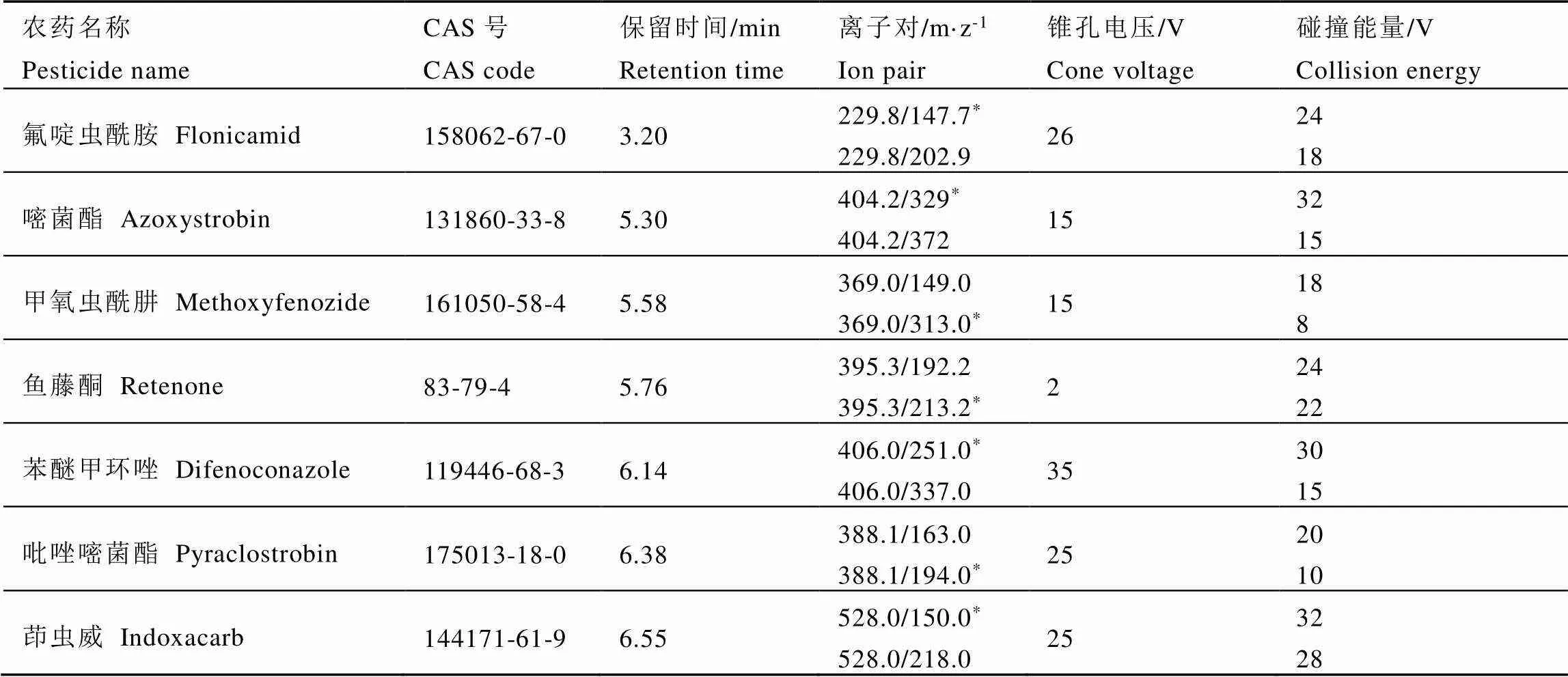
表1 农药测定的ESI+-MS/MS条件
注:*:定量离子
Note: *: Quantification ions

表2 农药测定的EI-MS条件
1.5.3 定性定量方法
在与基质匹配标准溶液相一致的保留时间下,所选择的所有离子或离子对的丰度比与基质匹配标准溶液样品的离子丰度比相一致(相对丰度>50%,允许±20%偏差;相对丰度>20%~50%,允许±25%偏差;相对丰度>10%~20%,允许±30%偏差;相对丰度≤10%,允许±50%偏差)[27],则可判断样品中存在该目标化合物。目标化合物的定量采用外标法,定量用溶液采用基质匹配标准溶液。
2 结果与分析
2.1 样品前处理条件优化
对比了1.3.1章节中TPT柱、1.3.2章节中Carb-NH2柱和1.3.3章节中Florisil+GCB混合柱3种净化方式对目标化合物的回收率和基质效应(ME,采用单点校正方式,=(A-A)÷A×100%,其中A表示基质匹配标准溶液的响应,A表示溶剂标准溶液的响应)。由表3可知,采用Carb-NH2柱净化后物质的回收率在56.7%~84.1%,而采用TPT和Florisil+GCB两种方法净化后的回收率在71.2%~94.9%,RSD为1.2%~14.0%,满足农药残留测定要求[28]。TPT柱净化后的基质效应稍大于Florisil+GCB的基质效应。
但是Florisil+GCB混合柱净化后的定容溶液呈墨绿色,易对质谱造成污染。采用1.3.4章节方法,即加入GCB和PSA分散固相吸附剂再次净化后,溶液呈浅黄色,是由于GCB和PSA可去除基质中的有机酸、糖类和极性色素等[29-31]。经1.3.4章节处理后,目标物质的回收率在70.6%~108.4%,RSD<20%。
比较体积比为9∶1、8∶2、7∶3、1∶1的正己烷-丙酮洗脱溶液对Florisil+GCB混合柱净化后回收率的影响(图1),结果表明,随着丙酮比例的增加,目标化合物回收率增加。在正己烷∶丙酮=1∶1混合溶液洗脱时,9种农药的添加回收率增加到73.9%~107.3%。洗脱溶剂体积对回收率的影响如图2所示,随着洗脱溶剂体积增加,目标化合物回收率增加,当洗脱溶液体积增加到15 mL时,物质的回收率达83.0%~97.6%,因此采用15 mL正己烷∶丙酮=1∶1混合溶液作为最佳洗脱溶剂。
比较洗脱溶剂体积对TPT柱回收率的影响(图3),当洗脱溶剂(乙腈∶苯=3∶1)体积增加到20 mL时,目标物的回收率达到农残测定要求,在72.2%~88.4%。此方法与采用15 mL体积比为1∶1的正己烷-丙酮洗脱Florisil+GCB混合柱相比,需要使用更多的洗脱溶剂;与正己烷和丙酮相比,乙腈的高沸点使得洗脱溶液的旋转蒸发浓缩时间增加,因此本试验选择1.3.4章节中的方法分析茶叶中9种目标化合物的残留量。
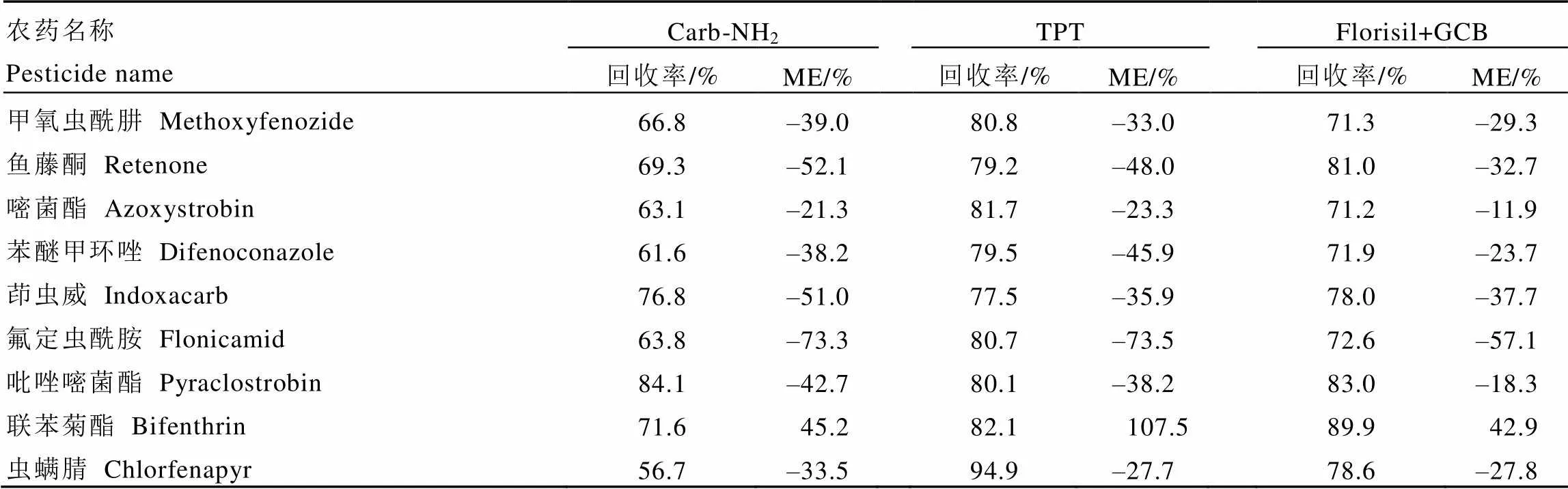
表3 农药经过不同的净化材料的回收率和ME
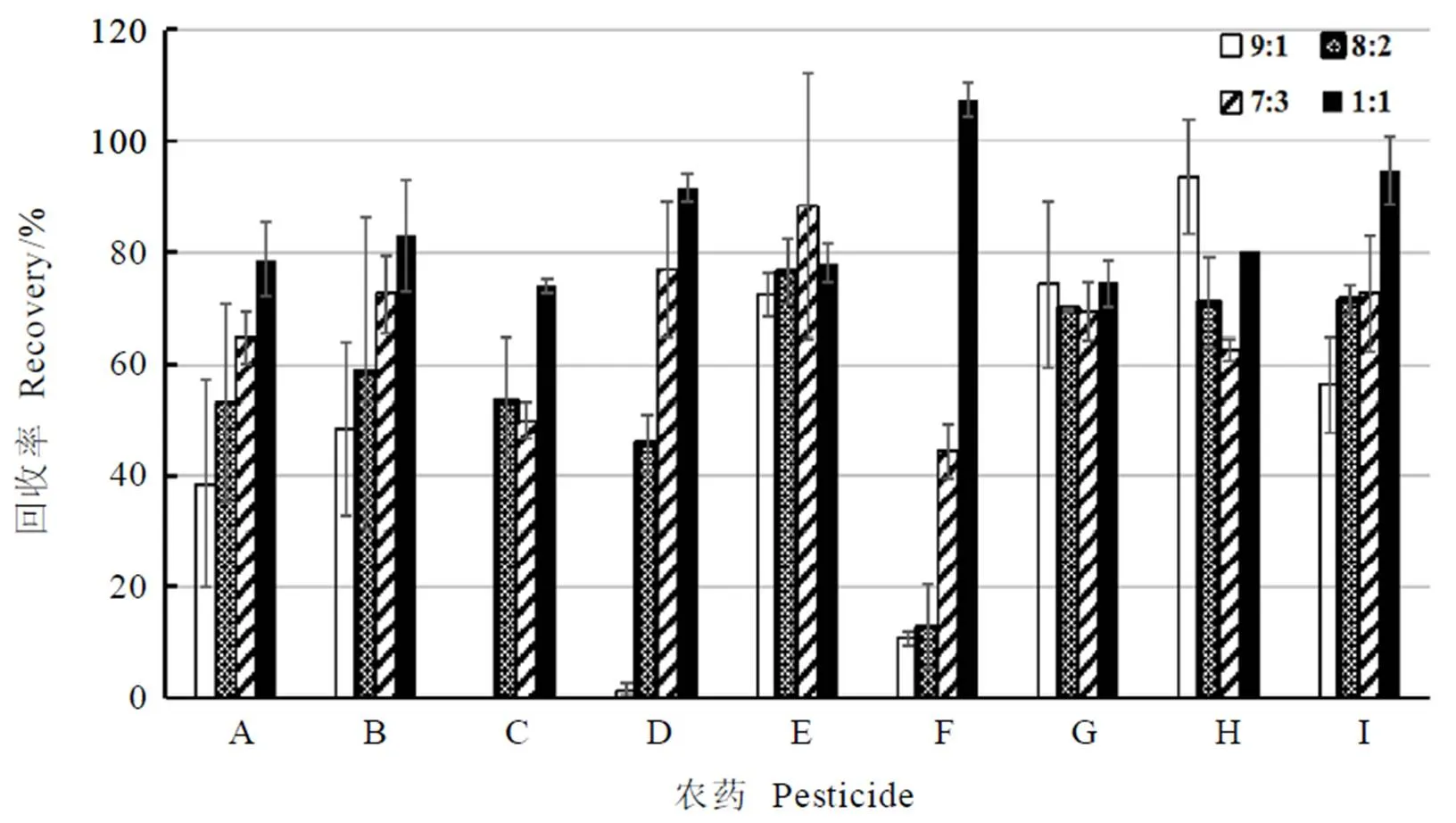
注:A:甲氧虫酰肼;B:鱼藤酮;C:嘧菌酯;D:苯醚甲环唑;E:茚虫威;F:氟定虫酰胺;G:吡唑嘧菌酯;H:联苯菊酯;I:虫螨腈。下同
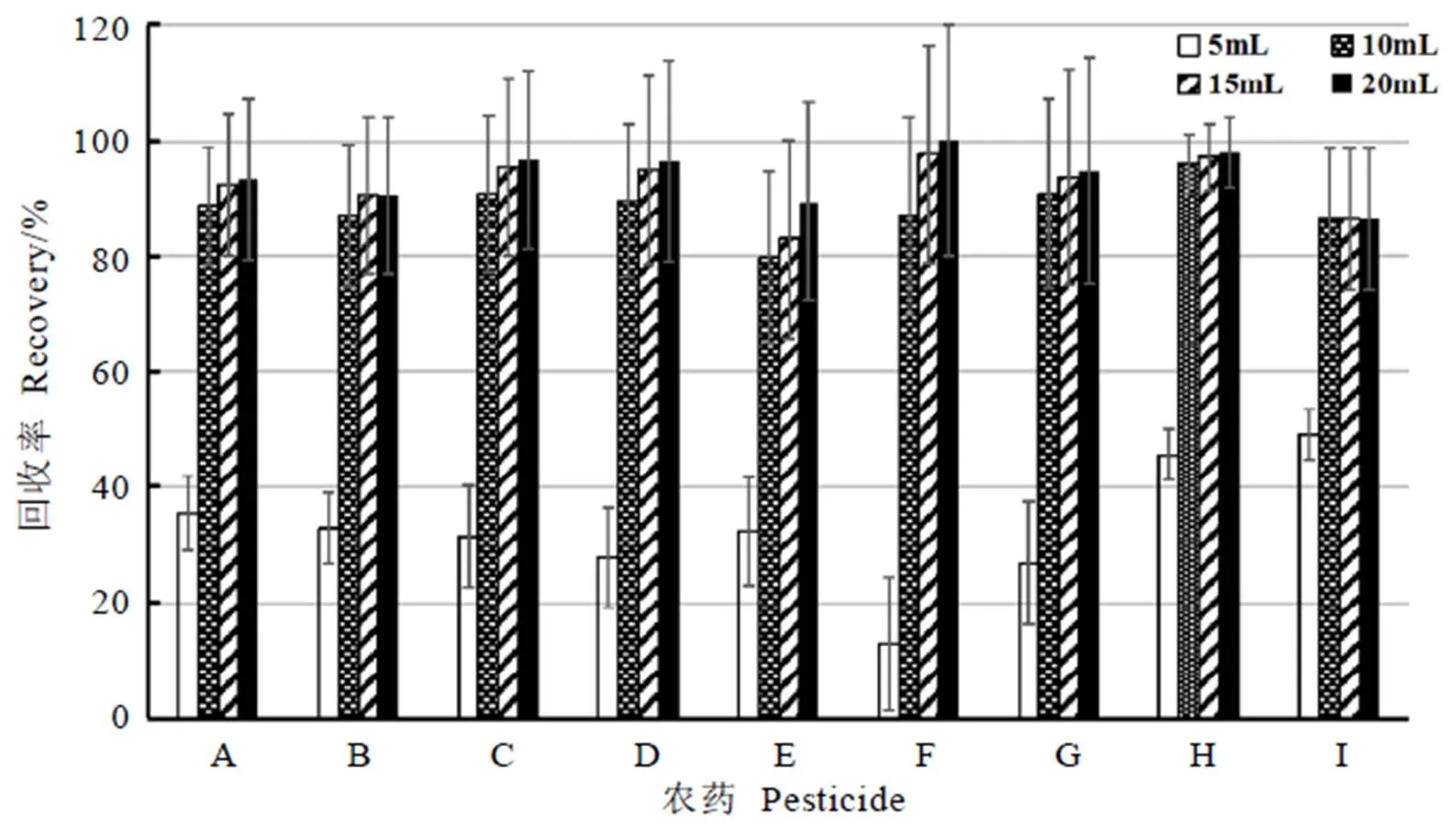
图2 Florisil+GCB混合柱的洗脱溶剂体积对农药回收率的影响
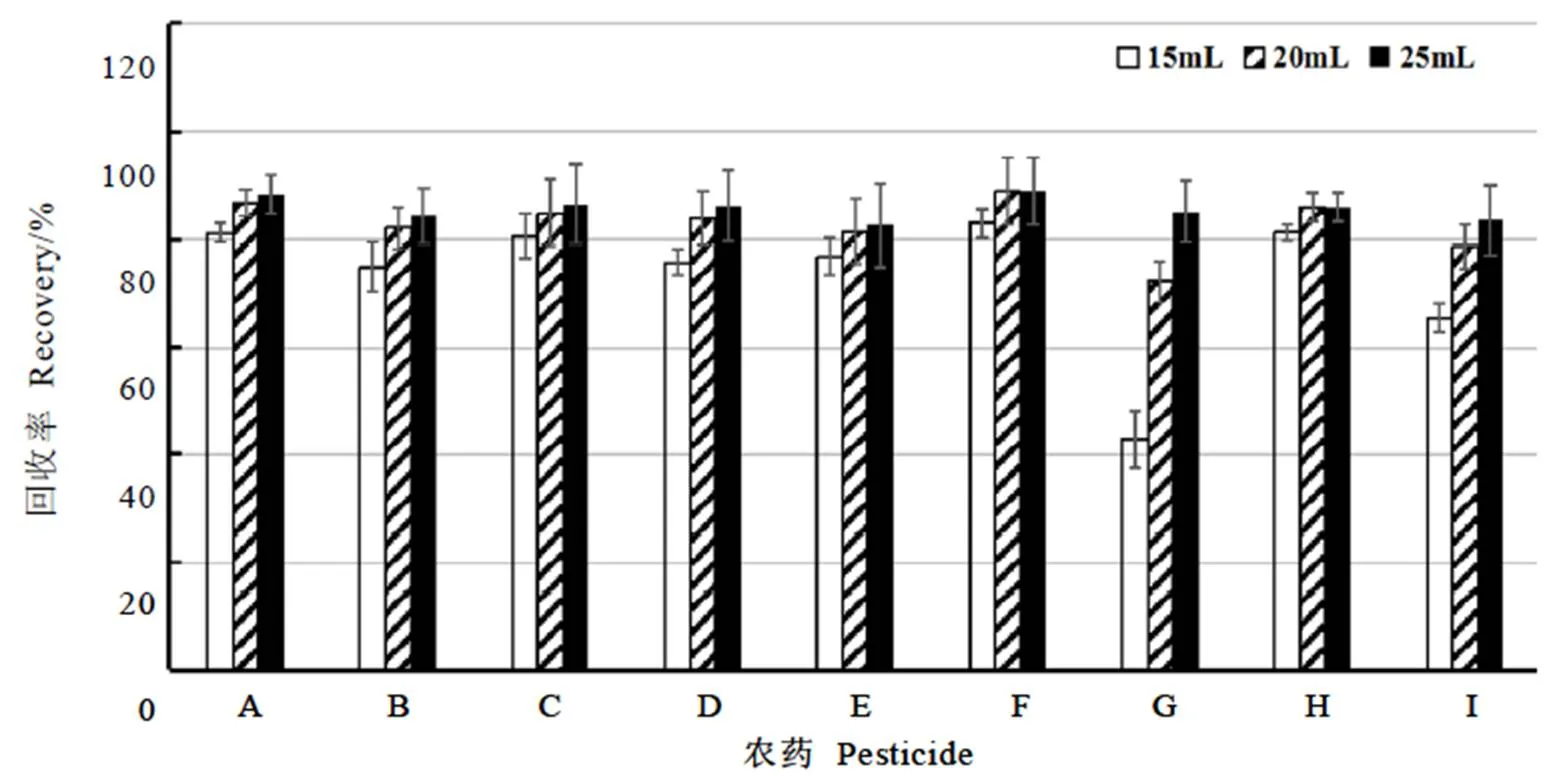
图3 TPT柱的洗脱溶剂体积对农药回收率的影响
2.2 线性方程和基质效应
制备鲜叶和干茶的基质空白溶液,并用空白基质溶液配置质量浓度为2.00、1.00、0.50、0.20、0.05、0.005 mg·L-1的基质匹配标准溶液。
以溶剂标准溶液与鲜叶和干茶的基质匹配标准溶液的斜率计算基质效应[32]:
=(K-K)/K×100%
其中K为基质标准曲线的斜率,K为溶剂标准曲线的斜率。结果如表4所示,在0.005~2 mg·kg-1的浓度范围内,目标化合物在溶剂、鲜叶基质和干茶基质中的线性关系良好,线性相关系数在0.995 4~0.999 8。
鲜叶中9种农药的基质效应在–29.3%~23.7%,其中除氟啶虫酰胺(–29.3%)和联苯菊酯(23.7%)的基质效应高于20%外,其他7种农药在茶鲜叶基质中的基质效应不显著。干茶中9种农药的基质效应明显高于鲜叶中,除了虫螨腈在干茶中的基质效应小于鲜叶中外,其他8种农药干茶中的基质效应明显高于鲜叶中,范围在–77.8%~58.9%,干茶基质引起的基质增强或基质减弱效应明显。因此,茶叶中目标化合物定量均采用基质匹配标准溶液。
2.3 回收率和精密度
鲜叶和干茶基质中9种农药的添加回收率和精密度见表5。在0.005~1.000 mg·kg-1的添加范围内,目标化合物的回收率范围在70.3%~103.9%,RSD<20.0%。LOQ以最小添加浓度表示,为0.005 mg·kg-1。
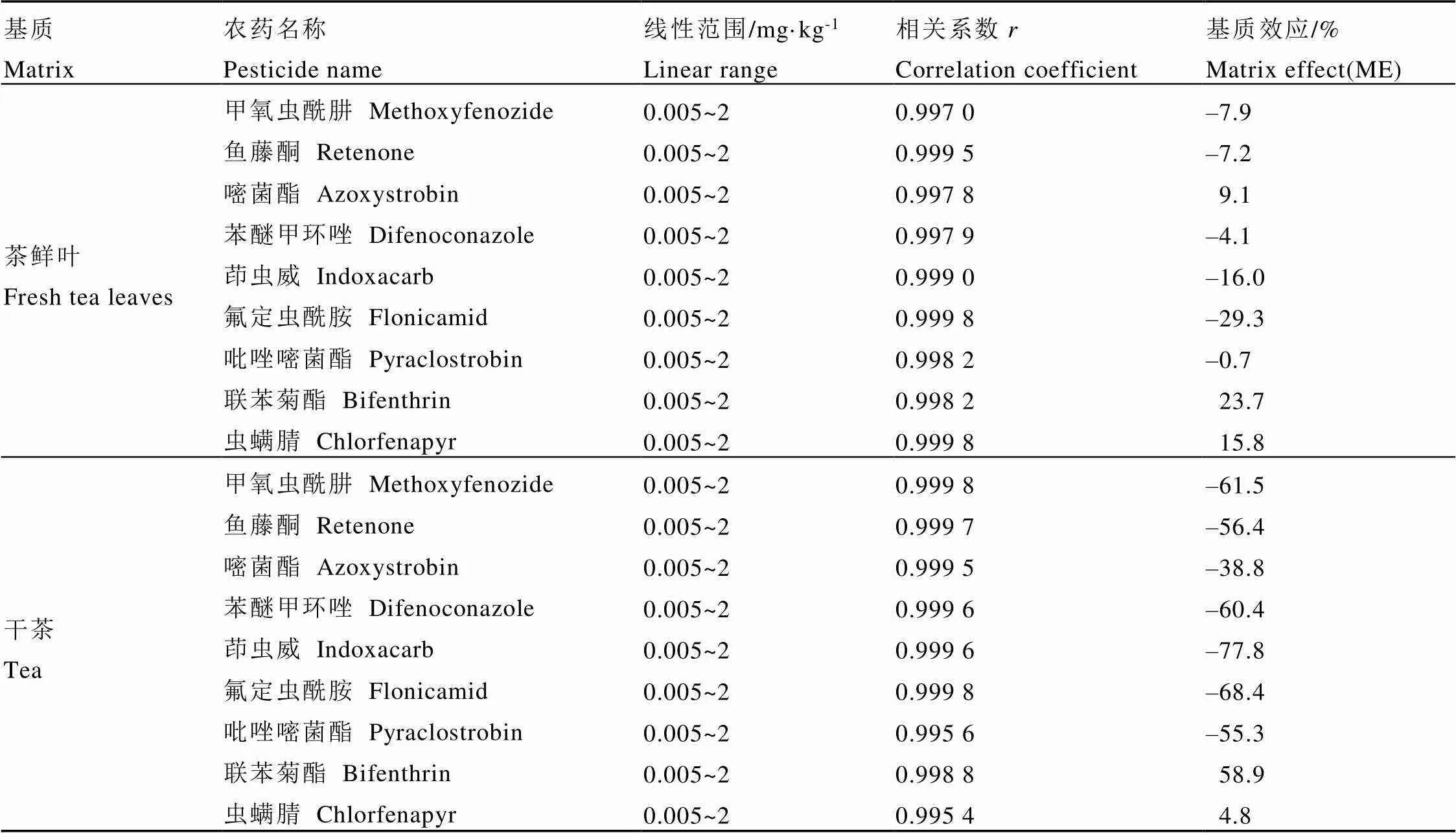
表4 农药的线性方程和相关系数
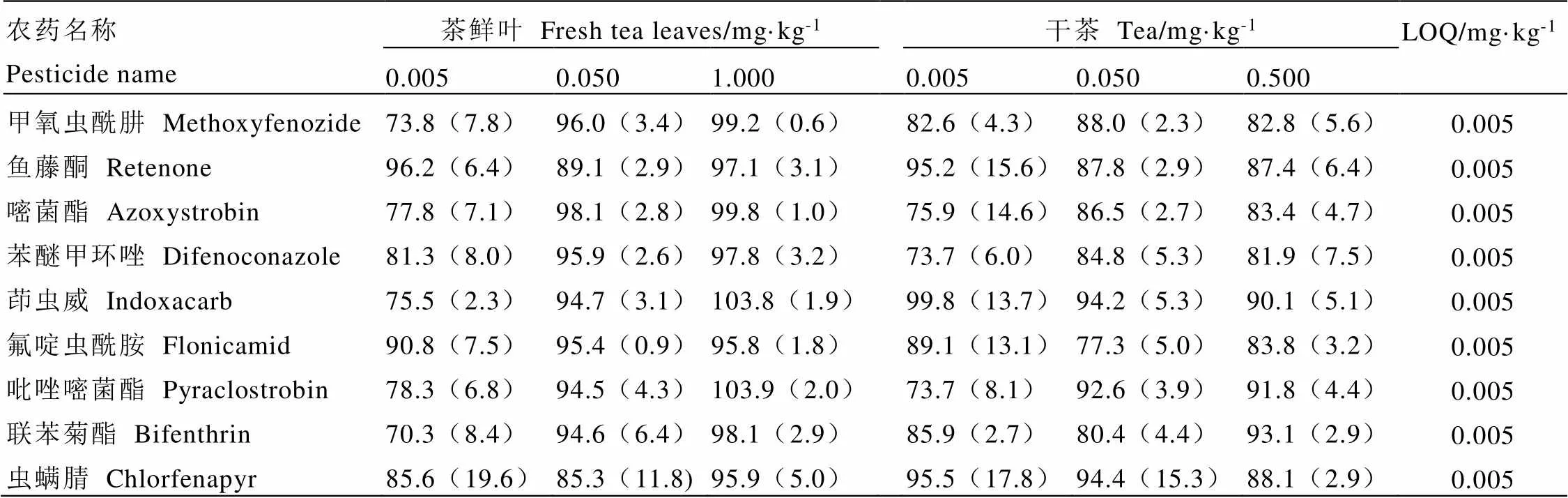
表5 农药的添加回收率和LOQ(n=5)
2.4 实际样品测定
采用本文方法测定了市售27份茶叶样品,其中2份检出茚虫威(0.007~0.008 mg·kg-1)、14份检出联苯菊酯(0.006~0.400 mg·kg-1),2份检出虫螨腈(0.005~0.200 mg·kg-1),8份检出苯醚甲环唑(0.008~0.300 mg·kg-1),7份检出吡唑嘧菌酯(0.005~0.030 mg·kg-1),检出样品的农药残留量均远低于我国GB/T 2763—2019[33]中规定的相关农药的最大残留限量水平(茚虫威5 mg·kg-1,联苯菊酯5 mg·kg-1,虫螨腈20 mg·kg-1,苯醚甲环唑10 mg·kg-1,吡唑醚菌酯10 mg·kg-1)。所有茶样均未检出甲氧虫酰肼、嘧菌酯、鱼藤酮和氟定虫酰胺。
3 结论
本研究通过优化茶鲜叶和干茶基质中目标农药的前处理条件,比较4种方法对茶叶中目标物质回收率、基质效应、溶剂使用量和试验时间成本的差异,建立了乙腈提取,Florisil+GCB混合柱和PSA/GCB分散固相联合净化,UPLC-MS/MS和GC-MS测定茶叶中氟啶虫酰胺等9种农药的低成本测定方法。对市售27份茶叶样品的筛查结果表明,该方法适用于茶叶中目标农药残留的定量分析检测。
[1] 李加成. 我国农业病虫害防治现状及建议分析[J]. 种子科技, 2017, 35(6): 106-108. Li J C. Status analysis and suggestions of the disease and pest control in China [J]. Seed Science & Technology, 2017, 35(6): 106-108.
[2] 罗宗秀, 苏亮, 陈宗懋. 茶园农药须注意更新换代[J]. 中国茶叶, 2018, 40(3): 36-38. Luo Z X, Su L, Chen Z M. Attention should be paid to update the pesticide in tea garden [J]. China Tea, 2018, 40(3): 36-38.
[3] 田新湖, 陈益生. 鱼藤酮等生物农药防治茶假眼小绿叶蝉药效试验[J]. 上海农业科技, 2012, 28(1): 127-130. Tian X H, Chen Y S. Control efficacy of rotenone and other biological pesticides on the tea green leafhopper [J]. Shanghai Agricultural Science and Technology, 2012, 28(1): 127-130.
[4] 赵丰华, 任红楼, 蒋双丰, 等. 豫南茶园主要害虫防治药剂筛选研究[J]. 天津农业科学, 2014, 20(12): 94-98. Zhao F H, Ren H L, Jiang S F, et al. Screening of main pests insecticides in South Henan tea garden [J]. Tianjin Agricultural Sciences, 2014, 20(12): 94-98.
[5] 卢兆成, 赵海英, 乔利. 13种杀虫剂防治茶尺蠖室内药效试验[J]. 农药科学与管理, 2012, 33(6): 46-50. Lu Z C, Zhao H Y, Qiao L. The laboratory test of thirteen in secticides againstWehrli [J]. Pesticide Science and Administration, 2012, 33(6): 46-50.
[6] 赵晓珍, 段长流, 李冬雪, 等. 茶叶斑点病的药剂筛选及田间防治技术初步研究[C]//中国植物保护学会. 绿色生态可持续发展与植物保护——中国植物保护学会第十二次全国会员代表大会暨学术年会论文集. 北京: 2017. Zhao X Z, Duan C L, Li D X, et al. Preliminary research on chemicals screening and field control of tea spot disease [C]//Chinese Society of Plant Protection. Sustainable Development of Green Ecology and Plant Protection: Proceedings of the 12th National Congress of the Chinese Society of Plant Protection. Beijing: 2017.
[7] 周晓东, 王润龙, 黄亚辉, 等. 天王星(联苯菊酯)在茶叶生产上的安全性试验[J]. 茶叶通讯, 2002(3): 24-25. Zhou X D, Wang R L, Huang Y H, et al. Safety test of uranus (bifenthrin) in tea production [J]. Journal of Tea Communication, 2002(3): 24-25.
[8] 张新忠, 罗逢健, 陈宗懋, 等. 分散固相萃取净化超高效液相色谱串联质谱法研究茶叶与茶汤中茚虫威残留降解规律[J]. 分析测试学报, 2013, 32(1): 1-8. Zhang X Z, Luo F J, Chen Z M, et al. Study of indoxacarb residue degradation in tea and tea Infusion by ultra high performance liquid chromatography coupled with tandem mass spectrometry after dispersive solid phase extraction cleanup [J]. Journal of Instrumental Analysis, 2013, 32(1): 1-8.
[9] 钱承敬, 史晓梅, 谢云峰, 等. 气相色谱-串联质谱法测定茶叶茶汤中多种农药残留量[J].食品安全质量检测学报, 2017, 8(8): 3218-3230. Qian C J, Shi X M, Xie Y F, et al. Determination of multi-pesticide residue in tea and tea infusion by gas chromatography-tandem mass spectrometry [J]. Journal of Food Safety & Quality, 2017, 8(8): 3218-3230.
[10] Wu C. Multiresidue method for the determination of pesticides in Oolong tea using QuEChERS by gas chromatography-triple quadrupole tandem mass spectrometry [J]. Food Chemistry, 2017, 229: 580-587.
[11] 王兵, 李斌, 张媛媛, 等. QuEChERS-高效液相色谱法测定绿茶中虫螨腈残留[J]. 中国食品学报, 2017, 17(1): 240-245. Wang B, Li B, Zhang Y Y, et al. Determination of chlorfenapyr in green tea by QuEChERS-high-performance liquid chromatography [J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(1): 240-245.
[12] 李玮, 贾彦博, 林伟杰, 等. 分散固相萃取净化-气相色谱-质谱联用法测定茶叶中7种杀螨杀虫类农药残留[J]. 食品安全质量检测学报, 2017, 8(9): 3485-3490. Li W, Jia Y B, Lin W J, et al. Determination of 7 pesticides residues in tea by gas chromatography-mass spectrometry combined with dispersive solid phase extration [J]. Journal of Food Safety & Quality, 2017, 8(9): 3485-3490.
[13] Zhang X Z, Luo F J, Lou Z Y, et al. Simultaneous and enantioselective determination of-epoxiconazole and indoxacarb residues in various teas, tea infusion and soil samples by chiral high performance liquid chromatography coupled with tandem quadrupole-time-of-flight mass spectrometry [J]. Journal of Chromatography A, 2014, 1359: 212-223.
[14] 吴林, 吴晓波, 张承聪, 等. 固相萃取-气相色谱法同时检测茶叶中多种农药和多氯联苯残留[J]. 食品科学, 2011, 32(14): 223-226. Wu L, Wu X B, Zhang C C, et al. Multiresidue determination of pesticides and polychlorinated biphenyls in tea by solid-phase extraction and gas chromatography [J]. Food Science, 2011, 32(14): 223-226.
[15] Song W H, Xie L P, Shao T F. Determination of 33 pesticides in tea by accelerated solvent extraction-gel permeation and solid-phase extraction purification-gas chromatography-mass spectrometry [J]. Chinese Journal of Chromatography, 2008, 26(1): 22-28.
[16] 徐敦明, 卢声宇, 陈达捷, 等. 加速溶剂萃取-气相色谱-串联质谱法测定茶叶中10种吡唑和吡咯类农药的残留量[J]. 色谱, 2013, 31(3): 218-222. Xu D M, Lu S Y, Chen D J, et al. Determination of ten pesticides pyrazoles and pyrroles in tea by accelerated solvent extraction coupled with gas chromatography-tandem mass spectrometry [J]. Chinese Journal of Chromatography, 2013, 31(3): 218-222.
[17] 李军明, 钟读波, 王亚琴, 等. 在线凝胶渗透色谱-气相色谱/质谱法检测茶叶中的153种农药残留[J]. 色谱, 2010, 28(9): 840-848. Li J M, Zhong D B, Wang Y Q, et al. Determination of 153 pesticides in tea using online gelpermeation chromatography-gas chromatography/mass spectrometry [J]. Chinese Journal of Chromatography, 2010, 28(9): 840-848.
[18] 唐吉旺, 王建秀, 袁列江, 等. 气相色谱-串联质谱法测定茶叶中24种农药残留量[J]. 理化检验(化学分册), 2015, 51(11): 1557-1561. Tang J W, Wang J X, Yuan L J, et al. GC-MS/MS determination of residual amounts of 24 pesticides in tea [J]. Physical Testing and Chemical Analysis (Part B: Chemical Analysis), 2015, 51(11): 1557-1561.
[19] 周华, 张蕴, 吴平谷, 等. 固相萃取-气相色谱质谱联用法测定茶叶中溴虫腈和茚虫威[J]. 卫生研究, 2016, 45(5): 817-820. Zhou H , Zhang Y , Wu P G, et alDetermination of chlorfenapyr and indoxacarb in tea by gas chromatography-mass spectrometry with solid phase extraction [J]. Journal of Hygiene Research, 2016, 45(5): 817-820.
[20] 许欣欣, 王冰, 陈慧玲, 等. 气相色谱-质谱联用法测定茶叶中溴虫腈、啶虫脒和茚虫威[J]. 预防医学情报杂志, 2017, 33(9): 901-904. Xu X X, Wang B, Chen H L, et al. Determination of chlorfenapyr, acetamiprid and indoxacarb in tea by gas chromatography/mass spectrometry [J]. Journal of Preventive Medicine Information, 2017, 33(9): 901-904.
[21] 姚铭栋. 固相萃取-气相色谱/串联质谱法测定茶叶中49种农药残留量[J]. 中国卫生检验杂志, 2014, 24(15): 2170-2173. Yao M D. Determination of 49 pesticides in tea by solid phase extraction-gas chromatography/tandem mass spectrometry [J]. Chinese Journal of Health Laboratory Technology, 2014, 24(15): 2170-2173.
[22] 王兴宁, 蔡秋, 朱明, 等. 固相萃取净化-气相色谱/串联质谱法测定茶叶中54种农药残留量[J]. 分析试验室, 2011, 30(11): 110-116. Wang X N, Cai Q, Zhu M, et al. Determination of 49 pesticide residues in tea using solid-phase extraction and gas chromatography-triple quadrupole mass spectrometry [J]. Chinese Journal of Analysis Laboratory, 2011, 30(11): 110-116.
[23] Tewary D K, Kumar V, Ravindranath S D, et alDissipation behavior of bifenthrin residues in tea and its brew [J]. Food Control, 2005, 16(3): 231-237.
[24] Hou X, Lei S, Guo L, et al. Optimization of a multi-residue method for 101 pesticides in green tea leaves using gas chromatography-tandem mass spectrometry [J]. Revista Brasileira de Farmacognosia, 2016; 26(4): 401-407.
[25] Rajski Ł, Lozano A, Belmonte-Valles N, et al. Comparison of three multiresidue methods to analyse pesticides in green tea with liquid and gas chromatography/tandem mass spectrometry [J]. Analyst, 2013, 138(3): 921-931.
[26] Peng C F, Kuang H, Li X Q, et al. Evaluation and interlaboratory validation of a GC-MS method for analysis of pesticide residues in teas [J]. Chemical Papers, 2007, 61(1): 1-5.
[27] European Communities. Commission Decision 2002/657/EC of 12 August 2002 implementing Council Directive 96/23/EC concerning the performance of analytical methods and the interpretation of results [S]. Official Journal of the European Communities, 2002: 8-36.
[28] 全国认证认可标准化技术委员会实验室认可分技术委员会. 合格评定化学分析方法确认和验证指南: GB/T 27417—2017[S]. 北京: 中国标准出版社, 2017. Subcommittee 1 on Laboratory Accreditation of National Technical Committee 261 on Certification and Accreditation of Standardization Administration of China. Comformity assessment—Guidance on validation and verification of chemical analytical methods: GB/T 27417—2017 [S]. Beijing: Standards Press of China, 2017.
[29] 张新忠, 罗逢健, 陈宗懋, 等. 超高效液相色谱串联质谱法测定茶叶、茶汤和土壤中氟环唑、茚虫威和苯醚甲环唑残留[J]. 分析化学, 2013, 41(2): 215-222. Zhang X Z, Luo F J, Chen Z M, et al. Residue determination of epoxiconazole, indoxacarb and difenoconazole in tea, tea infusion and soil using ultra high performance liquid chromatography coupled with tandem mass spectrometry [J]. Chinese Journal of Analytical Chemistry, 2013, 41(2): 215-222.
[30] Chen G, Cao P, Liu R. A multi-residue method for fast determination of pesticides in tea by ultra performance liquid chromatography-electrospray tandem mass spectrometry combined with modified QuEChERS sample preparation procedure [J]. Food Chemistry, 2011, 125(4): 1406-1411.
[31] Díez C, Traag W A, Zommer P, et al. Comparison of an acetonitrile extraction/partitioning and “dispersive solid-phase extraction” method with classical multi-residue methods for the extraction of herbicide residues in barley samples [J]. Journal of Chromatography A, 2006, 1131(1/2): 11-23.
[32] Besil N, Cesio V, Heinzen H, et al. Matrix effects and interferences of different citrus fruits coextractives in pesticide residue analysis using ultra high-performance liquid chromatography—high-resolution mass spectrometry [J]. Journal of Agricultural and Food Chemistry, 2017: 65(23): 4819-4829.
[33] 中华人民共和国国家卫生健康委员会. 食品安全国家标准食品中农药最大残留限量: GB 2763—2019[S]. 北京: 中国农业出版社, 2019. National Health Commission of the People's Republic of China. National food safety standard—Maximum residue limits for pesticides in food: GB 2763—2019 [S]. Beijing: China Agriculture Press, 2019.
Determination of Pesticide Residue in Fresh Tea Leaves and Dry Tea by Solid Extraction and Dispersive Solid Extraction Cleanup Coupled with Tandem Mass Spectrum
YANG Jie1,2, ZHOU Li1*, YU Huan1,2, SUN Hezhi1, WANG Xinru1, ZHANG Xinzhong1, YANG Mei1, CHEN Zongmao1, LUO Fengjian1*
1. Research Center of Quality Safety for Agricultural Products, Tea Research Institute, Chinese Academy of Agricultural Sciences Hangzhou 310008, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China
A method for the determination of 9 pesticide residues in fresh and dry tea was established. Residual pesticides in samples were extracted by acetonitrile, purified by Florisil/GCB solid phase extraction column, followed by absorbent of PSA and GCB as dispersed solid phase, and determined by ultra-high performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) and gas chromatography-mass spectrometry (GC-MS). In the spiked range of 0.005-1.000 mg·kg-1, the average recoveries of target pesticides in fresh leaves and dried tea were 70.3%-103.9%, and the relative standard deviations (RSD) were less than 20%. In the range of 0.005-2.000 mg·kg-1, the linear relationship of target pesticides in fresh leaves and dry tea matrix was good, with>0.995 4. The limit of quantity (LOQ) was 0.005 mg·kg-1. The test results of actual samples showed that the method was highly sensitive and reproducible, and can meet the requirements of multi-residue detection.
multi-residue of pesticides, UPLC-MS/MS, GC-MS, tea, solid phase extraction, dispersive solid-phase extraction
世界首个“国际茶日”
2020年5月21日,是联合国确定的首个“国际茶日”。国家主席习近平向“国际茶日”系列活动致信表示热烈祝贺。
习近平指出,茶起源于中国,盛行于世界。联合国设立“国际茶日”,体现了国际社会对茶叶价值的认可与重视,对振兴茶产业、弘扬茶文化很有意义。作为茶叶生产和消费大国,中国愿同各方一道,推动全球茶产业持续健康发展,深化茶文化交融互鉴,让更多的人知茶、爱茶,共品茶香茶韵,共享美好生活。
茶是世界三大饮品之一,全球产茶国和地区达60多个,饮茶人口超过20亿。2019年12月,联合国大会宣布将每年5月21日确定为“国际茶日”,以赞美茶叶的经济、社会和文化价值,促进全球农业的可持续发展。今年“国际茶日”期间,我国农业农村部与联合国粮农组织、浙江省政府以“茶和世界共品共享”为主题,通过网络开展系列宣传推广活动。
5月21日下午,中国茶叶学会在线举办了“美美与共”云茶会。云茶会邀请了广大民众在同一时间一同饮茶,多地联动,打破时间和空间束缚,以“名家、名茶、名匠、民族”为核心展示内容。旨在分享茶健康知识,彰显制茶人匠心,展示茶民俗文化,提振疫情后产业信心,推广贫困地区茶品牌,带动茶农增收致富,体现我国茶业总体风貌,促进中国与世界各国茶文化交融互鉴和全球农业可持续发展。
S571.1;S482
A
1000-369X(2020)03-397-10
2019-09-27
2020-01-04
国家重点研发计划子课题(2016YFD0200207-2)、浙江省自然科学基金(LY18C16005)
杨洁,女,硕士研究生,主要从事茶园有害生物综合治理研究。*通信作者:lizhou@tricaas.com,lfj@tricaas.com
投稿平台:http://cykk.cbpt.cnki.net

