苯海拉明口腔溶解膜的制备及溶出度测定
王红霞, 李 雪, 丁平田
苯海拉明口腔溶解膜的制备及溶出度测定
王红霞1,2, 李 雪1,2, 丁平田1*
(1. 沈阳药科大学 药学院, 辽宁 本溪 117004; 2. 天津市聚星康华医药科技有限公司, 天津 300384)
制备苯海拉明口腔溶解膜并建立溶出度测定方法。运用掩味技术制备苯海拉明口腔溶解膜,采用高效液相色谱法进行溶出度测定。采用聚苯乙烯磺酸钠树脂掩味制备苯海拉明口腔溶解膜,以500 mL质量浓度为5 gL-1的十二烷基硫酸钠水溶液作为溶出介质,温度为 (37±0.5) ℃,转速为75 r·min-1,溶出方法与参比药品溶出行为一致。苯海拉明口腔溶解膜的制备方法简单可行,建立的溶出度测定方法适合苯海拉明口腔溶解膜溶出度的测定。
苯海拉明; 口腔溶解膜; 离子交换树脂; 溶出度
苯海拉明是一种乙醇胺类抗组胺药物,自19世纪40年代研发以来,作为抗组胺类非处方药物一直沿用至今。同时,苯海拉明的临床作用也被不断拓展,已发展成为可用于多种适应症的药物,如可用于治疗眩晕、过敏反应以及治疗术后药物引起的恶心、呕吐等;可用不同剂量苯海拉明治疗氯氮平引起的流涎;静脉滴注苯海拉明可用于治疗美尼尔氏综合征;与其他药物合用可作为镇静催眠成分发挥作用。苯海拉明为油状液体,不易与他辅料混合均匀,临床常用其盐的形式入药。
口腔膜剂是一种新的药物传递系统、载药多聚体膜剂,其大小、形状、厚度类似于邮票,将其置于舌上,在唾液中能快速溶解、释放药物。与常规药物剂型相比,口腔膜剂有很多优点:1.对于局部作用的药物来说,可以直接作用于病灶,提高了生物利用度;2.对于全身作用的药物来说,活性物质可经口腔黏膜直接吸收,避免了首过效应;3.不需要用水送服,没有堵塞喉咙的危险,适合儿童和老年患者服用,提高了患者的顺应性;4.携带方便。经多种应用证实,该剂型与其他口服剂型相比,在耐受性、顺应性及生物利用度等方面均具有优势。本研究以聚苯乙烯磺酸钠树脂对盐酸苯海拉明原料进行掩味,再制备苯海拉明口腔溶解膜,并采用高效液相色谱法对其溶出度进行测定。
1 材料与仪器
盐酸苯海拉明(启东东岳药业有限公司)、聚苯乙烯磺酸钠树脂(陶氏化学有限公司)、麦芽糊精(山东西王药业有限公司)、甘油(湖南尔康制药股份有限公司)、羟丙甲基纤维素(安徽山河药用辅料股份有限公司)、三氯蔗糖(盐城捷康三氯蔗糖制造有限公司)、蓝莓香精(天津香源商贸有限公司)、草莓红色素(天津奥凯化工贸易有限公司)、枸橼酸钠(湖南华日制药有限公司)。
PTC-10A TG-DTA分析仪(日本理学公司);magna-560傅里叶变换红外光谱仪(美国Nicolet公司);Waters 2695-996高效液相色谱仪(美国沃特世公司);AUW120D分析天平(日本岛津公司);加热式磁力搅拌器(予华仪器);电热鼓风干燥箱(中兴伟业);XT-200CA型自动涂布机(奥斯派贸易);ZRS-8G药物溶出仪(海益达科技);盐酸苯海拉明对照品(中国药品生物制品检定所,批号100066-200807);Children's Triaminic Thin Strips®参比药品(Novartis Consumer Health,批号:111256,按C17H21NO·HCl计,含量为99.9%);苯海拉明口腔溶解膜(本实验室研制,规格:25 mg,批号:20140301);乙腈、乙酸和三乙胺为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 药树脂的制备及鉴别
2.1.1 药树脂的制备
取盐酸苯海拉明原料药适量,用枸橼酸钠水溶液制成质量浓度为25 gL-1的药物溶液,再加入聚苯乙烯磺酸钠离子树脂(IRP69树脂),原料药与树脂的质量比为1︰1,30 ℃下避光搅拌1 h,过滤。滤饼用适量纯水洗涤2次,烘箱干燥,即得药树脂复合物。药树脂复合物中药物含量测定结果为47.32%。
2.1.2 药树脂的鉴别
2.1.2.1 差示扫描量热法分析(DSC)
测试条件:以空铝坩埚为参考池,另一铝坩埚为样品池,分别放入盐酸苯海拉明原料药、IRP69树脂、盐酸苯海拉明原料药与树脂质量比为1︰1的物理混合物、盐酸苯海拉明药树脂复合物,扫描速度10 ℃·min-1;扫描范围:室温~400 ℃,空气氛围。扫描结果见图1。

Fig.1 DSC curves of IRP69 (A), diphenhydramine hydrochloride (B), diphenhydramine hydrochloride physically mixed with IRP69 (C) and diphenhydramine hydrochloride medicinal resin (D)



Continued Fig.1
由图1A可知,单独IRP69树脂无吸热峰,盐酸苯海拉明原料药在171 ℃有明显的吸热峰(图1B),盐酸苯海拉明原料药与树脂物理混合物中也在171 ℃有明显的吸热峰(图1C),而盐酸苯海拉明药树脂复合物中该吸热峰消失(图1D),表明盐酸苯海拉明原料药与树脂不是简单的物理混合,而是通过化学键结合。
2.1.2.2 红外光谱法分析(IR)
测试条件:溴化钾压片法。谱区范围:4000 cm-1~400 cm-1。扫描结果见图2。


Continued Fig. 2
由图2可知,在单纯阳离子树脂中,3 443 cm-1处产生的吸收峰主要是由残留的水分引起,1 177 cm-1和1 126 cm-1处分别为强的磺酸基团S=O反对称伸缩振动吸收峰和对称伸缩振动吸收峰,盐酸苯海拉明药树脂复合物中出现了2 566 cm-1处的叔胺盐的N-H伸缩振动峰,而且存在1 103 cm-1处的C-N伸缩振动峰,1 070 cm-1处的C-O-C不对称伸缩振动峰,699 cm-1处的苯环单取代C-H面外弯曲振动特征峰,以上为盐酸苯海拉明的特征峰,表明苯海拉明被成功结合到聚丙烯酸磺酸钠树脂上。
2.2 口腔溶解膜的制备
2.2.1 成膜材料的制备
称取羟丙甲基纤维素(E-15)15 g,置于烧杯中,加水至总质量为100 g,搅拌分散均匀,静置8 h以上,使其充分溶解成澄清或微浑浊的胶体溶液备用。
2.2.2 胶液的配制
称取枸橼酸钠2 g,加水至55 g,搅拌使溶解,加入草莓红色素溶液5 g,搅拌使混合均匀,分别称取三氯蔗糖(3 g)、麦芽糊精(10 g)、蓝莓香精(0.5 g)、甘油(10 g),依次加入烧杯中,搅拌10 min,再加入预先制备的成膜材料100 g,搅拌均匀,缓慢加入药树脂适量(约50 g),边加边搅拌,静置消泡后备用。
2.2.3 成膜
设定涂膜机的铺膜厚度,将所得胶液涂布、干燥、分切,制得长宽为20 mm × 30 mm、厚约200 µm的口腔溶膜,规格为25 mg。膜片表面平整,溶化时限为15 s左右,志愿者试药口感良好。
2.3 溶出度测定
2.3.1 色谱条件
色谱柱:色谱柱:Welch Ultimate®XB-CN(250 mm × 4.6 mm,5 µm);流动相:乙腈-体积分数1.0%三乙胺(体积比35︰65),用乙酸调pH值至6.0;检测波长:258 nm;流速:1.0 mL·min-1;柱温:35 ℃。
2.3.2 对照品溶液制备
精密称取盐酸苯海拉明对照品适量,用溶出介质溶解并稀释成每1 mL约含盐酸苯海拉明50 µg的溶液,作为对照品溶液。
2.3.3 溶出介质选择
根据化学药品研究指导原则,对于普通口服制剂的溶出行为考察需在pH 1.2~6.8范围内进行。为了掩盖盐酸苯海拉明的不良口感(苦、麻),膜剂制备过程采用了离子交换树脂作为味道掩蔽剂,所以结合本剂型的实际特点对溶出介质进行了筛选。分别以500 mL水、pH 1.0盐酸溶液、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液和质量浓度为5 gL-1的十二烷基硫酸钠水溶液作为溶出介质,温度为(37±0.5) ℃,转速为75 r·min-1,检测了本品在不同介质中的溶出情况,测定结果见表1,溶出曲线见图3。
Table.1 The accumulative dissolution percentage of prepared films in different mediums
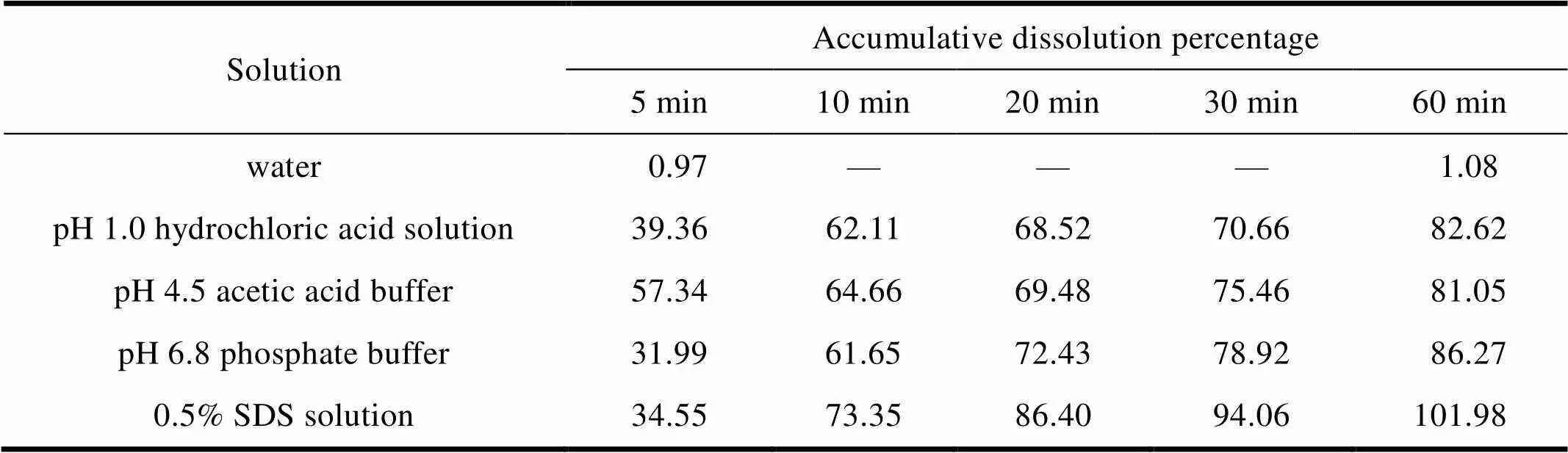
表1 自制膜剂在不同溶出介质中的累积溶出百分率测定结果

—water;—pH 1.0 hydrochloric acid solution;—pH 4.5 acetic acid buffer;—pH 6.8 phosphate buffer;—0.5% SDS solution
根据苯海拉明口腔溶解膜在不同介质中累积溶出百分率可知,本品主药成分在水中60 min的累积溶出百分率为1.08%,几乎不溶;在pH 1.0盐酸溶液、pH 4.5醋酸盐缓冲液和pH 6.8磷酸盐缓冲液这三种溶出介质中基本均不能很好的溶出,30 min累积溶出百分率分别约为70.66%、75.46%和78.92%,均低于80%;在质量浓度为5 gL-1的十二烷基硫酸钠溶出介质中30 min累积溶出百分率为94.06%,因此,选择质量浓度为5 gL-1的十二烷基硫酸钠作为溶出介质。
2.3.4 专属性试验
空白溶剂:取溶出介质(质量浓度为5 gL-1的十二烷基硫酸钠溶液)作为空白溶剂。
空白膜溶液的制备:取无原料药的空白膜适量,按“2.3.2”项下配制。
对照品溶液的制备:按“2.3.2”项下配制。
原料药溶液的制备:取盐酸苯海拉明原料药适量,按“2.3.2”项下配制。
制剂样品溶液的制备:取苯海拉明口腔溶解膜样品适量,按“2.3.2”项下配制。
将上述各供试品溶液照“2.3.1”项下的色谱条件,分别进样,记录色谱图,考察空白溶剂和全辅料的干扰情况,实验结果见图4。
由图4可知,空白溶剂和全辅料对主药成分溶出度的测定均无干扰,可见选择高效液相色谱法测定本品的溶出度有良好的专属性。


Continued Fig. 4
2.3.5 线性关系与范围
供试品溶液的制备:取盐酸苯海拉明对照品适量(约25 mg),精密称定,置50 mL量瓶中,用质量浓度为5 gL-1的十二烷基硫酸钠溶解并稀释至刻度,摇匀,作为对照品储备液;分别精密量取对照品储备液0.2、0.4、0.6、0.8、1.0 mL,置于10 mL量瓶中,用质量浓度为5 gL-1的十二烷基硫酸钠稀释至刻度,摇匀,即得不同质量浓度的供试品溶液。
照“2.3.1”项下的色谱条件,测定峰面积。以峰面积()为纵坐标,实际进样浓度(mg·L-1)为横坐标,绘制标准曲线,得回归方程为= 4.466 3×103- 4.439×103,= 0.9999。结果表明,在9.99~49.96 mg·L-1范围内,质量浓度与峰面积呈良好线性关系。
2.3.6 精密度试验
取样品剪碎,称取适量用溶出介质制成浓度约为50 mg·L-1的样品溶液,将该样品溶液连续进样6次,峰面积相对标准偏差RSD为0.22%,小于2.0%,表明仪器精密度良好。
2.3.7 稳定性试验
取样品按“2.3.2”项下配制,作为供试品溶液。室温放置,分别于0、1、2、4、8、24 h进样20 μL,记录色谱图,以峰面积计算RSD = 0.62%,结果表明供试品室温放置24 h稳定性良好。
2.3.8 重复性试验
取同批样品6份,按溶出度实验制备供试品溶液,按照“2.3.1”项下色谱条件测定,苯海拉明峰面积RSD为0.6%,表明本方法重复性良好。
2.3.9 回收率试验
对照品溶液的制备:按“2.3.2”项下配制。
供试品溶液的制备:按照处方量精密称量全辅料适量,分别置50 mL的量瓶中,精密称取3份盐酸苯海拉明原料药分别置于量瓶中,用质量浓度为5 gL-1的十二烷基硫酸钠溶解并稀释至刻度,制成浓度分别为60%、80%、100%的供试品溶液,按照“2.3.1”项下色谱条件测定,每个浓度平行测定3次,并计算回收率。

Table 2 The recovery rates of diphenhydramine orally dissolving films
结果表明,三个浓度的回收率分别为99.24%、99.53%、100.06%,均在98.0%~102.0%以内,平均回收率为99.61%,RSD为0.68%,结果表明该方法测定本品的回收率良好。
2.3.10 溶出度测定
取本品6片,照溶出度测定法(《中国人民共和国药典》2015年版四部通则0931第二法),以质量浓度为5 gL-1的十二烷基硫酸钠水溶液500 mL为溶出介质,温度为(37±0.5) ℃,转速为75 r·min-1,依法测定,分别在5、10、20、30、60 min取溶液适量(同时补充等量溶出介质),滤过,取续滤液作为供试品溶液。精密称取盐酸苯海拉明对照品适量(约25 mg),置于50 mL量瓶中,用质量浓度为5 gL-1的十二烷基硫酸钠溶解并稀释至刻度,摇匀,精密量取1 mL,置于10 mL量瓶中,用质量浓度为5 gL-1的十二烷基硫酸钠稀释至刻度,摇匀,即得对照品溶液。
取上述对照品溶液和供试品溶液,按照“2.3.1”项下色谱条件测定,按外标法以峰面积计算每片的溶出量。结果显示,拟定处方膜剂在该溶出介质中小试样品、中试样品与参比药品(国外上市苯海拉明膜剂)的2均大于50,体外溶出行为相似,其溶出参数无显著差异。

Table 3 The accumulated release rates of diphenhydramine orally dissolving films in 0.5% SDS solution

—small experiment;—production samples;—commercial products
3 讨论
为了满足吞咽传统固体制剂有困难的老年及儿童患者的需求,速溶给药系统作为片剂、胶囊及糖浆的替代品问世,2001年辉瑞制药首先在市场上推出口腔分散膜。药物的口味是影响患者服药顺应性的主要因素,盐酸苯海拉明原料味苦、麻,本研究中采用离子交换技术制成药物树脂复合物可有效掩盖其苦味。因药树脂制备的膜剂在口腔中停留短暂,且口腔中唾液量较少、离子浓度很低,药物不易解离,因此可以掩盖药物的不良味道。当药树脂进入到胃肠道时,丰富的钠、钾离子可促使药物迅速释放。
《美国药典》(USP35-NF30)中盐酸苯海拉明胶囊溶出度测定方法为篮法,以水为溶出介质,体积为500 mL,转速为100 r·min-1,取样时间为30 min,限度为不低于标示量的80%;《中国人民共和国药典》2015年版二部中盐酸苯海拉明片溶出度测定方法为桨法,以水为溶出介质,体积为500 mL,转速为100 r·min-1,取样时间为45 min,限度为不低于标示量的75%。结合本品制剂特点选择质量浓度为5 gL-1的十二烷基硫酸钠作为溶出介质,体积为500 mL,转速为75 r·min-1。经验证,此法操作简单、准确,方法学可靠,适合苯海拉明口腔溶解膜溶出度的测定。
[1] 国家药典委员会. 中华人民共和国药典临床用药须知-化学药和生物制品卷(2010年版)[M]. 北京:中国医药科技出版社, 2011.
[2] The United States Pharmacopeial Convention. United States Pharmacopeia (USP35)[M]. U.S.:United Book Press, Inc., Baltimore, MD, 2012, 5457-5458.
[3] 翟成. 抗组胺药物概述(综述)[J]. 中国城乡企业卫生, 2011,(5): 50-53.
[4] 陈芳, 夏怡然, 侯惠民. 口腔膜剂的研发及应用[J]. 中国医药工业杂志, 2012,43(6): 484-489.
[5] 赵伟, 康静, 王红霞. 口腔速溶膜剂及其应用[J]. 天津药学, 2013,25(4): 60-64.
[6] 沃尼尔·朗伯公司. 含有作为味道掩蔽剂的离子交换树脂的快速口溶食用膜:中国, 01806998.3[P]. 2001-01-23.
[7] 国家药典委员会. 中华人民共和国药典2015年版2部[M]. 北京:中国医药科技出版社, 2016.
[8] 谢沐风. 溶出曲线相似性评价方法[J]. 中国医药工业杂志, 2009,40(4): 308-311.
Preparation and dissolution evaluation of diphenhydramine orally dissolving film
WANG Hongxia1,2, LI Xue1,2, DING Pingtian1*
(1.,,117004,; 2.300384)
To prepare diphenhydramine orally dissolving film and establish dissolution determination method.The taste-dissolving technique was used to prepare diphenhydramine orally dissolving film, and the dissolution rate was determined by HPLC.This study used sodiumpolystyrene sulfonate resin to mask the taste of API to prepare diphenhydramine orally dissolving film. 500 mL of sodium dodecyl sulfate aqueous solution (5 g·L-1) was used as the dissolution medium; the temperature was (37± 0.5) ℃; the rotation speed was 75 r·min-1. And the dissolution rate was consistent with the reference drug dissolution behavior.The preparation method of diphenhydramine orally dissolving film is simple and feasible, and the established dissolution method is suitable for the determination of the dissolution rate of diphenhydramine orally dissolving film.
diphenhydramine; orally dissolving film; ion exchange resin; dissolution
2019-08-12
王红霞(1982-), 女(汉族), 天津人, 中级工程师, 在读硕士, 主要从事药物新剂型研究, Tel. 022- 60383875, E-mailwhx_tj@126.com.
丁平田(1969-), 男(汉族), 山东省济南人, 教授, 博士,博士生导师, 主要从事药物新剂型和新技术研究, Tel. 024-23986305, E-mail dingpingtian@qq.com。
R94
A
(2020)03–0135–12
10.14146/j.cnki.cjp.2020.03.001

